混合模式层析分离纯化超螺旋质粒DNA
张鹏程, 谭远志, 孙艳娜, 张其磊, 姚善泾, 林东强
混合模式层析分离纯化超螺旋质粒DNA
张鹏程, 谭远志, 孙艳娜, 张其磊, 姚善泾, 林东强
(浙江大学生物质化工教育部重点实验室, 浙江省智能生物材料重点实验室,浙江大学 化学工程与生物工程学院, 浙江 杭州 310058)
针对细胞裂解液中的超螺旋质粒DNA (sc pDNA)的分离,以质粒pVAX1为典型对象、采用Capto PlasmidSelect作为混合模式层析介质,探讨了料液中主要成分sc pDNA、开环质粒DNA (oc pDNA)和RNA的吸附行为,优化了分离条件,实现了从成分较为复杂的料液中高效分离sc pDNA。考察了上述3种组分的静态吸附,发现在(NH4)2SO4浓度(NH4)2SO4为1.9~2.5 mol×L-1时,sc pDNA均具有较高的吸附量,确定(NH4)2SO4=2.5 mol×L-1的料液可直接上样,此时sc pDNA饱和吸附量为每克介质吸附3.3 mg。动态吸附实验发现,sc pDNA穿透略晚于oc pDNA,sc pDNA动态载量为每毫升介质负载2.00 mg,RNA吸附能力明显强于pDNA。进一步优化了洗脱、冲洗和上样量等分离条件,采用(NH4)2SO4=2.5 mol×L-1上样、(NH4)2SO4=1.9 mol×L-1冲洗、((NH4)2SO4=1.7 mol×L-1)+(NaCl= 0.3 mol×L-1)洗脱,sc pDNA纯度可达83.9%、同质性高达95.8%、收率为80.6%。结果表明,混合模式层析对sc pDNA选择性好、处理量较大,具有良好的应用价值。
超螺旋质粒DNA;吸附;混合模式层析;核酸分离
1 前 言
近年来,随着生物技术的快速发展,基因治疗在生物医药领域越来越受到关注,目前已有多个基因治疗产品获得美国食品和药物管理局(FDA)或欧洲药品管理局(EMA)批准[1]。
质粒DNA(pDNA)是一种小型环状DNA,在基因治疗中可以作为DNA疫苗直接参与疾病防控,也可以作为病毒载体或mRNA等药物的生产原料[2]。pDNA存在三种不同构象:超螺旋(supercoiled,sc),开环(open circular,oc)和线性(linear,ln)。作为基因治疗药物,pDNA存在转染效率低的缺点,大约1 000个分子中只有1个能进入细胞并被表达[3]。研究表明,超螺旋质粒DNA (supercoiled plasmid DNA,sc pDNA)具有更高的细胞转染效率[4],因此,如何制备高同质性即高超螺旋比例的pDNA是关键。FDA对pDNA产品中杂质含量做了详细规定[5],其中RNA因电荷和疏水性存在较大差异而较容易分离,oc pDNA和sc pDNA相对分子质量及总带电量相近,差别仅在于局部电荷密度以及sc pDNA过旋引起的碱基暴露[6],因此如何有效分离oc pDNA和sc pDNA成为pDNA纯化过程的关键。
pDNA分离方法有沉淀[7]、膜分离[8]、双水相萃取[9]、固相萃取[10]、磁性纳米颗粒吸附[11]等,但普遍存在分离效果有限、收率低等问题,而层析具有更精细的分离效果。Valente等[12]使用精氨酸大孔亲和层析,从澄清的细胞裂解液中分离出pcDNA3-FLAG-p53(碱基对数量为6 070 bp),采用NaCl浓度NaCl=120 mmol×L-1的洗脱液使oc pDNA和RNA洗脱,再升高NaCl至160 mmol×L-1使sc pDNA洗脱,得到的sc pDNA纯度为92%,但收率仅为43%;作者进一步通过试验设计法(DoE)优化制备了O-磷--酪氨酸介质,sc pDNA纯度提高到98.2%,但收率仍只有49.7%[13]。Santos等[14]采用-酪氨酸作为亲和配基分离pPH600质粒(碱基对数量为3 562 bp),纯度为98.2%、收率为56.3%,但介质的动态载量较低。Bicho等[15]采用乙二胺作为离子交换配基制备整体柱用于pDNA分离,sc pDNA纯度为97.1%、收率为47.0%。疏水相互作用层析也有报道[16],可达到98%的同质性和96%的收率,但需要偶联其他分离步骤。整体而言,sc pDNA分离仍有较大挑战,难以同时达到高纯度与高收率。
混合模式层析是一种兼有多种分子相互作用的新型层析分离方法[17-20]。pDNA分离涉及的3种主要核酸成分既有荷电性质的差异,也有疏水性的差异,因而利用混合模式层析纯化更具有优势。Silva-Santos等[21]使用Capto adhere介质,得到92.2%同质性的sc pDNA;又采用胍丁胺整体柱,获得纯度为98.3%的sc pDNA,收率为51.8%[22]。近些年新推出的混合模式介质Capto PlasmidSelect是以2-巯基吡啶为配基,兼有离子和疏水相互作用,对sc pDNA具有较好的选择性。本研究针对sc pDNA分离,采用Capto PlasmidSelect作为混合模式介质,澄清的细胞裂解液直接上样,考察该介质对分离过程中主要成分sc pDNA、oc pDNA 和RNA的吸附和分离性能,优化冲洗、洗脱、上样量等分离条件,实现sc pDNA的高效分离。
2 材料与方法
2.1 材料
混合模式介质Capto PlasmidSelect,Cytiva公司;质粒pVAX1(碱基对数量为3.0 kbp),武汉淼灵生物科技有限公司;质粒纯化中量试剂盒,上海生工生物工程有限公司;CIMac pDNA分析柱,BIA Separations公司;超滤离心管(0.5 mL,截留分子量为10 000),Millipore公司;其他试剂为市售分析纯。AKTA层析系统,GE Healthcare公司。
2.2 菌体培养
取少量经pVAX1转化的DH5a大肠杆菌,在含有卡那霉素100 mg×mL-1的固体溶菌肉汤(LB)培养基上37 ℃下活化24 h,挑取单菌落经两级扩大培养,以2%的接种量接入250 mL、含100 mg×mL-1卡那霉素的液体LB培养基,在220 r×min-1、37 ℃条件下摇床培养12~16 h。
2.3 pDNA初步提取
采用改良的碱裂解法进行pDNA初步分离。细菌培养液经4 000 r×min-1离心30 min,取沉淀物用10 mL溶液I(葡萄糖浓度Glu=50 mmol×L-1、三羟甲基氨基甲烷浓度Tris= 25 mmol×L-1、乙二胺四乙酸浓度EDTA=10 mmol×L-1,pH=8.0)重悬,加入15 mL溶液II(NaOH= 0.2 mol×L-1、SDS 的质量浓度为0.01g×mL-1)进行裂解,室温下放置5 min,立即加入12 mL溶液III(醋酸钾浓度KAc= 3 mol×L-1,pH=5.5)中和,此时产生大量絮状沉淀。冰浴20 min,10 000 r×min-1下离心30 min,取上清液加入0.6倍体积的异丙醇,室温放置30 min使其充分沉淀,10 000 r×min-1下离心20 min,将收集到的沉淀物用少量质量分数为70%的乙醇洗涤,自然挥发掉多余的乙醇。用5 mL、Tris=10 mmol×L-1的Tris-HCl缓冲液(pH=8.0)重悬,加入(NH4)2SO4至(NH4)2SO4= 2.5 mol×L-1,冰浴15 min使部分RNA和蛋白质析出,10 000 r×min-1下离心20min,得到上清液作为初分离料液,用于后续分离。料液中含有sc pDNA 0.82 mg×mL-1、oc pDNA 0.16 mg×mL-1和RNA 1.63 mg×mL-1。
2.4 静态吸附测定
取适量Capto PlasmidSelect介质,用去离子水充分清洗,抽干后用(NH4)2SO4= 2.5 mol×L-1、Tris=10 mmol×L-1的缓冲液(pH=7.5)平衡30 min,再抽滤15 min。称取约0.03 g介质置于2 mL离心管,将上述初分离料液pH值调至7.5,稀释成8种不同浓度,分别取0.8 mL加入装有介质的离心管,25℃、1 200 r×min-1下恒温混匀仪振荡3 h,充分吸附达到平衡;3 000 r×min-1下离心2 min,使吸附介质沉降,得到上清液,经孔径为0.22mm的滤膜过滤,用高效液相色谱(HPLC)分析各组分的平衡质量浓度(mg×mL-1)。根据物料衡算得到sc pDNA、oc pDNA和RNA这3种核酸的吸附量(mg×g-1),采用Langmuir 吸附平衡式对吸附等温线进行拟合,得到饱和吸附量m(mg×g-1)和结合常数a(mL×mg-1),具体如下:

2.5 动态载量测定
将Capto PlasmidSelect介质1 mL装填于Tricorn 5/50层析柱(Cytiva公司)。初分离料液pH值调至7.5,经孔径为0.45mm的滤膜过滤后作为上样料液,上样流速为200 cm×h-1。上样前用(NH4)2SO4=2.5 mol×L-1的平衡缓冲液(pH=7.5)充分平衡介质,上样后收集流穿组分,用HPLC分析流穿液中sc pDNA、oc pDNA和RNA的质量浓度,分别绘制穿透曲线,计算10% 穿透时的动态载量。上样完成后,用EDTA=10 mmol×L-1、Tris=100 mmol×L-1的缓冲液(pH=7.5)洗脱,并用NaOH=1 mol×L-1的清洗液进行清洗再生。
2.6 分离条件优化
用EDTA=10 mmol×L-1、Tris=100 mmol×L-1的缓冲液(pH=7.5)配制5种不同浓度的(NH4)2SO4与NaCl的混合盐溶液(如1.5 mol×L-1(NH4)2SO4与0.5 mol×L-1NaCl混合溶液,其他配比为1.6+0.4、1.7+0.3、1.8+0.2、1.9+0.1)作为洗脱液。首先以(NH4)2SO4=2 mol×L-1、Tris=100 mmol×L-1的缓冲液(pH =7.5)作为冲洗液,考察上述混合盐洗脱液的浓度对洗脱效果的影响,即收集洗脱液,HPLC分析sc pDNA纯度、同质性和收率。确定洗脱条件后,进一步考察冲洗条件和不同上样量(2、5、10 mL)对纯化效果的影响。
2.7 凝胶电泳
称取0.4 g琼脂粉溶于50 mL 1xTAE缓冲液制成凝胶,加入体积分数为1%的核酸染料4S Green Plus。样品上样量为6mL (5mL样品+1mL DNA上样缓冲液),DNA Marker上样量为5mL,110 V恒压电泳35 min,黑暗条件紫外灯下观察电泳条带并拍照,用Image J软件对图像进行分析。
2.8 HPLC分析
分析柱为CIMac pDNA 0.3 mL Analytical Column,上样条件为NaCl=0.725 mol×L-1、Tris=10 mmol×L-1、pH=8.0,洗脱梯度设置为NaCl=0.725~0.85 mol×L-1,最后用NaCl=1 mol×L-1的溶液进行再生。流量为1 mL·min-1,上样体积为20mL,检测波长为260 nm,室温下进行。sc pDNA的纯度和同质性计算式如下:

式中:sc、oc、all分别为sc pDNA、oc pDNA和全部峰面积。
3 结果与讨论
3.1 静态吸附性能
初分离料液中含有sc pDNA、oc pDNA,以及未去除完全的RNA和少量其他杂质,下面考察Capto PlasmidSelect 介质对不同组分的静态吸附情况。根据预实验的结果,首先选择(NH4)2SO4=2.5 mol×L-1、Tris=10 mmol×L-1的缓冲液(pH=7.5)。为了考察盐浓度对吸附的影响,还比较了(NH4)2SO4=1.9 mol×L-1时的吸附,具体结果见图1~3。由图1可见,两种盐浓度下的m比较接近,分别为3.3和3.4 mg×g-1,这表明盐浓度对sc pDNA吸附影响较小。但结合常数a有差异,比较3个组分吸附情况,可以发现(NH4)2SO4从2.5降到1.9 mol×L-1时,sc pDNA吸附量略有增高,而oc pDNA和RNA则有所降低,原因可能在于本研究采用的是混合模式介质,配基为2-巯基吡啶,与目标物结合存在疏水、静电和亲硫等复杂作用,sc pDNA、oc pDNA、RNA在电荷密度(scpDNA>ocpDNA>RNA)及疏水性(RNA>sc pDNA>oc pDNA)方面存在差别,因此,随盐浓度增大,sc pDNA呈现与oc pDNA和RNA不同的变化趋势。

图1 Capto PlasmidSelect介质对sc pDNA的吸附等温线(pH=7.5)

图2 Capto PlasmidSelect介质对oc pDNA的吸附等温线(pH=7.5)
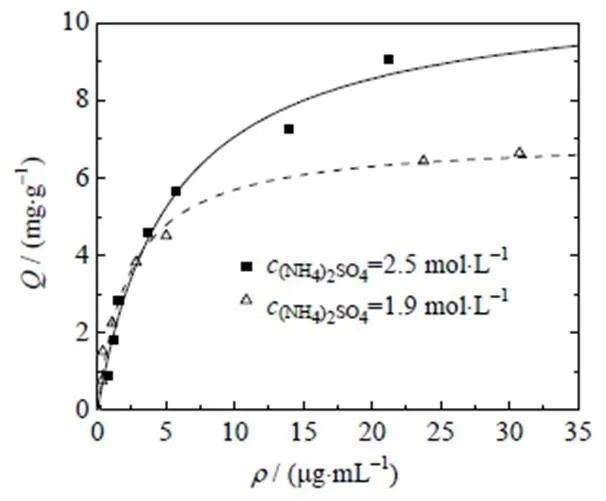
图3 Capto PlasmidSelect介质对RNA的吸附等温线(pH=7.5)
根据上述结果,当初分离料液中(NH4)2SO4=2.5 mol×L-1时,可直接作为上样料液,此时,目标物sc pDNA有较好的吸附能力;(NH4)2SO4=1.9 mol×L-1的溶液可作冲洗液,能去除大部分oc pDNA,从而提高sc pDNA的分离效果。由于RNA在(NH4)2SO4=2.5或1.9 mol×L-1的溶液中都具有较高的结合能力,故尚需优化洗脱,以便更好地进行核酸分离。
3.2 动态吸附性能
在静态吸附结果基础上,进一步考察pH=7.5、(NH4)2SO4=2.5 mol×L-1的含pDNA的料液动态载量,选择线性流速为200 cm×h-1,三组分的穿透曲线如图4所示,0为上样料液的质量浓度,mg×mL-1。由图可见,sc pDNA和oc pDNA达到10%穿透的时间相近,其中oc pDNA略早一些,表明二者可能不存在竞争性吸附。相对而言,sc pDNA穿透曲线更平缓,表明吸附能力强,这可能与超螺旋结构空间位阻较小有关。sc pDNA的动态载量为每毫升介质负载2.00 mg,oc pDNA为每毫升介质负载0.32 mg。图中还可以发现,当sc pDNA和oc pDNA接近饱和吸附状态时,RNA仅有少量穿透 (小于5%),这与3.1节的静态吸附结果一致,表明RNA对pDNA吸附没有显著影响,推测RNA吸附有可能为非特异性吸附,并不占据pDNA的吸附位点。

图4 200 cm×h-1流速下Capto PlasmidSelect介质对sc pDNA、oc pDNA和RNA的穿透曲线
3.3 分离条件优化
3.3.1 洗脱条件
根据sc pDNA、oc pDNA和RNA在电荷密度(sc pDNA>oc pDNA>RNA)及疏水性(RNA>sc pDNA>oc pDNA)方面的差异,以及预实验结果,发现对于混合模式介质Capto PlasmidSelect,适当的(NH4)2SO4可以促进sc pDNA结合,降低(NH4)2SO4和添加少量NaCl可以改变sc pDNA和oc pDNA与介质的结合状态。因此,选择在(NH4)2SO4=2 mol×L-1与((NH4)2SO4=1.5 mol×L-1)+(NaCl=0.5 mol×L-1)之间设置等梯度的洗脱条件,以便考察不同盐浓度对sc pDNA纯度、同质性和收率影响。上样2 mL、(NH4)2SO4=2 mol×L-1下冲洗,不同盐浓度的等梯度洗脱曲线见图5,UV,260nm表示260 nm下的紫外响应值。由图可见,((NH4)2SO4=1.9 mol×L-1)+(NaCl=0.1 mol×L-1)条件下,sc pDNA无法洗脱。随着(NH4)2SO4降低以及NaCl升高,洗脱条件逐渐苛刻,质粒峰后会跟随一个不可忽略的峰,如图中((NH4)2SO4=1.5 mol·L-1)+(NaCl=0.5 mol×L-1)时的曲线,经电泳分析发现该峰富含RNA,从而影响sc pDNA纯度。此外,发现不同盐浓度洗脱条件对sc pDNA的同质性无显著影响。综合比较纯度、同质性和收率 (见图6),选择((NH4)2SO4=1.7 mol×L-1)+(NaCl= 0.3 mol×L-1)为最佳洗脱条件,此时sc pDNA纯度为80.9%、同质性达到91.5%、收率为73.7%。

图5 不同盐浓度的洗脱HPLC谱图

图7 sc pDNA、oc pDNA和RNA的层析分离图谱(2 mL上样)
最佳洗脱条件下sc pDNA、oc pDNA和RNA三组分的层析分离结果见图7。由图可见,在洗脱开始阶段,oc pDNA少量解吸,然后sc pDNA大量洗脱,因此收集洗脱液应以oc pDNA的小峰之后、sc pDNA峰之前为起点。RNA始终有一个小的洗脱平台,只在sc pDNA之后才大量洗脱。综合考虑收率和纯度,确定合适的收集洗脱液区间应为sc pDNA出峰之后的2~3 mL。
3.3.2 冲洗条件
上述结果表明,(NH4)2SO4=2.0 mol·L-1下的冲洗效果不佳。为了减少洗脱液收集组分中oc pDNA含量,需进一步对冲洗阶段盐浓度进行优化。不同(NH4)2SO4下冲洗的层析分离谱图如图8所示。由图可见,将冲洗液中(NH4)2SO4由2.0 mol·L-1略微降低至1.9 mol×L-1,可以冲洗出更多的oc pDNA,同时不会影响sc pDNA。原本在洗脱阶段才能解吸的部分oc pDNA在冲洗过程中被去除,降低了洗脱峰中杂质oc pDNA的含量。优化后,洗脱峰中sc pDNA纯度从80.9%提高至87.6%、同质性从91.5% 提高至95.7%、收率则基本保持不变。
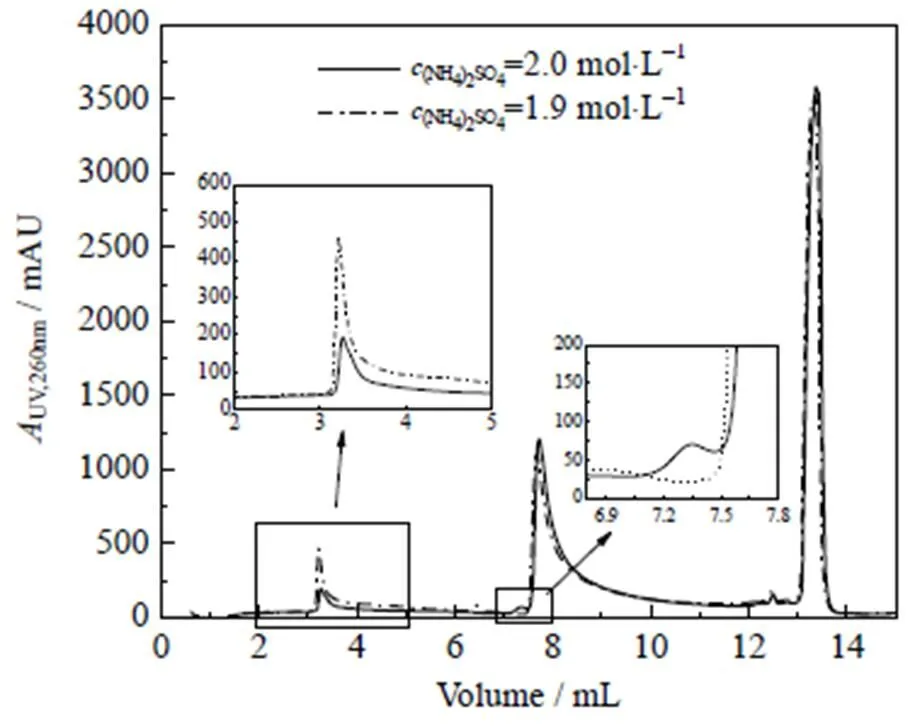
图8 不同盐浓度冲洗的层析分离谱图
3.3.3 上样量影响
根据动态吸附实验结果,合适的上样量为5~10 mL,既达到较大处理量,又避免了sc pDNA穿透。采用优化的冲洗和洗脱条件,比较了不同上样量的sc pDNA分离结果(见图9)。由图可见,上样量从2 mL增大到5 mL,对各组分的吸附和洗脱分离行为没有显著影响,仅仅为量级的差别。当上样量继续增大至10 mL时,冲洗峰出现异常增大,洗脱峰也较预期偏小。再通过HPLC分析(见图10)发现,冲洗峰中含有大量sc pDNA,导致收率显著降低到59.2%。可能原因是,随上样量增大,部分sc pDNA处于弱结合状态,导致容易被冲洗掉而影响收率。

图9 不同上样量的层析分离谱图

图10 不同上样量下冲洗峰的HPLC分析比较
最终确定最佳上样量为5 mL,此时核酸分离得到sc pDNA纯度为83.9%、同质性达到95.8%、收率为80.6%。Valente等[12]采用精氨酸大孔介质从细菌裂解液中分离pDNA,得到纯度为92%的sc pDNA,但收率仅为43%,动态载量也仅有每毫升介质负载0.256 mg。Bicho等[15]使用乙二胺整体柱,分离得到纯度为97.1% 的sc pDNA,收率仅为47.0%,且处理体积仅为20mL,单次获得的总sc pDNA量仅为2.55mg,而本研究单次可获得sc pDNA约为每毫升介质负载0.465 mg。与文献相比,本研究获得的sc pDNA纯度较低,主要是由于初分离料液中RNA含量较大,造成洗脱过程中RNA的部分解吸,后续可通过初分离去除RNA或后续核酸分离提高sc pDNA纯度。
4 结 语
采用新型混合模式层析介质Capto PlasmidSelect分离料液中的sc DNA。探讨了料液中主要组分sc pDNA、oc pDNA和RNA的吸附行为,测定了其动态载量,并优化了层析分离过程冲洗、洗脱条件及上样量。在(NH4)2SO4=2.5 mol×L-1条件下,成分较为复杂的料液中sc pDNA的饱和吸附量达到每克介质吸咐3.3 mg,故料液可不进行额外处理,直接上样分离。200 cm×h-1流速下sc pDNA的动态载量为每毫升介质负载2.00 mg,而oc pDNA为每毫升介质负载0.32 mg。优化的分离条件为:pH=7.5、(NH4)2SO4=2.5 mol×L-1下上样,上样量为5 mL;pH=7.5、(NH4)2SO4=1.9 mol×L-1下冲洗,最佳洗脱盐浓度((NH4)2SO4=1.7 mol×L-1)+(NaCl= 0.3 mol×L-1),可得到sc pDNA纯度为83.9%、同质性高达95.8%、收率为80.6%。结果表明,采用混合模式层析介质Capto PlasmidSelect一步分离sc pDNA效果显著、选择性好、处理量较大,具有良好的应用前景。
[1] HIGH K A, RONCAROLO M G, Gene therapy [J]. The New England Journal of Medicine, 2019, 381(5): 455-464.
[2] KULKARNI K M, KHOT A M, LOKAPURE S G,. A brief review on gene therapy [J]. Indo American Journal of Pharmaceutical Sciences, 2018, 5(5): 3288-3299.
[3] FEMIRA G N M. 基因治疗和DNA疫苗质粒DNA的下游加工技术 [J]. 郭利平, 章佩芬, 唐青涛, 译. 华西药学杂志,2002, 17(2): 159-162.
FEMIRA G N M. Downstream processing technologies of plasmid DNA for gene therapy and DNA vaccines [J]. GUO L P, ZHANG P F, TANG Q T, trans. West China Journal of Pharmaceutical Sciences,2002, 17(2): 159-162.
[4] 哈小琴, 吴祖泽, 张庆林, 等. 质粒超螺旋比例对其细胞转染效率及表达的影响 [J]. 生物技术通讯,2005, 16(4): 392-394.
HA X Q, WU Z Z, ZHANG Q L,. The effect of proportion of supercoiled plasmid on transfer efficiency and expression level in target cells [J]. Letters in Biotechnology,2005, 16(4): 392-394.
[5] US Food and Drug Administration. Guidance for industry: Considerations for plasmid DNA vaccines for infectious disease indications [R]. Washington: US Department of Health and Human Services, 2007.
[6] SANTOS T, CARVALHO J, CORVO M C,. L-tryptophan and dipeptide derivatives for supercoiled plasmid DNA purification [J]. International Journal of Biological Macromolecules, 2016, 87: 385-396.
[7] 徐英黔, 吴蕾, 甘一如. CTAB法制备超螺旋质粒DNA [J]. 过程工程学报, 2007, 7(2): 390-394.
XU Y Q, WU L, GAN Y R. Purification of supercoiled plasmid DNA by CTAB [J]. The Chinese Journal of Process Engineering, 2007, 7(2): 390-394.
[8] LI Y, CURRIE D, ZYDNEY A L. Enhanced purification of plasmid DNA isoforms by exploiting ionic strength effects during ultrafiltration [J]. Biotechnology and Bioengineering, 2016, 113(4): 783-789.
[9] NAZER B, DEHGHANI M R, GOLIAEI B. Plasmid DNA affinity partitioning using polyethylene glycol-sodium sulfate aqueous two-phase systems [J]. Journal of Chromatography B, 2017, 1044/1045: 112-119.
[10] SALEK P, FILIPOVA M, HORAK D,. Enhanced solid phase extraction of DNA using hydrophilic monodisperse poly (methacrylic acid-co-ethylene dimethacrylate) microparticles [J]. Molecular Biology Reports, 2019, 46(3): 3063-3072.
[11] DA SILVA R J, MACIEL B G, MEDINA-LLAMAS J C,. Extraction of plasmid DNA by use of a magnetic maghemite- polyaniline nanocomposite [J]. Analytical Biochemistry, 2019, 575: 27-35.
[12] VALENTE J F A, SOUSA A, AZEVEDO G A,. Purification of supercoiled p53-encoding plasmid using an arginine-modified macroporous support [J]. Journal of Chromatography A, 2020, 1618: 460890.
[13] VALENTE J F A, SOUSA A, AZEVEDO G A,. DoE to improve supercoiled p53-pDNA purification by-phospho-L-tyrosine chromatography [J]. Journal of Chromatography B, 2019, 1105: 184-192.
[14] SANTOS T, PEREIRA P, SOUSA F,. Purification of supercoiled G-quadruplex pDNA fortranscription [J]. Separation and Purification Technology, 2016, 163: 59-71.
[15] BICHO D, SANTOS B F, CARAMELO-NUNES C,. Application of ethylenediamine monolith to purify a hemagglutinin influenza deoxyribonucleic acid-based vaccine [J]. Separation and Purification Technology, 2015, 154: 320-327.
[16] CARDOSO S, ČERNIGOJ U, LENDERO KRAJNC N,. Chromatographic purification of plasmid DNA on hydrophobic methacrylate monolithic supports [J]. Separation and Purification Technology, 2015, 147: 139-146.
[17] HALAN V, MAITY S, BHAMBURE R,. Multimodal chromatography for purification of biotherapeutics - A review [J]. Current Protein & Peptide Science, 2019, 20(1): 4-13.
[18] 武强, 林东强, 翁叶靖, 等. 用于双水相萃取的混合模式配基制备及对IgG分配的影响[J]. 高校化学工程学报, 2013, 27(6): 925-930.
WU Q, LIN D Q, WENG Y J,. Preparation of mixed-mode ligand for aqueous two-phase extraction and the influences of the ligand on IgG partitioning [J]. Journal of Chemical Engineering of Chinese Universities, 2013, 27(6): 925-930.
[19] LUO Y D, ZHANG Q L, YAO S J,. Adsorption behaviors of avian immunoglobulins and purification of immunoglobulin Y from chicken serum with mixed-mode resins [J]. Chinese Journal of Chemical Engineering, 2019, 27(3): 514-518.
[20] WU Q C, ZHANG Q L, GAO D,. Mixed-mode expanded-bed adsorption for human serum albumin separation [J]. Industrial & Engineering Chemistry Research, 2018, 57(3): 1039-1047.
[21] SILVA-SANTOS A R, ALVES C P A, PRAZERES D M F,. Separation of plasmid DNA topoisomers by multimodal chromatography [J]. Analytical Biochemistry, 2016, 503: 68-70.
[22] BICHO D, CARAMELO-NUNES C, SOUSA A,. Purification of influenza deoxyribonucleic acid-based vaccine using agmatine monolith [J].Journal of Chromatography B, 2016, 1012/1013: 153-161.
Separation and purification of supercoiled plasmid DNA by mixed-mode chromatography
ZHANG Pengcheng, TAN Yuanzhi, SUN Yanna, ZHANG Qilei, YAO Shanjing, LIN Dongqiang
(Key Laboratory of Biomass Chemical Engineering of Ministry of Education, Zhejiang Key Laboratory of Smart Biomaterials, College of Chemical and Biological Engineering, Zhejiang University, Hangzhou 310058, China)
The mixed-mode resin Capto PlasmidSelect was used to study adsorption behaviors of supercoiled plasmid DNA sc pDNA, open-circular plasmid (oc pDNA) and RNA in order to purify (sc pDNA) from cell lysate with pVAX1 plasmid as a studying object. The separation conditions were then optimize to efficiently purify sc pDNA from clarified lysate. Static adsorption of sc pDNA, oc pDNA and RNA was investigated, and the results show that sc pDNA had high adsorption capacity at 1.9-2.5 mol×L-1(NH4)2SO4salt concentration. The saturated adsorption capacity of sc pDNA was 3.3 mg×g-1resin, and the feedstock containing 2.5 mol×L-1(NH4)2SO4could be loaded directly. The dynamic binding experiments indicate that sc pDNA penetrated slightly later than oc pDNA, and the dynamic binding capacity of sc pDNA was 2.00 mg×mL-1resin. The adsorption of RNA was significantly stronger than that of plasmid DNA. The separation conditions including elution and washing conditions and loading volume were optimized. The best conditions are 2.5 mol×L-1(NH4)2SO4for loading, 1.9 mol×L-1(NH4)2SO4for washing, and 1.7 mol×L-1(NH4)2SO4+ 0.3 mol×L-1NaCl for elution. The purity of sc pDNA reached 83.9%, the yield was 80.6% and the homogeneity was as high as 95.8%. The results demonstrate that mixed-mode chromatography has good selectivity and productivity for supercoiled plasmids.
supercoiled plasmid DNA; adsorption; mixed-mode chromatography; nucleic acid separation
TQ028.8
A
10.3969/j.issn.1003-9015.2023.05.013
1003-9015(2023)05-0806-07
2022-07-03;
2022-08-06。
国家重点研发计划(2021YFC2103401,2021YFE0113300);国家自然科学基金(22078286)。
张鹏程(1996-),男,浙江温州人,浙江大学硕士生。
林东强,E-mail:lindq@zju.edu.cn
张鹏程, 谭远志, 孙艳娜, 张其磊, 姚善泾, 林东强. 混合模式层析分离纯化超螺旋质粒DNA[J]. 高校化学工程学报, 2023, 37(5): 806-812.
:ZHANG Pengcheng, TAN Yuanzhi, SUN Yanna, ZHANG Qilei, YAO Shanjing, LIN Dongqiang. Separation and purification of supercoiled plasmid DNA by mixed-mode chromatography [J]. Journal of Chemical Engineering of Chinese Universities, 2023, 37(5): 806-812.

