Nano-seq宏基因组测序在关节置换术后假体周围感染诊断中的应用价值
邓磊,王少华,李征,杨光亚,于雅丽,侯颖周,李科伟,孙博
(1.河南中医药大学第一临床医学院,河南 郑州 450046;2.郑州市骨科医院,河南 郑州 450052;3.唐山市工人医院,河北 唐山 063000)
人工关节置换是髋、膝关节疾病终末期治疗的有效方法,能够显著提高患者生活质量[1]。假体周围感染是人工关节置换的严重并发症之一,发生率为1%~2%[2]。相关研究发现,假体周围感染与人工关节置换手术失败密切相关,而假体周围感染的医疗费用是初次关节置换的5倍以上[3-4]。此外,部分假体周围感染患者的病原微生物难以通过微生物培养检出,增加了假体周围感染漏诊、误诊的风险[5]。Nano-seq宏基因组测序属于第3代测序(third-generation sequencing,TGS)技术,具有测序快速、准确等特点,在病原微生物的基因测序中具有独特的优势[6-9]。为了探讨Nano-seq宏基因组测序在关节置换术后假体周围感染诊断中的应用价值,我们进行了相关研究,现总结报告如下。
1 临床资料
1.1 一般资料选取2020年1月至2021年9月在郑州市骨科医院采用人工关节置换术治疗后因疑似假体周围感染再次住院的患者为研究对象。试验方案经郑州市骨科医院伦理委员会审查通过,伦理批件号:2019010。
1.2 纳入标准①人工关节置换术后再次住院;②疑似为假体周围感染[10];③神志清醒,智力正常,可配合进行相关检查;④参与本研究,签署知情同意书。
1.3 排除标准①合并其他部位感染者;②入院前2周使用抗菌药物者。
1.4 退出标准①抽取关节液不足者;②关节液样品在运输、使用过程中被污染者。
2 方 法
2.1 检查方法患者住院后,抽血测定血清C反应蛋白(C-reactive protein,CRP)含量、血沉(erythrocyte sedimentation rate,ESR)和血浆纤维蛋白原(fibrinogen,FIB)含量等指标;抽取患者2份关节液样本,每份5 mL。将其中1份关节液冷冻处理后,送至郑州迪安医学检测所有限公司,并于采集后4 h内进行Nano-seq宏基因组测序;另1份关节液送至检验科进行病原微生物培养。Nano-seq宏基因组测序后,由郑州迪安医学检测所有限公司进行生物信息学分析,并出具病原微生物检验报告。
2.2 数据收集与分析方法患者出院后,从病历系统中提取患者入院时测定的血清CRP含量、ESR、血浆FIB含量及病原微生物培养检验报告、Nano-seq宏基因组测序检验报告及出院诊断结果。分别根据血清CRP含量、ESR、血浆FIB含量、病原微生物培养检验报告、Nano-seq宏基因组测序检验报告诊断假体周围感染,并以出院诊断结果为金标准,计算上述指标诊断假体周围感染的敏感度、特异度、准确度、阳性预测值、阴性预测值。血清CRP含量、ESR、血浆FIB含量诊断假体周围感染的依据分别为血清CRP含量>10 mg·L-1[11]、ESR>30 mm·h-1[12]、血浆FIB含量>4.01 g·L-1[13]。Nano-seq宏基因组测序和病原微生物培养诊断假体周围感染依据检验报告结果。
2.3 数据统计方法采用SPSS26.0统计软件对所得数据进行统计学分析。Nano-seq宏基因组测序诊断假体周围感染的敏感度、特异度、准确度与其他指标的比较均采用Fisher确切概率法检验;采用受试者操作特征(receiver operating characteristic,ROC)曲线评价不同指标诊断假体周围感染的应用价值。检验水准α=0.05。
3 结 果
共纳入39例患者,1例患者关节液使用过程中被污染,最终纳入38例患者。血清CRP含量诊断假体周围感染的敏感度为90.48%、特异度为41.18%、准确度为68.42%,ESR诊断假体周围感染的敏感度为66.67%、特异度为64.71%、准确度为65.79%,血浆FIB含量诊断假体周围感染的敏感度为66.67%、特异度为70.59%、准确度为68.42%,病原微生物培养诊断假体周围感染的敏感度为61.90%、特异度为94.12%、准确度为76.32%,Nano-seq宏基因组测序诊断假体周围感染的敏感度为95.24%、特异度为82.35%、准确度为89.47%(表1至表5)。Nano-seq宏基因组测序诊断假体周围感染的敏感度高于ESR、血浆FIB含量、病原微生物培养(P=0.045,P=0.045,P=0.020),与血清CRP含量的差异无统计学意义(P=1.000);Nano-seq宏基因组测序诊断假体周围感染的特异度高于血清CRP含量(P=0.032),与ESR、血浆FIB含量、病原微生物培养的差异均无统计学意义(P=0.438,P=0.688,P=0.601);Nano-seq宏基因组测序诊断假体周围感染的准确度高于血清CRP含量、ESR、血浆FIB含量(P=0.047,P=0.026,P=0.047),与病原微生物培养的差异无统计学意义(P=0.222)。血清CRP含量、ESR、血浆FIB含量、病原微生物培养、Nano-seq宏基因组测序诊断假体周围感染的ROC曲线下面积分别为0.791(P=0.002)、0.706(P=0.031)、0.734(P=0.014)、0.780(P=0.000)、0.888(P=0.000),见图1。

表2 血沉诊断假体周围感染结果 单位:例

表3 血浆纤维蛋白原含量诊断假体周围感染结果 单位:例
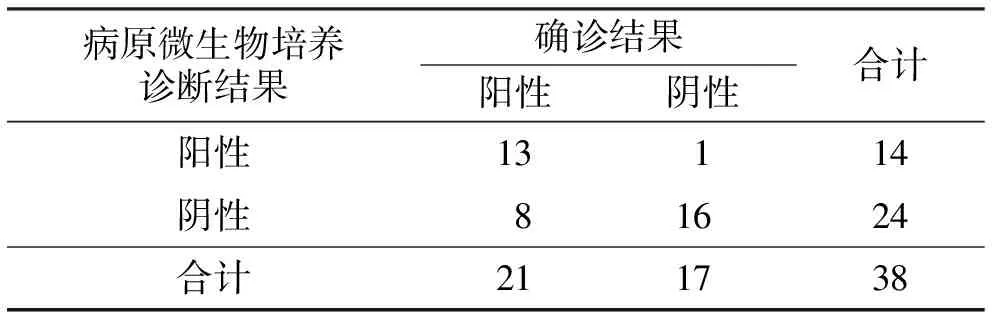
表4 病原微生物培养诊断假体周围感染结果 单位:例

表5 Nano-seq宏基因组测序诊断假体周围感染结果 单位:例
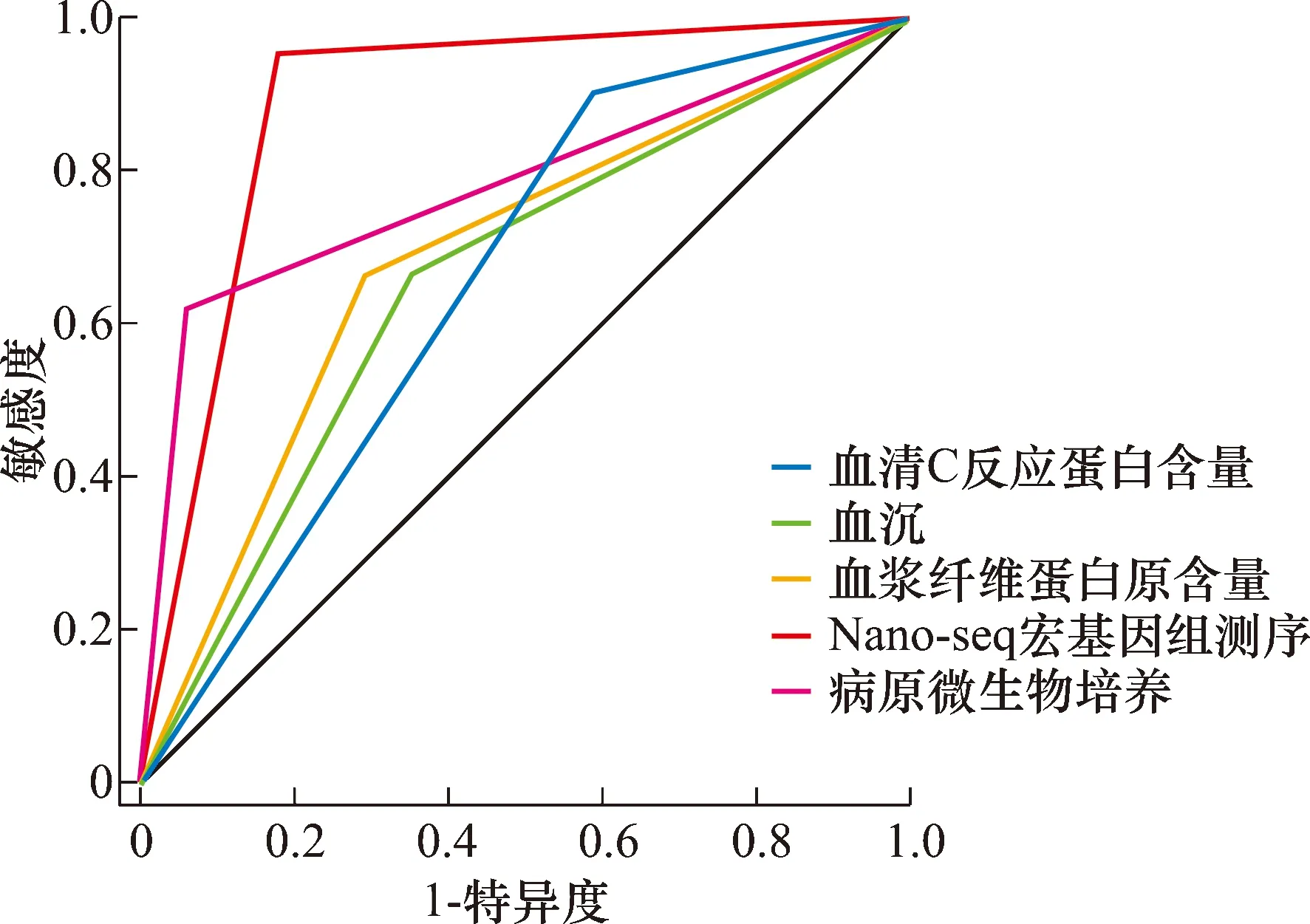
图1 不同指标诊断假体周围感染的受试者操作特征曲线
4 讨 论
随着社会老龄化的加剧,人工关节置换的需求不断增加,导致假体周围感染患者人数也随之逐渐增加[14]。早期诊断假体周围感染并明确病原微生物种属对于假体周围感染的治疗具有重要意义。血清CRP含量和ESR在辅助诊断假体周围感染中具有一定的应用价值[15]。然而,部分假体周围感染患者的临床症状不典型,血清CRP含量、ESR等指标无异常,导致假体周围感染漏诊的风险增大,进而降低关节置换的成功率、增加假体翻修的风险[16]。Akgun等[17]回顾性分析了215例假体周围感染患者的病例资料,其中77例术前血清CRP含量正常,进一步分析这些患者的致病菌种属发现,血清CRP含量对丙酸杆菌、凝固酶阴性葡萄球菌和肠球菌等低毒力致病菌感染导致的假体周围感染的诊断敏感度较低。Watanabe等[18]的研究结果也表明,部分假体周围感染患者的血清CRP含量和ESR在正常范围内。因此,依据血清CRP含量和ESR诊断假体周围感染可能会导致误诊,从而延长假体周围感染患者的诊疗周期。血浆FIB含量升高能够提示机体炎症反应的发生[19]。黄金承等[11]研究发现,血浆FIB含量可用于辅助诊断假体周围感染。目前关于血清CRP含量、ESR、血浆FIB含量诊断假体周围感染的标准以及应用价值均存在争议[20-21]。本研究结果显示,这些指标在诊断假体周围感染中具有一定的应用价值,血清CRP含量诊断假体周围感染的敏感度较高,但特异度较低,而ESR和血浆FIB含量诊断假体周围感染的敏感度和特异度均不高,且这3项指标的准确度均不高。

表1 血清C反应蛋白含量诊断假体周围感染结果 单位:例
Nano-seq宏基因组测序采用Nanopore测序平台进行,能够实现单分子实时测序。该技术通过捕捉DNA或RNA通过纳米孔道时形成的特征性电信号变化,并将电信号转换为碱基序列,完成核酸序列的测定;Nano-seq宏基因组测序具有更长的读取长度、更低的碱基错配率,且能够检测的病原微生物种属范围更广[9]。在完成测序后,通过生物信息学分析,可以获得病原微生物的相关信息,进而为医生制定治疗方案提供帮助[22-23]。Luo等[24]收集了70例上呼吸道感染患者的支气管肺泡灌洗液样本,分别采用微生物培养和TGS进行病原微生物检测,结果显示微生物培养的阳性率为25.71%,TGS的阳性率为84.29%。Wang等[25]研究发现,基于Nanopore测序平台的TGS技术在鉴别假体周围感染患者的病原微生物种属方面具有显著优势。Yu等[26]收集肝癌合并腹水感染患者的腹水样本进行TGS,结果显示TGS在检测多种细菌合并感染方面具有显著优势。Huang等[27]的研究结果表明,基于Nanopore测序平台的TGS技术检测病原微生物的敏感性较高。相关研究发现,近年来真菌、分枝杆菌、布鲁氏杆菌等需要特定检测方法检测的病原微生物导致的假体周围感染患者人数呈上升趋势,而依据传统微生物培养检查结果为阴性的假体周围感染患者占假体周围感染患者40%以上[28-29]。Nano-seq宏基因组测序在真菌、病毒等病原微生物的检测方面具有显著优势[25]。此外,传统的微生物培养检测存在结果滞后问题,而Nano-seq宏基因组测序可在24 h内得到检测结果,并可提供更加准确、全面的病原微生物信息,进而为假体周围感染的早期诊断和治疗提供可靠依据[30]。
本研究结果表明,Nano-seq宏基因组测序在关节置换术后假体周围感染诊断中具有较高的应用价值。Nano-seq宏基因组测序专业性较强、成本较高,目前在临床中的应用较少。但随着科技的发展和技术的进步,Nano-seq宏基因组测序将会在假体周围感染的诊断中发挥更加重要的作用。

