TACE术治疗的原发性肝癌患者血清IL-33水平变化及其对发热的鉴别意义探讨*
莫春明,黄德佳,韦惠章,罗江伟
近年来,原发性肝癌(PLC)发病率在全球范围内有增加趋势,在疾病进展到中晚期才有临床表现,而诊断时多数患者已无法进行外科手术治疗,只能采用非手术方法治疗[1]。经导管肝动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)是非手术治疗PLC的首选方法,但部分患者在TACE治疗后效果未达到预期。因此,尽早对TACE治疗效果进行评估,及时调整治疗方案,提高治疗效果具有重要的临床意义。TACE 为微创术,但在临床工作中也会发现一部分患者出现栓塞后综合征(post-embolization syndrome,PES),出现发热、恶心、疼痛等症状[2,3]。PLC患者多伴有乙型肝炎病史,且存在凝血功能障碍、肝功能异常等,在TACE 术后极易出现感染性并发症。因此,为了正确应对TACE术后发热,临床医师需分辨感染与非感染因素,并给予适当的处理。因此,及早明确TACE术后PLC患者发热的具体原因,对提高TACE治疗效果、降低抗菌药物滥用具有重要的临床意义。白介素-33(interleukin-33,IL-33)是一种前炎症细胞因子,主要以前体蛋白的形式存在于多种细胞核内[4]。既往研究[5]报道,IL-33与多种细菌感染性疾病存在一定的关联。本研究检测了TACE术后发热的PLC患者血清IL-33水平,以探讨其诊断细菌感染的价值,现报道如下。
1 资料与方法
1.1 病例来源 2020年4月~2022年4月我院诊治的PLC患者150例,符合《原发性肝癌诊疗规范(2017年版)》[6]的诊断标准,纳入患者均接受TACE术治疗并出现发热症状。排除标准:合并其他恶性肿瘤;肝癌远处转移或多发肝内转移;存在严重的心脑血管疾病;存在血液系统疾病;存在自身免疫性疾病。本研究通过我院医学伦理委员会批准,患者及其家属签署知情同意书。
1.2 TACE治疗方法 患者取仰卧位,消毒铺巾后,在股动脉穿刺点注射利多卡因行局部麻醉,先行股动脉穿刺,置入导管于腹腔干、造影,观察肝内肿瘤位置、大小、数目和供血等。将导管插至肝总动脉近端,置入微导管和微导丝,将微导管插至肿瘤供血动脉内,造影确定。缓慢注射奥沙利铂等化疗药物和超液化碘油10~20 mL,行肝动脉栓塞化疗,直至所有供血动脉被栓塞完毕。再次造影,不见肿瘤染色,结束手术,拔除导管。在腹股沟处加压包扎。间隔3~4周,再次行TACE治疗,每例治疗2~4次。
1.3 感染诊断 经痰液、尿液、血液或体液送培养和细菌鉴定、血清检测和影像学检查,综合判断细菌感染[7]。
1.4 血清IL-33水平检测 采用ELISA法检测(英国Abcam公司)。
1.5 资料收集 根据本研究目的,检索医院电子病历系统,收集患者基本临床资料,包括年龄、性别、合并症、HBV感染、酒精肝、肿瘤相关资料(包括肝功能Child-Pugh分级、腹水、TNM分期、肿瘤大小、肿瘤数量)和发热当日实验室检查资料[包括WBC计数、C反应蛋白(C-reactive protein,CRP)、降钙素原(procalcitonin,PCT)、IL-33]。

2 结果
2.1 细菌感染与非细菌感染的PLC患者基线资料比较 在TACE术后发热的患者中,细菌感染组合并糖尿病比率显著高于非细菌感染组(P<0.05,表1)。
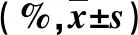
表1 细菌感染与非细菌感染的PLC发热患者基线资料比较
2.2 细菌感染与非细菌感染的PLC患者基线肝功能和肿瘤指标比较 细菌感染组肿瘤TNM Ⅲ期、肿瘤大于5 cm和肿瘤多发占比显著高于非细菌感染组(P<0.05,表2)。

表2 细菌感染与非细菌感染的PLC患者肝功能和肿瘤指标(%)比较
2.3 细菌感染与非细菌感染的PLC患者实验室指标比较 细菌感染组外周血白细胞计数、血清CRP、PCT和IL-33水平显著高于非细菌感染组(P<0.05,表3)。
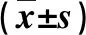
表3 细菌感染与非细菌感染PLC患者实验室指标比较
2.4 血清IL-33和PCT对TACE术后发热的PLC患者细菌感染的诊断价值 以血清IL-33和PCT水平联合预测细菌感染的效能显著优于两指标单独预测(P<0.05,表4、图1)。

图1 血清IL-33和PCT诊断PLC患者细菌感染的ROC分析

表4 血清IL-33和PCT对PLC患者细菌感染的预测价值
3 讨论
全球PLC发病率呈增长趋势,在恶性肿瘤死亡风险排名中居第三位。肝细胞癌(HCC)其PLC的80%,严重威胁人类的生命健康[8]。PLC起病隐匿,早期缺乏典型症状。当临床症状明显时,大多病情已进入中、晚期。TACE属于一种微创介入化疗手段,已在临床应用了近30年,成为有效治疗PLC的姑息性疗法之一。对于失去手术机会的肝癌患者,该方法是首选疗法[9,10]。然而,TACE术后有众多的不良反应,如发热、恶心、呕吐、腹痛、肝肾功能损害、骨髓抑制等,这些不良反应不仅会影响治疗效果,治疗过程还会给患者带来痛苦,有一些患者因为惧怕治疗带来的副反应而放弃治疗。因此,如何既发挥TACE术的治疗优势,同时防治该治疗手段引起的副作用,是决定肝癌患者抗癌治疗效果及生存质量的关键。发热是TACE术后常见的不良反应,临床医师通常会选择抗菌药物进行预防性抗感染,但引起TACE术后发热的因素较多。若非细菌感染患者应用抗菌药物可能出现药物滥用情况。在TACE术后发热发生率为49%~100%[11]。有研究[12]认为,TACE术后发热的可能原因是由于肿瘤和正常肝细胞实质性坏死导致的。此外,TACE术后肿瘤细胞溶解和坏死可能导致炎症细胞因子释放和全身性应激反应、侵入性操作和化疗药物的副作用不可避免地影响患者的体内环境和免疫功能的平衡,均可能导致TACE术后发热[13]。既往研究关于TACE术后PLC患者发生细菌感染的报道不尽相同。有报道,在TACE术后感染的发生率为2.2%[14]。有观察发现21.4%PLC患者在TACE术后48 h出现发热症状,其中11.9%发热患者经病原学检查确诊为细菌感染[15]。一般认为,高龄、住院时间较长、腹水和血清白蛋白较低是TACE术后PLC患者发生医院感染的独立危险因素[16]。本组患者感染发生率比较高。控制感染危险因素能够减少PLC患者TACE术后细菌感染的发生,避免抗菌药物的滥用。因此,早期诊断PLC患者TACE术后发热的原因,对提高TACE治疗效果及防止抗菌药物的滥用具有重要的临床意义。
本组细菌感染与非细菌感染的PLC患者性别、年龄、HBV感染、酒精性肝病、Child-Pugh分级比较,差异无统计学意义,而合并糖尿病、TNM分期、肿瘤大小和肿瘤数量有显著差异。外周血WBC计数、血清CRP和PCT水平是临床常用的判定细菌感染的指标,但是影响因素较多,个体差异大,影响了对感染性疾病诊断的特异度和灵敏度判断,故需结合临床表现及其他实验室指标综合判断。IL-33是由人源基因IL33编码的蛋白,是IL-1家族成员,能有效驱动辅助因子Th2的启动。IL-33信号通路诱导下游炎症和抗炎基因转录,从而导致充分的免疫应答[17,18]。血清IL-33水平对胃癌根治术后感染具有良好的预测效能[19]。呼吸道合胞病毒感染小鼠血清IL-33水平明显升高[20]。本研究结合上述报道,结果提示TACE术后发热的PLC患者血清IL-33水平变化可能与细菌感染的发生密切相关,可作为预测患者细菌感染的有效辅助指标。
肝癌引起的发热多是因为肿瘤组织内非感染性炎症或肿瘤坏死而释放的致热源引起的,但同时肿瘤患者抵抗力低下,容易发生感染,这时出现的发热是感染性的,因此明确患者发热原因有助于控制TACE术后抗菌药物的滥用。本研究经ROC 曲线分析发现,联合血清IL-33和PCT水平预测TACE术后发热的PLC患者细菌感染的效能较高,有一定的临床应用价值。既往研究[21,22]报道,血清IL-33信号通路可能在炎症疾病发生过程中发挥重要作用,且与脑性疟疾患者病情发展有一定的关联。本研究结果支持上述观点。今后,可扩大临床试验,探讨应用这些指标诊断细菌感染的准确性,为更好地预防和治疗TACE术后细菌感染提供更科学合理的依据。
综上所述,血清IL-33水平升高可以预测TACE术后发热的PLC患者细菌感染,具有较高的诊断价值。本研究细菌感染率较高,可能与选择的患者合并糖尿病多和肿瘤晚期等因素有关。

