肝硬化并发肝肾综合征患者U-mAl及外周血NLR和血清NGAL水平变化研究*
田 宇,陈 燕,曹佳非,周晓倩
肝硬化是慢性肝脏损伤进展,长期炎症损伤,逐渐导致肝组织纤维化和假小叶形成,使得肝组织结构发生整体缩小和结构紊乱。肝硬化早期无明显的临床症状。若病情持续发展,则表现为门静脉高压和肝功能严重损伤,常出现消化道出血、肝性脑病、肝肾综合征((HRS)和癌变等严重并发症[1,2]。肝硬化并发HRS的发病原因尚无明确的定论,部分学者认为,其主要发病原因是病情严重,出现大量的腹腔积液,导致有效循环血容量不足、肾灌注不足,从而继发肾功能衰竭[3]。HRS是严重肝病患者病程后期出现的功能性肾衰竭,主要以肾功能损伤、循环功能障碍和血管舒张因子明显异常为特征,常伴随有腹腔积液。若未及时采取有效的治疗措施,可在较短时间内死亡[4]。因此,寻找有效手段早期诊断HRS,对及时治疗,防止病情快速发展,降低病死率具有重要的临床意义。尿微量白蛋白(U-mAl)是指在正常尿液中含量甚微的白蛋白,可早期反映肾脏损伤,临床常用于排查糖尿病肾病、高血压病肾损害等肾损伤并发症[5,6]。中性粒细胞/淋巴细胞比值(NLR)作为全身炎症反应的评价指标之一,其水平升高多见于广泛的组织损伤、感染和坏死[7]。中性粒细胞明胶酶相关载脂蛋白(NGAL)是肾脏结构损伤、全身炎症和氧化应激的标志物。在正常生理状态下,NGAL在肾小管被降解。若肾小管出现损伤,NGAL无法被正常降解,体内NGAL水平则会异常升高[8]。本研究检测了肝硬化并发HRS患者尿U-mAl及外周血NLR和NGAL水平,并探讨了各指标诊断HRS的价值,现报道如下。
1 资料与方法
1.1 病例来源 2020年1月~2022年1月我院收治的肝硬化并发HRS患者43例,男性28例,女性15例;年龄为28~69岁,平均年龄为(48.69±10.35)岁。依据2019年中华医学会制订的《肝硬化诊治指南》[9]的标准诊断肝硬化,依据2017年中华医学会制定的《肝硬化腹水及相关并发症的诊疗指南》[10]的标准诊断HRS。肝硬化的病因包括乙型肝炎30例,酒精性肝病10例,原发性胆汁性肝硬化(PBC)3例。另按照1:1的比例随机选择同期在我院住院的失代偿期肝硬化患者43例,男性27例,女性16例;年龄为28~70岁,平均年龄为(49.07±10.54)岁。肝硬化的病因包括乙型肝炎29例,丙型肝炎1例,酒精性肝病11例,PBC 2例。排除标准:既往存在肾脏手术史或存在肾脏慢性疾病;存在严重的心脑血管疾病;存在恶性肿瘤;存在血液系统疾病;存在自身免疫性疾病。本研究通过我院医学伦理委员会批准,患者或其家属签署知情同意书。
1.2 指标检测 使用美国Beckman公司Array 360全自动特定蛋白分析仪测定尿U-mAl水平;使用希森美康2800全自动血细胞分析仪检测外周血淋巴细胞计数、中性粒细胞计数和单核细胞计数,并计算NLR;采用ELISA法检测血清NGAL。

2 结果
2.1 两组尿U-mAl及NLR和血清NGAL水平比较 肝硬化并发HRS患者U-mAl、NLR和NGAL水平显著高于肝硬化患者(P<0.05,表1)
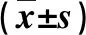
表1 两组尿U-mAl及NLR和血清NGAL水平比较
2.2 U-mAl、NLR和NGAL之间相关性分析 经Pearson相关性分析显示,肝硬化并发HRS患者U-mAl水平与NLR或NGAL水平呈正相关(r=0.470、r=0.476,均P<0.001,图1),NLR水平与NGAL水平呈正相关(r=0.752,P<0.001,图1)。

图1 U-mAl、NLR和NGAL之间相关性分析
2.3 U-mAl、NLR和NGAL单独或联合诊断肝硬化并发HRS的效能情况 分别以U-mAl=25.0 mg/24 h、NLR=3.5和NGAL=29.2 ng/mL为截断点,它们单独诊断HRS的AUC分别为0.741、0.733和0.734,差异均无统计学意义(P>0.05)。以U-mAl、NLR和NGAL并联的方式联合诊断HRS的AUC为0.870,其敏感度为0.973,特异度为0.767,联合诊断的AUC显著大于各指标的单独检测(Z=3.047、Z=3.039、Z=2.806,P=0.002、P=0.002、P=0.005,表2、图2)。

图2 U-mAl、NLR和NGAL单独(左)或联合(右)诊断HRS的ROC曲线

表2 U-mAl、NLR和NGAL单独或联合诊断HRS的效能
3 讨论
引起肝硬化的病因有很多,各种慢性肝病迁延不愈,都可以导致肝硬化。在我国,以乙型肝炎病毒感染为主[11]。肝硬化本身呈慢性病程,但出现严重并发症时可突发各种急性症状或危及生命的情况。HRS是失代偿期肝硬化可能会出现的严重并发症之一,其发病机制尚无明确的定论,多数学者认为主要通过以下机制导致HRS的发生[12-14]:①肝功能异常时,血管收缩因子表达异常,体内血管舒张因子灭活减少,引起体循环血管床扩张,导致肾脏血流改变;②体循环灌注减少导致肾脏血管代偿性收缩,肾血流量减少,肾内血流重新分布,血流自肾皮质向髓质分流,从而减少肾脏血流,尤其是肾皮质灌注不足,导致肾小球滤过率出现异常,继发肾衰竭;③大量腹水引起腹腔内压明显升高,肾血流进一步减少。肝硬化患者病情持续进展,肾脏血液循环障碍愈发严重,肾血流量减少,肾血流灌注量严重不足,导致严重脱水,最终出现少尿和无尿等,诱发HRS的发生。HRS病情发展迅速。若早期未及时采取有效的治疗措施,急进型患者将于2周内死亡。HRS的确切发病率和患病率尚无明确的数据,但HRS约占住院肝硬化难治性腹水患者肾损伤的11%,容易进展为肾衰竭,病死率高,病死率约80%~95%[15]。因此,HRS的早期诊断具有重要的临床意义。本研究分析了肝硬化并发HRS患者尿U-mAl及外周血NLR和血清NGAL水平变化,发现三项指标联合检测对HRS有较高的诊断效能。
本组肝硬化并发HRS患者U-mAl、NLR和NGAL水平显著高于肝硬化患者。U-mAl是指在人体尿液中出现极少的白蛋白。白蛋白是人体血液中最主要的蛋白质,维持机体营养和渗透压。由于肾功能正常,且滤过膜完整,蛋白不容易漏出。因此,健康生理状态下尿液中甚少出现白蛋白。当肾脏发生功能损伤,尤其在早期出现肾功能损伤时,导致滤过膜受损,引起白蛋白从肾小球滤过膜漏出,使U-mAl水平升高[16]。既往研究[17,18]报道,U-mAl对产后急性肾损伤和痛风患者早期肾损伤具有较高的诊断价值。本研究结合上述报道,结果提示U-mAl可作为肝硬化并发HRS的辅助诊断指标。当肝硬化患者出现早期肾损伤时,引起肾小球基底膜受损,导致基底膜通透性增加,肾小球基底膜负电荷减少,带负电荷的白蛋白很容易透过受损的肾小球基底膜,从而出现在尿液中,使U-mAl水平升高。白细胞是人体免疫系统的重要组成部分,其中中性粒细胞和淋巴细胞占据白细胞成分的90%,且正常人群血液中两者比例较为恒定,即NLR值较为稳定。当机体出现严重的组织损伤,则会出现NLR升高[19]。NLR是ICU胃肠疾病、肝胆手术和烧伤患者术后发生急性肾损伤的预测因素[20,21]。肝硬化并发HRS患者全身炎症加重,导致血液中性粒细胞显著升高,进而导致NLR水平升高。NGAL是一种小分子蛋白,在多种组织器官的中性粒细胞和上皮细胞都有表达。在正常情况下,NGAL在尿液和血浆中维持一个较低水平,而肾损伤时则在非常短的时间内急速升高,并且释放到尿液和血液中。在肾功能异常时,会引起肾小管上皮细胞损伤,分泌大量的NGAL,使间质浸润的中性粒细胞不断死亡,进而抑制炎性细胞损害肾组织,维持肾小管上皮细胞再生功能[22]。NGAL可作为肝硬化并发急性肾损伤的早期生物标志物[23]。我们认为,NGAL可作为肝硬化并发HRS的辅助诊断指标。肝硬化并发HRS患者会出现肾脏局部缺血或损伤,导致肾脏大量分泌NGAL,并进入尿液和血液。
本研究经Pearson相关性分析结果显示,肝硬化并发HRS患者尿U-mAl水平与NLR或血清NGAL水平呈正相关,NLR与血清NGAL水平也呈正相关,表明三项指标之间可能存在相互影响的关系。进一步进行ROC曲线分析发现,尿U-mAl及外周血NLR和血清NGAL水平诊断肝硬化并发HRS的AUC分别为0.741、0.733、0.734。既往研究[24]报道,血清NGAL是失代偿期肝硬化患者急性肾损伤病情进展的独立危险因素,尿U-mAl对失代偿期肝硬化患者发生HRS有较高的诊断价值。本研究结果支持上述报道,提示尿U-mAl与外周血NLR和血清NGAL水平对肝硬化并发HRS有较好的诊断效能,临床可早期采取对症措施进行治疗,以控制病情进一步发展。由于本组例数较少,病情可能代表性一般,需要扩大临床验证。

