节律基因CLOCK 单核苷酸多态性与生活方式在学龄前儿童肥胖中的交互作用
刘 玲,林秀雯
近年来,儿童肥胖已经成为一个日趋严重、全球关注的公共卫生问题[1]。 有研究显示[2],多数肥胖青少年在学龄前体质量增加幅度最为明显,而学龄前时期体质量增长过快可造成儿童青春期前肥胖和体脂过度,导致青春期早发。 另有研究显示[3],日常的不良生活行为因素是儿童肥胖的独立危险因素。因此学龄前儿童早期肥胖是青少年肥胖持续发展的关键时期,探究该阶段儿童肥胖的不良生活方式并进行及时干预防控对儿童的身心发展是至关重要的。
肥胖是遗传和环境因素共同作用的结果。昼夜节律运动输出周期故障 (circadian locomotor output cycles kaput,CLOCK)基因是第一个被发现的哺乳动物生物钟基因, 对人体生物钟及多种生理参数具有重要的调节作用[4,5]。 其中节律基因CLOCK 单核苷酸T3111C 位点 (简称T3111C 位点) 多态性不仅与睡眠-觉醒周期有关,还与体质量有关。 有研究显示[6],T3111C 位点多态性与儿童的饮食习惯有关, 是改变饱腹感饮食行为的遗传危险因素,可能与儿童早期肥胖的发生存在一定联系。 但是,目前有关此方面的研究内容较少,对T3111C 位点多态性与肥胖之间的联系还存在较大争议。 对此,笔者通过分析T3111C 位点多态性及生活方式在不同儿童中的分布状态,探索二者交互作用与肥胖的关系,以期为儿童的健康方案的精准化管理及预防提供相应的理论支持。
1 材料与方法
1.1 临床材料
选择2021 年6 月至2022 年6 月在佛山复星禅诚医院儿童保健门诊查体的肥胖儿童60 例 (肥胖组),其中男性34 例,女性26 例;年龄3 ~6 岁,平均年龄5.42 岁(标准差1.23 岁);体质量16.54 ~18.73 kg,平均体质量17.08 kg(标准差2.75 kg)。另选择100 例体质量正常的健康儿童作为对照组,其中男性57 例,女性43 例;年龄3 ~6 岁,平均年龄5.39 岁(标准差1.16 岁);体质量13.75 ~15.21 kg,平均体质量14.96 kg(标准差2.45 kg)。 所有纳入该研究患儿及其家属均知情并签署知情同意书。
选择标准: 根据儿童身高的体质量≥美国国家健康统计中心和(或)世界卫生组织(National Center for Health Statistics/World Health Organization,NCHS/WHO)标准体质量的120%。
排除标准:①与遗传、内分泌、代谢、中枢神经疾病有关的肥胖和肥胖综合征;②长期或间断补充营养品者;③围产期异常者;④摄食异常、心理疾病患儿;⑤原发肝肾等器质性病变; ⑥不愿配合研究调查者;⑦儿童直系父母合并精神异常不能完成调查者;⑧未跟随父母生活的儿童。
两组性别、 年龄比较, 差异无统计学意义(P>0.05)。
1.2 方法
1.2.1 临床资料和生活方式收集
通过调查问卷收集儿童的临床资料和生活方式(问卷由父母或监护人填写), 临床资料包括儿童性别、年龄、出生体质量、分娩方式、家庭情况等。生活方式包括儿童膳食结构(豆制品、海产品、奶制品、蔬菜、水果等)、睡眠时间、屏幕接触时间(电视、计算机、游戏机等)、户外活动时间等。
1.2.2 基因多态性检测
1.2.2.1 DNA 提取 采集儿童空腹外周血5 mL[乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)抗凝],参照DNA 纯化试剂盒说明书(Promega 公司,美国)从外周血单核细胞中提取基因组DNA,-20 ℃条件下保存备用。
1.2.2.2 基因型检测 采用多重聚合酶链式反应(polymerase chain reaction,PCR)扩增目的基因。 反应体系:50 ng 基因组DNA,7 μL 2 × PCR 缓冲溶液,15 mmol/L MgCl2,5 μmol/L 引物,0.55 UTag酶(天根公司,中国北京)。 反应条件:94 ℃15 min,94 ℃20 s,56 ℃30 s,72 ℃60 s,72 ℃3 min,启动PCR 反应。 通过酶切反应可知T3111C 位点存在3 种基因型, 野生TT、杂合突变TC 和纯合突变CC,基因分型见图1。
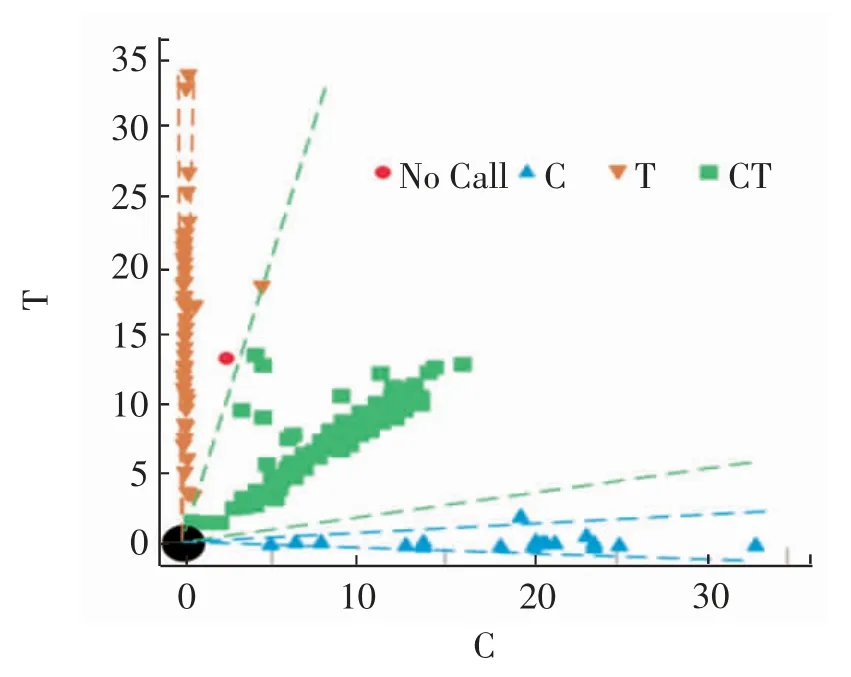
图1 T3111C 位点基因分型图Fig.1 Diagram of T3111C locus genotyping
引物序列如下:T3111C F 5"-TCCAGCAGTTTCATGAGATGC-3",R5"-GAGGTCATTTCAAGCTGAGC-3"。
1.2.3 分析方法
利用Excel 计算样本群体是否符合Hardy-Weinberg 遗传平衡定律(P>0.05 为符合);通过多因素Logistics 回归分析肥胖的危险因素。 通过比值比(odds ratio,OR)及95%可信区间(confidence interval,CI)表示相对风险度,分析T3111C 位点多态性与生活方式因素在学龄前儿童肥胖中的交互作用。
1.3 统计学方法
通过SPSS 23.0 统计软件进行数据统计分析。 以平均数± 标准差表示计量资料,采用t检验进行两组间比较;使用百分数(%)表示计数资料,采用χ2检验进行组间比较。P<0.05 为差异有统计学意义,P<0.01 为差异有显著统计学意义。
2 结果
2.1 Hardy-Weinberg 遗传平衡检验
经Hardy-Weinberg 平衡检验,T3111C 位点各基因型分布符合Hardy-Weinberg 定律(P>0.05)。 见表1。 这提示该研究所纳入样本群体具有良好的代表性。
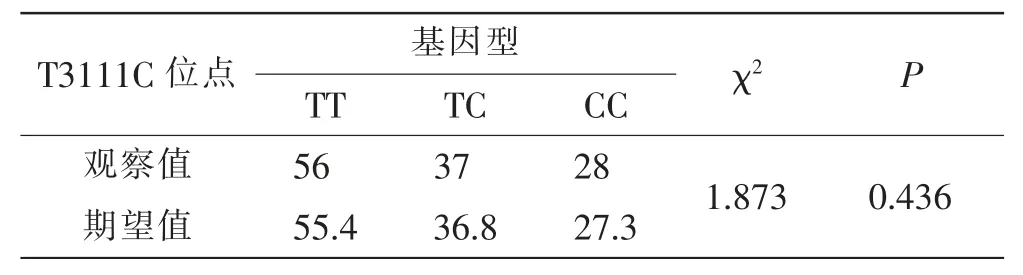
表1 Hardy-Weinberg 遗传平衡检验Tab.1 Result of Hardy-Weinberg genetic equilibrium test
2.2 两组T3111C 位点多态性基因型及等位基因频率分布比较
两组儿童TT 基因型频率、TC 基因型频率、CC 基因型频率比较,差异均有统计学意义(P<0.05)。两组儿童基因T 分布和基因C 分布比较, 差异均有显著统计学意义(P<0.001)。 见表2。
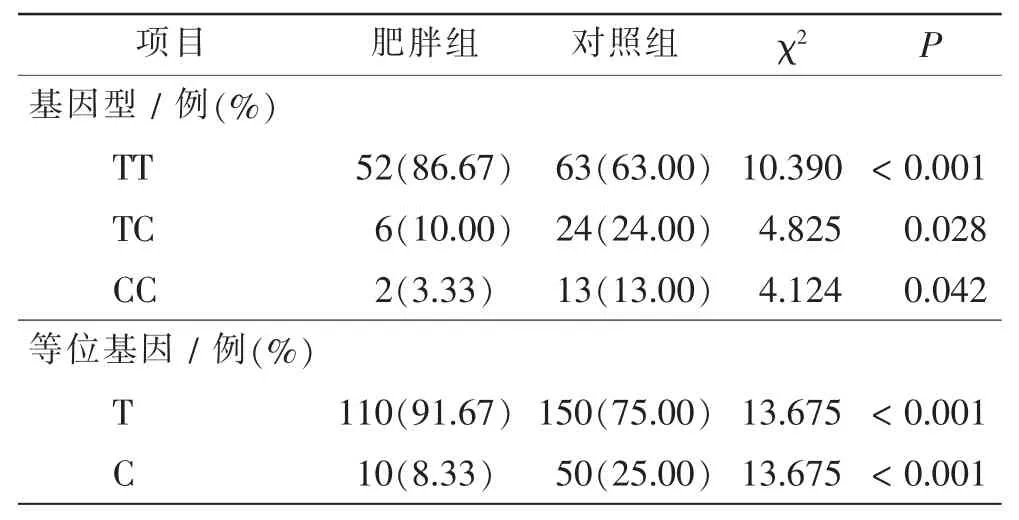
表2 两组T3111C 位点多态性基因型和等位基因比较Tab.2 Comparison of T3111C polymorphism genotype and allele between 2 groups
2.3 两组临床资料及生活方式比较
对比两组儿童临床资料及生活方式可知,两组儿童出生体质量、暴饮暴食、屏幕接触时间、户外活动时间、豆制品、海产品、垃圾食品方面比较,差异有统计学意义(P<0.05)。 见表3。

表3 两组临床资料及生活方式比较Tab.3 Comparison of general data and lifestyle between 2 groups
2.4 Logistic 回归分析学龄前儿童肥胖的危险因素
以儿童是否肥胖作为因变量(否=0,是=1),以2.3节中差异有统计学意义的因素及T3111C 位点基因型作为自变量(赋值见表4)进行Logistic 多因素回归分析。 结果显示,暴饮暴食、户外活动时间<30 min/d、垃圾食品≥3 次/周、 豆制品<3 次/周、T3111C 位点携带TT 基因型是影响学龄前儿童肥胖的独立危险因素。 见表5。

表4 学龄前儿童肥胖的Logistic 多因素回归分析赋值变量表Tab. 4 Logistic multivariate regression analysis of preschool children obesity assignment variable table
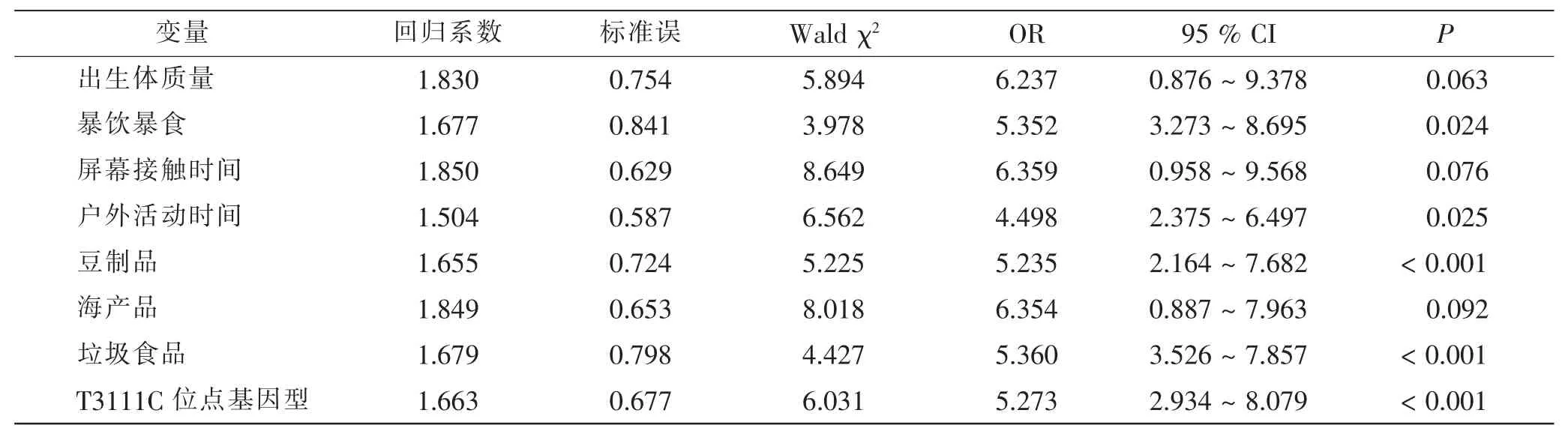
表5 Logistic 回归分析学龄前儿童肥胖的危险因素Tab.5 Logistic regression analysis of risk factors of obesity in preschool children
2.5 T3111C 位点多态性与生活方式因素在学龄前儿童肥胖中的交互作用
T3111C 位点TT 基因型与暴饮暴食、户外活动时间、豆制品及垃圾食品摄入量均有正交互作用(表6)。其中暴饮暴食同时携带TT 基因型者与不暴饮暴食同时携带CC 基因型者相比,肥胖风险前者是后者的2.936 倍;户外活动时间<30 min/d 同时携带TT 基因型者与户外活动时间≥30 min/d 同时携带CC 基因型者相比,前者肥胖风险是后者的3.235 倍;豆制品<3 次/周且携带TT 基因型者与豆制品≥3 次/周且携带CC 者相比,肥胖风险前者是后者的3.540 倍;垃圾食品≥3 次/周同时携带TT 基因型者与垃圾食品<3 次/周同时携带CC 基因型者相比,前者肥胖风险是后者的4.573 倍。
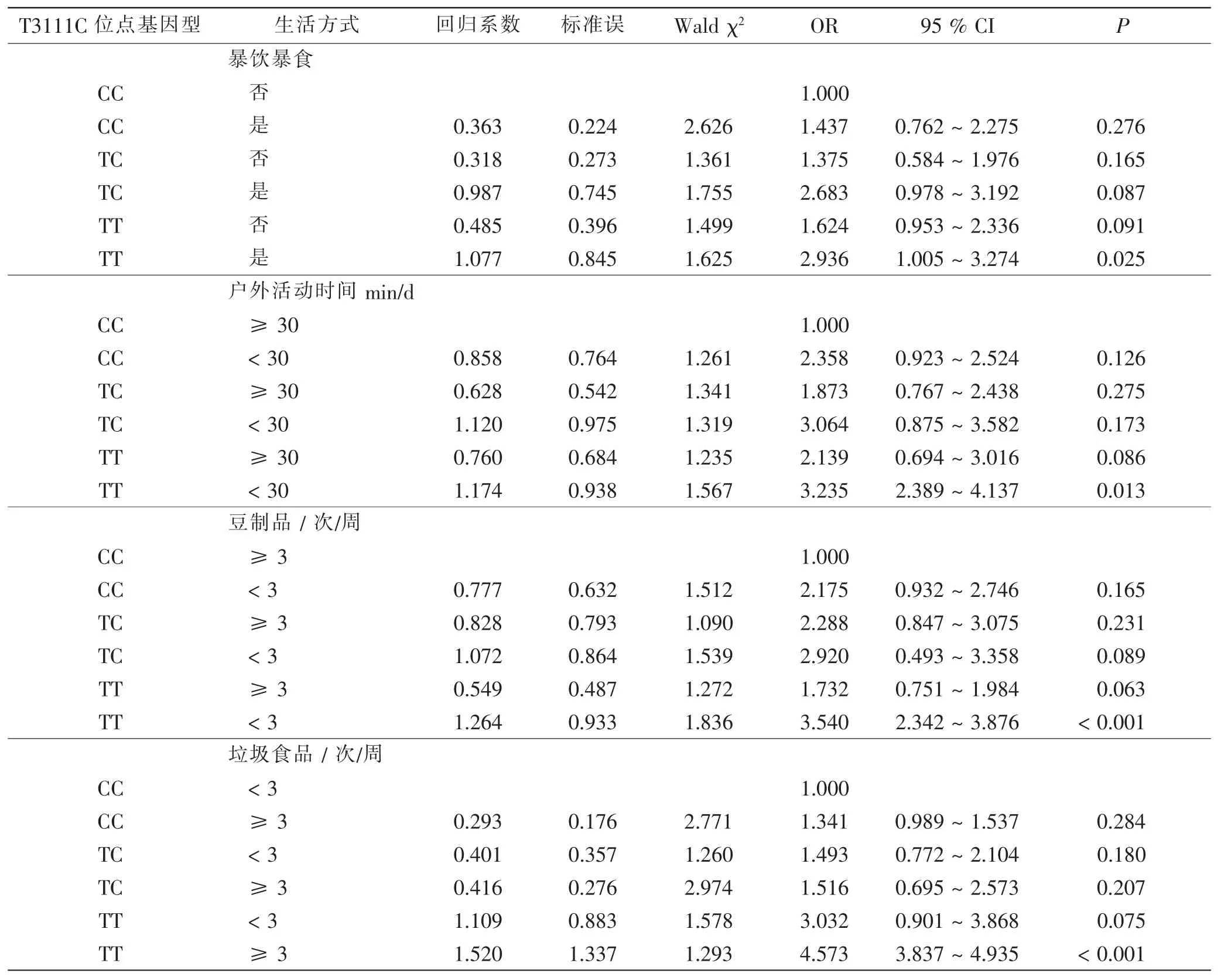
表6 T3111C 位点多态性与生活方式因素在学龄前儿童肥胖中的交互作用Tab.6 Interaction between T3111C polymorphism and lifestyle factors in preschool children with obesity
3 讨论
随着经济的飞速发展和生活水平的不断提高,无论发达国家还是发展中国家,学龄前儿童的超重和肥胖率均呈迅速上升趋势[7]。据专家预测,若不采取有效的干预措施,到2030 年,超重肥胖的儿童数将增至近5 000 万人[8]。 肥胖不光是一种营养性的疾病,还会影响身体其他器官,导致代谢发生异常,对儿童的身心健康造成了严重威胁。因此探究学龄前儿童肥胖的相关影响因素并进行有效的控制和预防是至关重要的。
既往研究结果表明[9],人体内多种代谢和生理功能均是由昼夜节律系统控制的,生物钟蛋白紊乱可诱发多种疾病。 节律基因CLOCK 是内源性分子昼夜生物钟的最重要的基因之一,它参与转录-翻译的蛋白产物是人体形成昼夜节律的分子生物学基础,在人体正常的代谢活动中发挥着重要的生物学作用[10,11]。 近年来,研究者发现T3111C 位点多态性与机体脂代谢异常有关,可引发功能性改变,增加肥胖风险。在一项有关饮食与超重和肥胖患者血脂间关系的研究中提到,在T3111C 位点多态性不同组中,患者间的血脂差异均无统计学意义[12]。而另一项研究显示[13],T3111C位点中具有C 等位基因的个体体质量较低, 肥胖的风险较低。 笔者研究发现,通过对比肥胖儿童和正常儿童T3111C 位点基因型及等位基因频率分布发现,肥胖组儿童TT 基因型的人数占比显著高于对照组儿童, 而TC 和CC 基因型的人数占比低于对照组,Logistic 多因素回归分析显示,T3111C 位点携带TT基因型是影响学龄前儿童肥胖的独立危险因素。这提示T3111C 位点中TT 基因型的儿童相比于TC 和CC基因型儿童更易肥胖。 研究显示[14],多数复杂疾病均为环境因素和遗传易感性共同作用的结果。因此环境因素在学龄前儿童肥胖的发生发展中也具有举足轻重的作用。 研究显示[15],不良的饮食习惯和体育运动量的不足是导致儿童肥胖的最主要原因。豆制品中的长链多不饱和脂肪酸可显著改善儿童机体内的胰岛素抵抗,降低氧化应激反应程度的同时达到控制体质量的效果[16]。 笔者通过行Logistic 多因素回归分析发现,暴饮暴食、户外活动时间<30 min/d、垃圾食品≥3 次/周、 豆制品<3 次/周是影响学龄前儿童肥胖的独立危险因素。 这提示,在日常生活中家长应注意儿童的生活方式,做到规律进食、减少垃圾食品摄入、增加豆制品摄入的同时还应注意增加户外活动时间,以降低儿童肥胖风险。
通过交互作用指标对两因素间的交互作用进行定量分析是流行病学常用的一种评估方法。分析基因和环境的交互作用可更加深入地了解环境因素对遗传因素易感性的影响及疾病的发生机制[17]。 目前关于T3111C 位点多态性与生活方式因素的交互作用在肥胖发病机制中所扮演的角色还尚未有研究报道,这是因为该位点多态性与肥胖之间的关联尚处于探究阶段。 笔者研究结果显示,T3111C 位点TT 基因型与暴饮暴食、户外活动时间、豆制品及垃圾食品摄入量均有正交互作用。 其中暴饮暴食同时携带TT 基因型者与不暴饮暴食同时携带CC 基因型者相比,肥胖风险前者是后者的2.936 倍;户外活动时间<30 min/d 同时携带TT 基因型者与户外活动时间≥30 min/d 同时携带CC 基因型者相比, 前者肥胖风险是后者的3.235 倍; 豆制品<3 次/周且携带TT 基因型者与豆制品≥3 次/周且携带CC 者相比, 肥胖风险前者是后者的3.540 倍;垃圾食品≥3 次/周同时携带TT 基因型者与垃圾食品<3 次/周同时携带CC 基因型者相比,前者肥胖风险是后者的4.573 倍。 究其机制,笔者猜测,这可能是由于T3111C 位点与脑组织中的蛋白表达存在密切关联,可通过中枢神经系统对体质量进行一定的调节,TT 基因型的儿童可能受神经系统的调节作用更倾向于摄入高热量食物, 对豆制品、海产品、蔬菜水果等摄入不足,导致机体内的胰岛素抵抗加重,导致高热食物吸收后无法及时代谢,造成脂肪堆积,进而为肥胖的发生创造了条件。此外,体育活动的不足对脂肪酸合成酶的基因转录产生抑制作用,进而减少了脂肪的生成,反之则增加肥胖风险,这与笔者研究结果相符。
笔者研究局限性:所纳入样本数量较少,可能一定程度上会影响分析结果的可靠性和稳定性; 其次,肥胖发病机制复杂,影响的因素也很多,笔者研究未完全纳入。 对此,笔者将在未来研究中进一步证实该研究的分析结果。
综上所述,暴饮暴食、户外活动时间<30 min/d、垃圾食品≥3 次/周、 豆制品<3 次/周、T3111C 位点携带TT 基因型是影响学龄前儿童肥胖的独立危险因素。节律基因CLOCK 单核苷酸T3111C 位点TT 基因型与暴饮暴食、户外活动时间、豆制品及垃圾食品摄入量均有正交互作用。

