结直肠癌患者肠道大肠埃希菌硝基还原酶NfsA的变异及活性研究
王 彬,张慧锋
(1.河北省沧州中西医结合医院实验诊断科,河北 沧州 062153;2.吉林医药学院,吉林 吉林 132013)
据2022年国家癌症中心数据,肠癌已上升为中国第二大癌症[1],且发病率在青少年和年轻成人中逐年升高,这些患者被定义为45岁以下的个体。研究显示,饮食习惯、家族遗传、生活环境是肠癌发生的重要因素[2]。近年来,肠道菌群与肠癌的发生、发展的关系亦备受关注。肠道微生物群是一种复杂的共生菌群,由1014个单独的细菌和大于300万个基因组成[3]。肠道微生物群影响宿主生理学稳态,包括营养代谢、抗感染和免疫系统发育等方面[4]。肠道微生物编码合成的硝基还原酶(nitroreductase-A,NfsA)存在于多种细菌中且含量丰富,以肠杆菌为主。主要有大肠埃希菌[5]、哈维氏弧菌、恶臭假单胞菌、沙门菌、阴沟肠杆菌[6]等。其中大肠埃希菌是人类肠道微生物中的一种常见细菌,在维持肠道稳态方面起着重要作用。大肠埃希菌携带的NfsA可以将人类肠道中硝酸盐还原为具有活性和毒性的亚硝酸盐,亚硝酸盐进一步与含氮化合物结合后产生亚硝基化合物,亚硝基化合物是高度致癌物。N-亚硝基化合物与人类基因表达改变有关,其在肠癌的发生、发展中起重要作用[7]。本研究从肠癌患者及健康人群肠道大肠埃希菌携带的NfsA在基因序列、编码蛋白质及酶活力差异来分析肠癌患者肠道NfsA的变异。
1 对象与方法
1.1 受试对象
收集2018年5月至2019年9月在吉林市肿瘤医院就诊的未进行手术及放化疗治疗之前的肠癌患者粪便标本。患者男19例,女12例;年龄45~63岁,平均(56.3±5.0)岁;21例患者饮酒,17例患者吸烟。收集同期医院体检中心健康人群粪便标本。其中男17例,女13例;年龄45~62岁,平均(52.9±5.1)岁;16例患者饮酒,11例患者吸烟。两组对象一般资料差异无统计学意义(P>0.05)。本研究参与患者均知情同意。
肠癌患者的纳入标准:①患者的临床症状符合肠癌诊断标准,并且经过病理学及血清学检查确诊为肠癌;②无其他消化道疾病(如胰腺炎、肠梗阻等);③未经过肠癌手术治疗和放化疗等辅助治疗。排除标准:①患者机体功能有严重损害者(如心、肺、肝等器官功能损害);②有家族遗传性消化道疾病(如大肠腺瘤、肠道炎症性疾病等);③近一月肠道菌群可能分布及代谢紊乱的患者(如服用抗生素、微生态制剂治疗等)。
健康对照者纳入标准:①无家族性或慢性肠道疾病;②体检及粪便常规各项指标均在正常范围内;③近期未使用抗生素等且肠道菌群分布及代谢正常。
1.2 主要试剂和仪器
Gelred染料(美国Biotium公司),D2000 Marker、2×Taq PCR Master-Mix、细菌基因组提取试剂盒、pGM-T载体试剂盒、质粒小提试剂盒均来自于北京天根科技有限公司。生物安全柜(BSC-1000B2,浙江苏净净化设备有限公司),PCR扩增仪(ECT811,东胜生物科技有限公司),凝胶成像仪(D-140,大连市竞迈科技有限公司),气浴恒温振荡器(ZD-85A,金坛市友联仪器研究所),高速冷冻离心机(SLM-17R,上海凌仪生物科技有限公司)。
1.3 细菌的分离培养
收集受试者新鲜粪便,接种于伊红美兰培养基置于37 ℃温箱中过夜培养。用一次性无菌接种环挑取疑似大肠埃希菌的菌落,三区划线涂布在LB平板上再次放于37 ℃温箱中进行过夜纯培养。挑选典型菌落观察菌落形态,并涂片进行革兰染色观察细菌的镜下形态。然后接种IMViC生化反应管,37 ℃培养18~24 h的时间,观察细菌的生化反应。
1.4 测序鉴定
1.4.1 引物的合成与PCR扩增
应用Primer 5软件设计16SrDNA、NfsA基因引物,由上海生工有限公司合成,引物序列见表1。在NCBI上检测其特异性;进行梯度PCR,探索最适退火温度。用细菌基因组提取试剂盒提取大肠埃希菌基因组。PCR反应体系(25 μL):2×Taq Mix 12.5 μL,上、下游引物各0.5 μL,目的基因1 μL。反应条件:95 ℃预变性5 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,共30个循环;72 ℃终延伸5 min。扩增出的NfsA基因进行2%的琼脂糖凝胶电泳并纯化。

表1 16SrDNA、NfsA基因引物序列
1.4.2 基因序列比对
用pGM-T克隆试剂盒将NfsA基因PCR产物连接到载体上,加入到TOP10感受态细胞中,并加入预热的SOC培养液,37 ℃培养3 h使菌体复苏。吸取混匀的菌液接种于转化平板上,过夜培养。挑取白色菌落接种到6 mL LB(含80 μg的Amp)液体培养基,37 ℃、150 r/min震荡过夜培养。用质粒提取试剂盒提取菌液中的质粒,经PCR扩增和2%琼脂糖凝胶电泳验证正确后,由上海生物工程有限公司进行测序。并在NCBI上与标准NfsA基因序列进行比对分析基因差异。
1.5 酶活力检测
将NfsA的特异性底物(呋喃西林粉)溶于PBS缓冲液配制成1 mmol/L,并梯度稀释成0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9 mmol/L,用酶标仪于25 ℃,测吸光度A410值,根据吸光度及其浓度制作标准曲线。挑取单个菌落接种于发酵培养基中,150 r/min、10 h震荡过夜培养,测得A600吸光度为0.7。将NfsA的特异性底物与诱导剂IPTG溶解于PBS缓冲液中配制成浓度分别为0.1、0.2 mmol/L的溶液。吸取菌液和含有特异性底物与诱导剂的PBS缓冲液加入到96孔板中,混匀37 ℃培养5 h。用酶标仪于25 ℃、测A410吸光度值,根据标准曲线计算出浓度。根据酶活力定义,按照公式U/L=(C始-C末)×V/h计算肠癌患者和健康对照者大肠埃希菌NfsA活力。
1.6 统计学分析
2 结 果
2.1 细菌鉴定
分离得到的大肠埃希菌在伊红美兰培养基上呈单个或多个聚集的紫黑色菌落,在阳光下观察可看到绿色金属光泽,显微镜下为G-短小杆菌,生化反应IMViC结果为++--,16SrDNA测序鉴定,与Gene Bank收录中的弗氏大肠杆菌(Escherichiafergusonii)ATCC 35469菌株相符,见图1。

注:Query为样本序列,Sbjct为参考序列
2.2 NfsA基因扩增
肠癌患者和健康对照者粪便标本大肠埃希菌NfsA基因经PCR扩增,片段为723 bp,见图2。
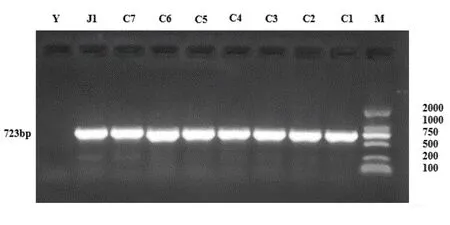
注:M为DL 2000 DNA分子量标准,Y为阴性对照,C1~C7为肠癌患者粪便标本,J1为健康对照者粪便标本
2.3 肠道大肠埃希菌携带的NfsA基因测序及比对
重组质粒由上海生物工程有限公司测序并与NCBI标准NfsA基因序列对比,发现样品中大肠埃希菌NfsA中有4处变异:第714位碱基由G颠换成A、第72位A突变成C、第79位C突变成T、第52位碱基缺失。部分序列比对结果见图3。其中第714位碱基由G颠换成A、第52位碱基缺失,差异在实验组与对照组之间有统计学意义(P<0.05),见表2。
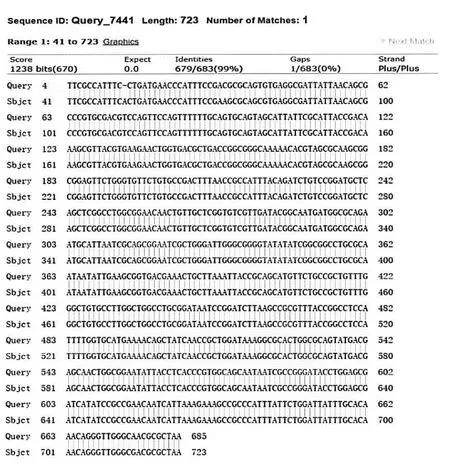
注:Query为样本序列,Sbjct为参考序列

表2 两组对象NfsA基因序列变异比较[n(%)]
2.4 结直肠癌患者及健康人群肠道大肠埃希菌携带的NfsA活性及分析
酶-底物法绘制呋喃西林粉标准曲线结果为Y=1.986 6x+0.049 3,相关系数r2=0.999 6,相关性良好。酶-底物法测定病例组大肠埃希菌NfsA活性为(46.7±5.0)U/L,对照组大肠埃希菌NfsA活性为(40.2±4.5)U/L,具有统计学差异(P<0.05)。
3 讨 论
我国目前结直肠癌诊断的方法主要为内镜检查、CT检查、粪便免疫学方法检查、血清标志物检查等,但每种方法都存在一定的局限性(如内镜具有创伤性可导致穿孔、出血,CT诊断的准确性严重受病变组织大小影响,血清标志物灵敏度特异度均较低等)[8]。因此,找到一种新的无创性肠癌筛查基因诊断指标,用于肠癌的预防及早期诊断,对提高肠癌患者的治愈率及生存率具有重要的意义。
肠癌是一种多因素疾病,与表观遗传改变、环境和生活方式等因素有关。癌症基因组学研究为观察其在肿瘤发展中的错综复杂性提供了一种可靠的视角[9]。肠道粪便大肠埃希菌NfsA主要功能是将肠道食物中的硝酸盐还原为亚硝酸盐,亚硝酸盐可进一步形成高度的致癌物——亚硝基化合物,可直接损伤组织细胞DNA,其活性增强会促进结直肠癌的发生、发展[10]。本研究收集测定肠癌患者粪便样本,结果显示肠道大肠埃希菌NfsA在基因序列发生了一个或多个位置碱基的突变,且NfsA活性明显增高,故而推测高频率的基因变异可能改变了NfsA编码蛋白质的结构进而上调了NfsA的活性,从而促进了癌症发生。同时少数健康对照者NfsA基因序列也发生了突变,推测这一突变后续可能引起NfsA活性的改变,应尽早进行干预,预防癌症的发生。

