甘薯蔓割病(Fusarium oxysporum f.sp.batatas)相关基因IbMAPKK9的克隆与特性分析
靖小菁 杨新笋 靳晓杰 刘 意 雷 剑 王连军 柴沙沙 张文英 焦春海,*
甘薯蔓割病(Fusarium oxysporum f.sp.batatas)相关基因IbMAPKK9的克隆与特性分析
靖小菁1,2杨新笋2靳晓杰2刘 意3雷 剑2王连军2柴沙沙2张文英1,*焦春海2,*
1长江大学农学院, 湖北荆州 434025;2湖北省农业科学院粮食作物研究所, 湖北武汉 430064;3海南大学园艺学院 / 海南省热带园艺作物品质调控重点实验室, 海南海口 570228
促丝裂原活化蛋白激酶(MAPK)级联是生物体内一种重要的信号转导途径, 广泛存在于植物中。MAPKKs位于该级联反应通路中间, 对信号传递起到关键作用, 目前在甘薯中少有报道。基于前期的转录组学分析, 本研究克隆出1个与甘薯抗病相关的基因。生物信息学分析表明,包含一个987 bp开放阅读框(open reading frame, ORF), 编码328个氨基酸, 具有1个蛋白激酶家族保守结构域(PF00069), IbMAPKK9蛋白以α螺旋和无规则卷曲为主, 启动子区包含多种激素(茉莉酸甲酯、乙烯、脱落酸、赤霉素、水杨酸)相关及胁迫响应元件。进化分析表明, IbMAPKK9蛋白与三叶裂薯、日本牵牛花、番茄和马铃薯亲缘关系较近。亚细胞定位显示IbMAPKK9蛋白定位于细胞核。实时荧光定量PCR发现在甘薯根、茎、叶和叶柄中均表达, 并响应甘薯蔓割病侵染。瞬时表达分析结果表明,引起5个与水杨酸合成途径及信号转导途径相关的基因在48 h内表达上调, 推测通过介导水杨酸信号途径影响植物的抗性。本研究可为进一步解析甘薯的生物学功能提供理论依据。
甘薯;; 蔓割病; 基因克隆; 亚细胞定位; 瞬时表达
甘薯[(L.) Lam], 俗称红薯、番薯、地瓜等, 是旋花科(Convolvulaceae)甘薯属()一年或多年生双子叶植物。甘薯起源于秘鲁、厄尔瓜多、墨西哥一带的热带美洲, 具有极强的环境适应性, 广泛种植于全球120多个国家和地区, 是世界上重要的粮食、饲料、工业原料及生物质能源作物, 也是世界第七大粮食作物[1]。联合国粮食及农业组织FAO (http://www.fao.org/)最新统计数据显示, 我国是世界上最大的甘薯生产国, 种植面积和产量均居全球首位。甘薯蔓割病由尖孢镰刀菌甘薯专化型f. sp侵染引起, 病原菌从苗茎受伤部位进入, 侵袭植株的维管组织, 致使植株茎部开裂甚至死亡[2]且易在高温多雨地带滋长、繁衍, 具有随机分布、危害性高的特点[3], 一般可致甘薯减产10%~20%, 重者达50%以上, 严重阻碍了中国南方甘薯生产的发展[4], 选育和种植抗病品种是目前最经济有效且绿色环保的防治措施[5]。
促丝裂原活化蛋白激酶激酶(MAPKKs)又称MKK或MEK, 是MAPK信号转导途径的中间激酶, 具有兼容性和高效性, 而成员数目最少[6-7]。在MAPK级联反应中, MAPKKs通过双磷酸化完成信号的收集与传递, 与MAPKKK (MKKK、MEKK)和MAPK (MPK)形成一组完整顺序作用的蛋白激酶(MAPKKK-MAPKK-MAPK), 以协调细胞反应, 参与植物免疫、环境应激反应以及植物的正常生长发育过程[8-11]。如烟草(NPK1-NQK1-NRK1)与拟南芥同源MAPK级联(ANPs-MKK6-MPK4)在植物细胞分裂中起重要作用[12-14], 水稻MAPK级联(OsMKKK10- OsMKK4-OsMPK6)可以调控种子的大小[15]。
近年来, 已在部分植物中鉴定和报道MAPK级联成员。其中, MAPKKs在拟南芥中有10个[7], 玉米中有9个[16-17], 水稻中有8个[18], 小麦中有18个[19], 二穗短柄草中有12个[20]。此外, 一些MAPKKs基因被证实与环境胁迫响应相关。研究表明, 拟南芥中对寒冷、盐度和病原体做出反应[21-23];可以调节茉莉酸(JA)信号和蓝光介导的幼苗发育[24-25];和在调控植物免疫与生长发育发挥和上游的冗余功能[26-29]。在转基因植物中通过清除活性氧(ROS)来增强渗透能力[30]。正调控枸杞对脱水及干旱的抗性, 过表达还能够增强ROS相关与胁迫响应基因的表达[31]。在紫花苜蓿中同时介导盐信号和诱导信号[32]。
目前,基因的表达与其抗逆胁迫中的功能研究还不深入, 在甘薯中鲜有报道。本研究基于前期获得的甘薯转录组, 筛选出显著差异基因, 以高抗蔓割病甘薯品种“鄂薯11”为试验材料克隆该基因, 将其命名为“”, 通过生物信息学分析、实时荧光定量分析以及亚细胞定位等方法分析该基因序列的结构特性和基因表达特性, 可为进一步解析甘薯的生物学功能提供理论依据, 以期为深入研究甘薯胁迫反应中的MAPK、MAPKK、MAPKKK信号传导级联系统奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 植物材料 高抗蔓割病甘薯品种“鄂薯11”,由湖北省农业科学院粮食作物研究所自主选育[33]。
1.1.2 工程菌及载体 pMD19-T克隆载体购于TaKaRa公司; 大肠杆菌感受态DH5α购于北京全式金生物技术有限公司; 亚细胞定位载体pCAMBIA 1300由本实验室保存。
1.2 试验方法
1.2.1 材料处理 “鄂薯11”组培苗经人工驯化后移栽至花盆, 分别取扦插后20 d的根、茎、叶和叶柄。根取完整根部, 茎取地面以上10 cm的主茎, 叶和叶柄分别取靠近主茎顶端的成熟叶片、叶柄, 分别剪碎后混合, 各自称取0.1 g并分装标记, 液氮速冻1 h后保存至–80℃超低温冰箱。
蔓割病病原菌Fob置于PDA平板培养1 周(黑暗条件, 温度28℃)。菌丝转移至马铃薯葡萄糖液体培养基中振荡培养, 7 d后将液体培养基通过16层无菌纱布过滤, 孢子收集到干净的空瓶中, 利用血球计数板计数, 用灭菌水稀释孢子悬浮液至浓度为1×107孢子 mL–1。选择健康、长势基本一致的“鄂薯11”薯苗剪取主茎顶端约16 cm茎段, 清水条件下置于三角锥瓶中生长, 3 d后利用无菌剪刀在茎基部制造新鲜伤口, 将划伤后的甘薯苗置于提前配制好的孢子溶液中持续浸泡, 并使孢子液没过甘薯苗的伤口, 分别在侵染0 h、2 h、4 h、12 h、24 h后取茎段4 cm, 液氮速冻1 h后保存至-80℃超低温冰箱, 每组处理3次重复, 侵染试验在本实验室光照生长室中进行(生长条件: 28℃±1℃, 16 h光照/8 h黑暗, 光照强度为54mmol m–2s–1。总RNA、DNA提取及cDNA合成。具体步骤参照陈选阳等[34]的专利。
利用CTAB法提取“鄂薯11” DNA, 用于启动子克隆; 利用植物总RNA提取试剂盒(北京全式金生物技术股份有限公司)提取RNA; 通过超微量分光光度计检测总RNA、DNA的浓度; 通过TaKaRa反转录试剂盒(宝日医生物技术(北京)有限公司)合成cDNA, 用于基因克隆和qRT-PCR分析。
1.2.2基因与启动子克隆 基于前期的转录组分析, 筛选出Gene ID为g6533的显著差异基因, KEGG注释为抗病相关的MAPK信号途径, Nr数据库(ftp://ftp.ncbi.nih.gov/blast/db)注释结果为利用基因ID在六倍体甘薯参考基因组数据库(https://ipomoea-genome.org/)中检索获得该基因的CDS序列及起始密码子上游2000 bp序列, 利用Primer 5.0软件设计特异性引物(表1), 克隆获得基因及启动子。目的片段回收、纯化后, 利用pMD 19-T进行载体连接, 连接产物转化DH-5α感受态细胞, 挑选阳性菌落进行测序(武汉天一华煜基因科技有限公司)。
1.2.3基因的生物信息学分析 利用NCBI (https://blast.ncbi.nlm.nih.gov/Blast.cgi)网站检索不同植物的同源蛋白序列, 使用MEGA 11在线软件进行多序列比对并构建同源序列系统进化树; 利用Expasy (https://web.expasy.org/protparam/)分析目的基因编码的氨基酸序列的理论等电点、相对分子质量、不稳定系数和蛋白亲水性; 利用SMART (http://smart.embl-heidelberg.de/)和HMMER (https://www.ebi.ac.uk/Tools/hmmer/)在线网站分析目的蛋白所含保守结构域及其位置; 利用WoLF PSORT (http://wolfpsort.hgc.jp/)在线网站预测目的蛋白的亚细胞定位; 利用SOPMA (https://npsa-prabi. ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)与SWISS-MODEL (https://swissmodel.expasy.org/)预测蛋白的二级结构和三级结构; 使用Plant CARE (http://bioinformatics.psb.ugent.be/webtools/plant-care/html/)在线工具分析启动子的顺式作用元件, 并利用GSDS2.0在线工具绘图。利用STRING (https:// cn.string-db.org/)在线软件对甘薯IbMAPKK9进行互作蛋白预测分析。
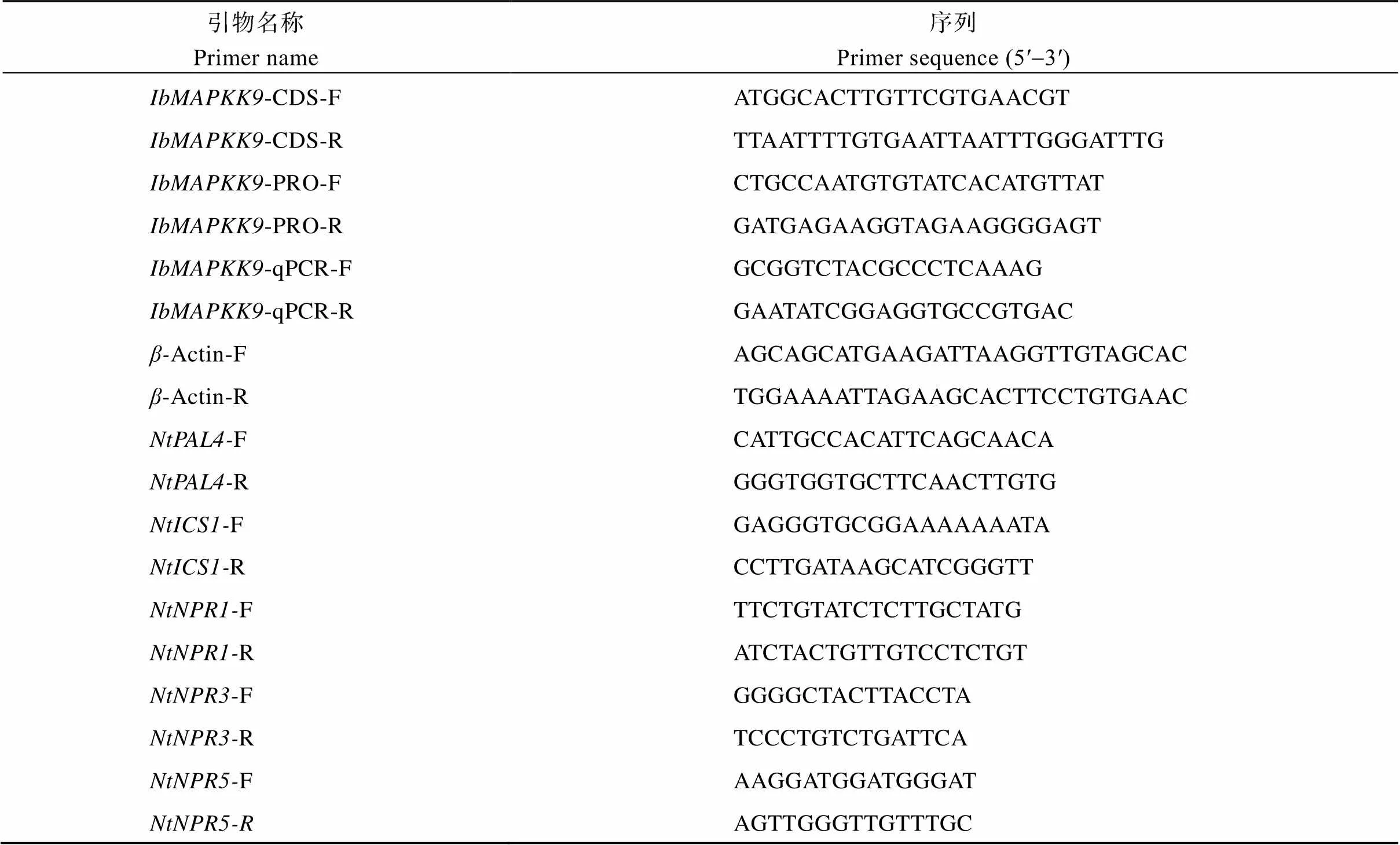
表1 本研究所用引物
1.2.4基因的亚细胞定位 通过在线软件PSORT II (https://psort.hgc.jp/form2.html)和WoLF PSORT (http://wolfpsort.hgc.jp/)对目的基因进行亚细胞定位预测。选取带有GFP标签的pCAMBIA1300为亚细胞定位载体, 构建IbMAPKK9的亚细胞定位重组载体。根据CDS序列设计引物, 去掉终止密码子, 在双端加入酶切位点和保护碱基, 将扩增后的序列插入pCAMBIA1300载体CaMV 35 S启动子下游的多克隆位点, 与GFP表达融合蛋白。采用I和I酶切载体pCAMBIA1300-GFP和目的基因, 回收产物经连接后, 转化DH5α。将其均匀涂抹至含有卡那霉素(Kan)的LB固体培养基, 37℃倒置培养过夜。挑选阳性菌落送测序, 提取重组载体pCAMBIA1300-GFP的质粒, 转化根癌农杆菌感受态细胞, PCR法筛选阳性菌株, 转化洋葱鳞叶表皮瞬时表达, 使用激光共聚焦显微镜(488 nm激光波长)观察其荧光分布状况。所用引物如下:
-T1300-F (H I): 5¢-CGGGATCC ATGGCACTTGTTCGTGAACGT-3¢
-T1300-R (I): 5¢-GCTCTAGAA TTTTGTGAATTAATTTGGGATTTG-3¢
1.2.5基因的表达分析 提取“鄂薯11” 4个组织器官(根、茎、叶、叶柄)和Fob侵染后0 h、2 h、4 h、12 h、24 h茎的总RNA, 逆转录合成cDNA。以各组织部位cDNA为模板, 选用甘薯肌动蛋白(AY905538.1)为内参基因, 检测基因在不同组织、不同处理后的表达模式, 引物序列见表1。反应体系参照TB Green Premix ExII (Tli RNaseH Plus)试剂盒(宝日医生物技术(北京)有限公司)配制, 采用荧光定量PCR仪(Bio-Rad)进行扩增, 反应程序为94℃预变性30 s; 94℃变性5 s, 58℃退火30 s, 45 个循环; 溶解曲线为65℃ 5 s到95℃, 增量为每循环0.5℃, 采用2–ΔΔCt法分析基因的相对表达水平。每个组织取3个生物学重复, 并进行3次独立重复试验。
1.2.6基因的瞬时功能分析 将重组质粒pCAMBIA1300-GFP通过农杆菌介导的瞬时表达方法转染烟草, 建立瞬时表达分析体系, 利用RT-PCR技术检测9下游基因的表达模式。所用引物见表1。
1.2.7 数据处理 使用DPS7.5统计软件进行单因素方差分析和显著性检验,<0.01表示在0.01水平下有显著性差异; 利用Microsoft Excel 2017软件绘图。
2 结果与分析
2.1 IbMAPKK9生物信息学分析
2.1.1编码序列和启动子序列克隆及分析 1%琼脂糖凝胶电泳检测得到约1000 bp的条带, 与预期大小一致(图1)。利用NCBI数据库对其蛋白序列进行在线blastp比对发现, 与甘薯近缘野生种三叶裂薯的MAPKK9蛋白同源性高, 与Nr数据库注释信息吻合。序列分析结果表明,的CDS长度为987 bp, 编码328个氨基酸, 蛋白分子量为36.80 kD, 脂肪系数78.20, 亲水性平均指数为–0.351, 等电点为8.55, 推测其编码不稳定的亲水性蛋白。
1%琼脂糖凝胶电泳检测得到约1700 bp的条带, 连接产物后送武汉天一华煜基因科技有限公司进行测序, 最终得到启动子序列全长1620 bp。序列分析结果表明,基因启动子范围内存在多种类型的启动子顺式作用元件, 且多个与激素应答和抗逆相关(图2)。其中包括厌氧诱导反应顺式作用调节元件ARE、脱落酸应答元件ABRE、乙烯响应元件ERE、茉莉酸甲酯应答元件G-box、赤霉素应答元件P-box、水杨酸(SA)应答元件TCA-element和胁迫响应元件MYB、MYC等(表2)。表明可能受到一些激素和非生物胁迫的调控。
2.1.2 IbMAPKK9蛋白结构分析 蛋白保守结构域的分析结果显示(图3), 甘薯IbMAPKK9含有1个蛋白激酶家族保守结构域(PF00069), 定位于52~315 aa之间。作为蛋白质进化过程中的保守部分, 含有蛋白质活性位点及结构是基因家族分类的重要依据, 对蛋白质具备的功能有指向性作用[35]。NetPho3.1Server (https://services.healthtech.dtu.dk/ service.php?NetPhos-3.1)预测甘薯IbMAPKK9蛋白质磷酸化位点结果显示(图4), 甘薯IbMAPKK9各蛋白质磷酸化位点存在差异(阈值>0.5), 其中包含丝氨酸(serine) 26个、苏氨酸(threonine) 11个、络氨酸(Tyrosine) 2个, 可以印证MAPKKs家族通过丝氨酸和苏氨酸残基被上游的MAPKKKs磷酸化激活, 进而向下游传送信号[7]。SOPMA分析结果显示(表3), IbMAPKK9蛋白结构域二级结构的主要组成元件为α-螺旋和无规则卷曲, 其次为延伸链, β-转角所占的比例最小(图5)。IbMAPKK9蛋白的三级结构预测结果如图6所示。
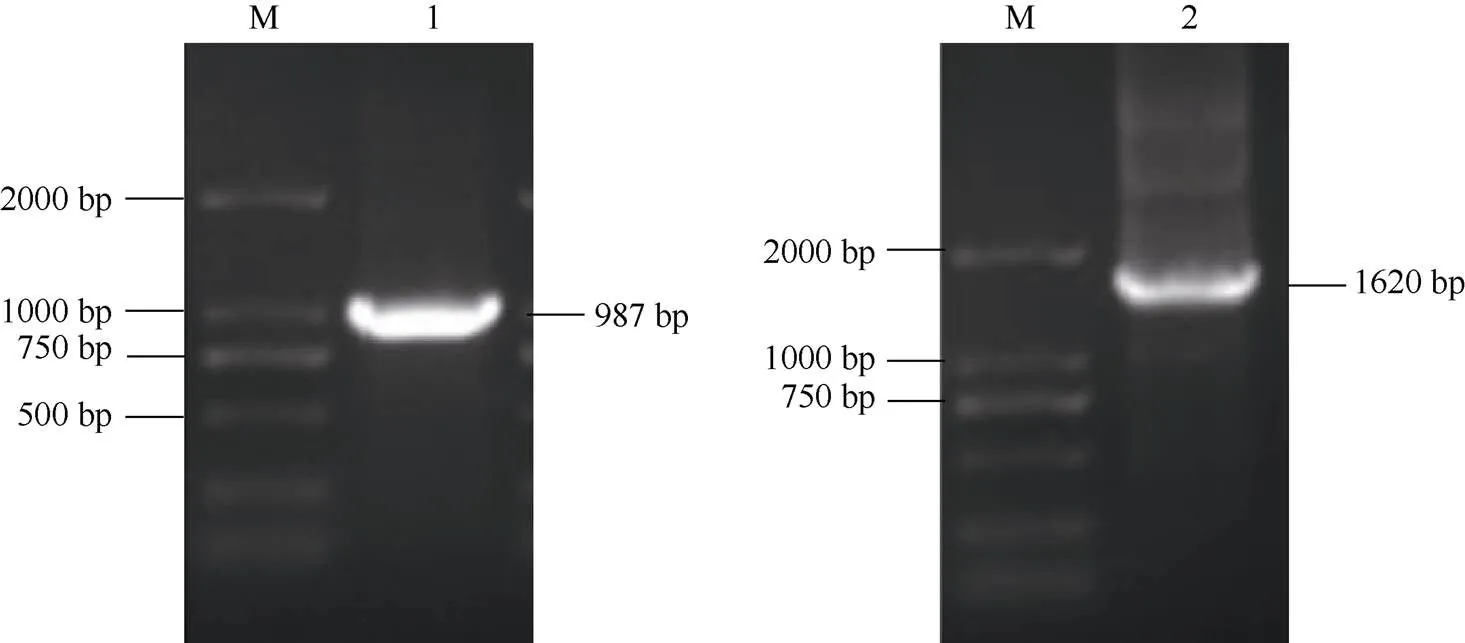
图1 甘薯IbMAPKK9的CDS与启动子克隆
M: DL2000 marker; 1:基因CDS扩增产物; 2:启动子扩增产物。
M: DL2000 marker; 1: CDS ofgene; 2: promoter ofgene.

图2 IbMAPKK9启动子区的调控元件分布

表2 IbMAPKK9基因启动区顺式作用元件分析
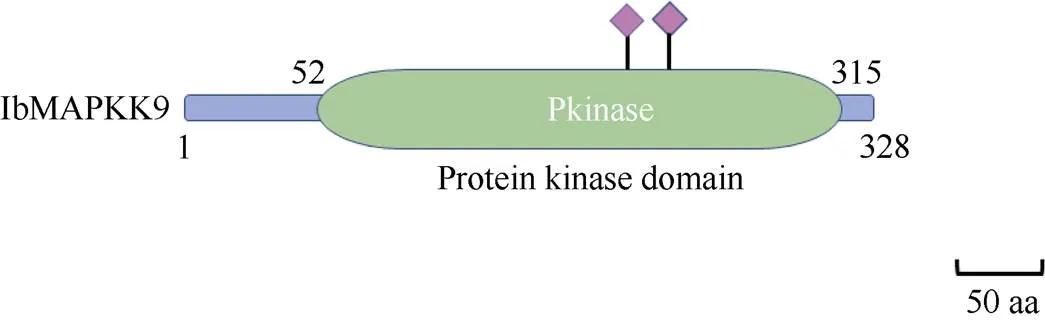
图3 甘薯IbMAPKK9蛋白保守结构域分析
2.1.3 IbMAPKK9蛋白的同源性及进化分析
利用NCBI网站检索与甘薯IbMAPKK9蛋白同源的氨基酸序列, 利用DNAMAN7.0软件进行多序列比对(图7-A), 发现与其他物种氨基酸序列具有较高的同源性, 其中与三裂叶薯、日本牵牛花、本氏烟草、曼陀罗、马铃薯、蔷薇、风铃辣椒、雷公藤、番茄和狭叶羽扇豆的氨基酸序列相似性分别为97.88%、94.61%、76.42%、77.78%、76.18%、71.04%、77.08%、70.30%、75.44%和67.38%。12 个蛋白序列均含有蛋白激酶家族的保守结构域(PF00069)且具有多个连续的保守结合位点。

图4 甘薯IbMAPKK9蛋白质磷酸化位点预测结果

表3 IbMAPKK9蛋白二级结构主要组成元件及比例
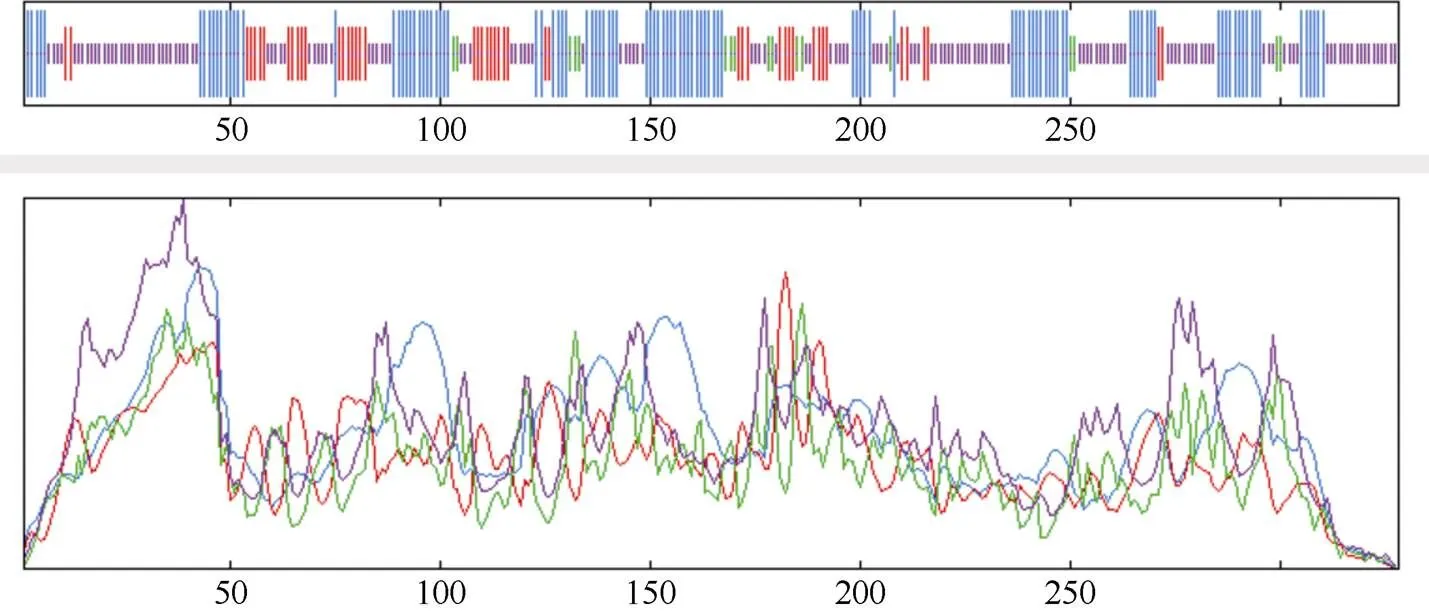
图5 IbMAPKK9蛋白二级结构的预测
蓝色表示α-螺旋(Hh); 红色代表延伸链(Ee); 绿色表示β转角(Tt); 紫色表示无规则卷曲(Cc)。
Blue indicates α-helix (Hh); red represents extension chain (Ee); green is the β-angle (Tt); purple is for random crimp (Cc).
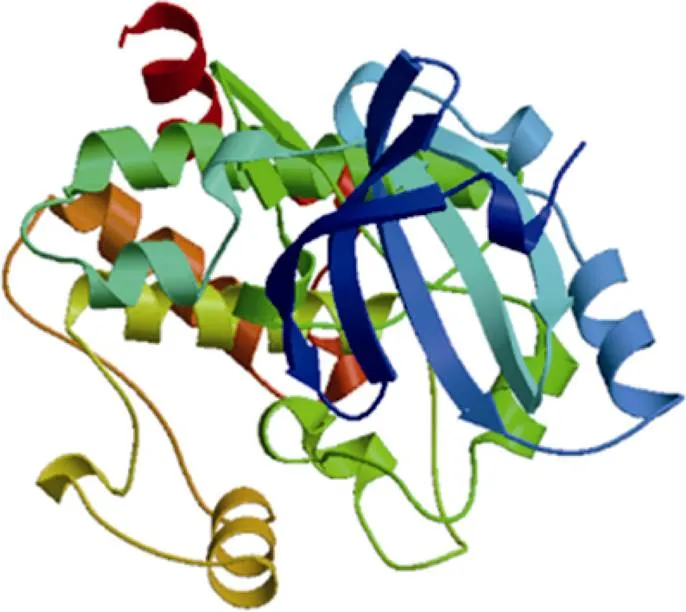
图6 IbMAPKK9蛋白三维结构预测
甘薯与其他11个物种的IbMAPKK蛋白序列的系统进化分析结果显示(图7-B), 甘薯IbMAPKK9蛋白与三叶裂薯蛋白的亲缘关系最近, 与日本牵牛花、番茄和马铃薯亲缘关系次之, 与狭叶羽扇豆亲缘关系最远。拟南芥中对MAPK级联的研究较多, 进一步构建甘薯IbMAPKK9与97个拟南芥MAPK级联成员的系统发育树(图8), 表明, IbMAPKK9蛋白在进化关系上与AtMKK7最近, 推测与AtMKK7可能具有相似的功能。
2.1.4 IbMAPKK9互作蛋白预测分析 甘薯IbMAPKK9互作蛋白预测分析结果如图9所示, 共筛选出10 个互作蛋白(置信度>0.8), 具体信息见表4。其中包括5 个烟草MAPK蛋白, 3 个烟草MAPKKK蛋白以及2个丝氨酸蛋白激酶。说明已有研究中的MAPKK蛋白互作方式以传统MAPK级联途径(MAPKKK-MAPKK-MAPK)为主。相较于MAPKs家族和MAPKKKs家族, MAPKKs家族的基因数目最少,可进一步说明MAPKKs家族基因在MAPK级联途径中起到整合上游刺激信号并向下游传递的作用。
2.2 IbMAPKK9蛋白亚细胞定位验证
WoLF PSORT和PSORT II网站预测结果显示(表5), IbMAPKK9蛋白定位于细胞核的预测分值显著高于其他位置。构建融合表达载体转入农杆菌转化洋葱鳞叶表皮(图10)。结果显示, 转入空载体pCAMBIA 1300-GFP的对照组洋葱鳞叶表皮细胞中均分布绿色荧光信号, 融合表达载体中的荧光信号只分布细胞核中, 证明其定位于细胞核, 与预测结果一致。
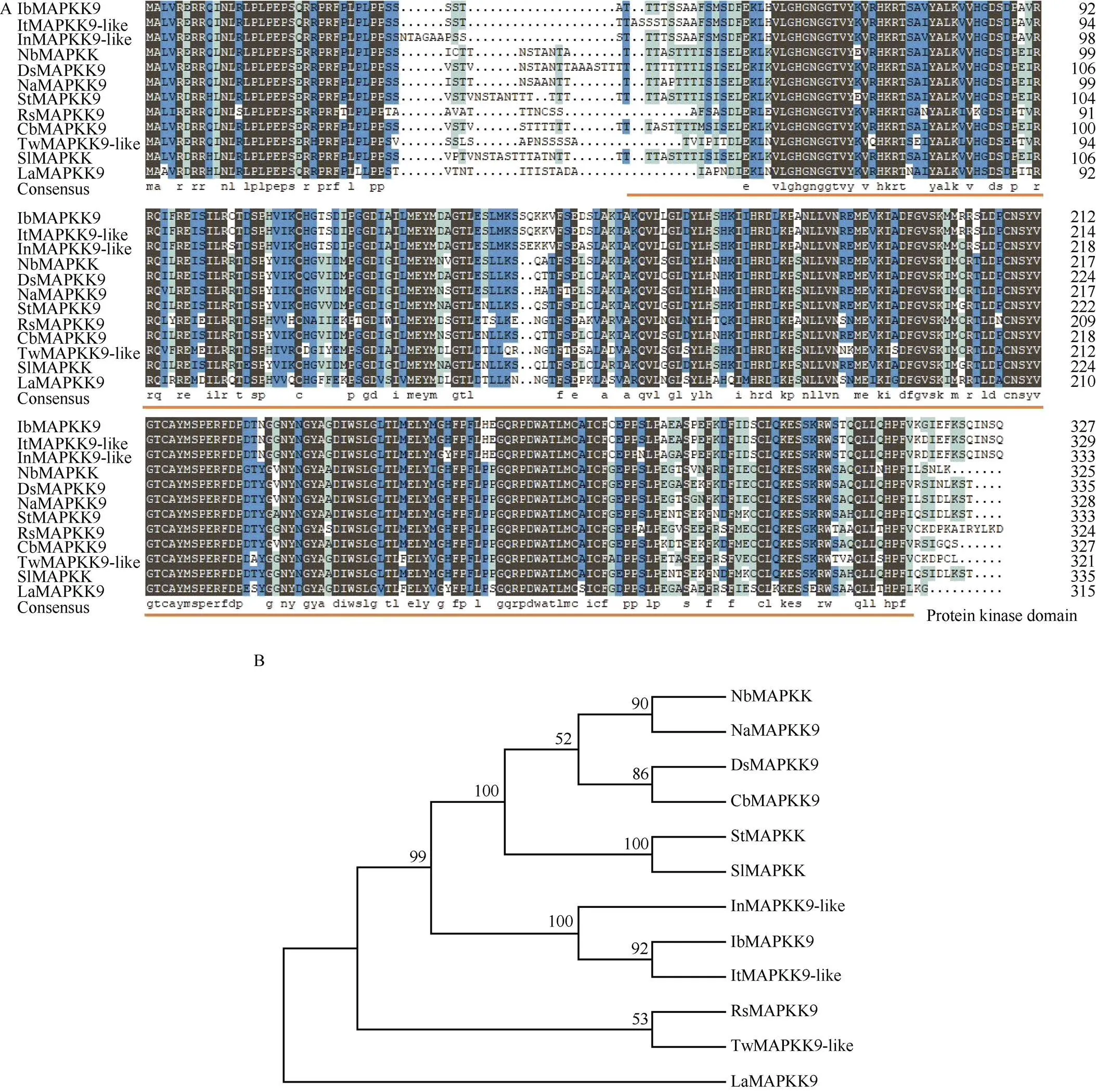
图7 IbMAPKK9蛋白序列比对及亲缘关系
A: IbMAPKK9氨基酸序列比对图。橙线指示蛋白激酶家族保守结构域; B: IbMAPKK9蛋白进化树。IbMAPKK9用红星标注。Ib: 甘薯; It: 三叶裂薯(XP_031110493.1); In: 日本牵牛花(XP_019189439.1); Nb: 本氏烟草(BAE95414.1); Ds: 曼陀罗(MCD7449465.1); Na: 野生烟草(XP_019267338.1); St: 马铃薯(XP_006363984.1); Rs: 蔷薇(ALG02506.1); Cb: 风铃辣椒(PHT53658.1); Tw: 雷公藤(XP_038686910.1); Sl: 番茄(NP_001234595.1); La: 狭叶羽扇豆(XP_019431663.1)。
A: IbMAPKK9 sequence alignment. The protein kinase domain is marked with orange underlines; B: phylogenetic tree of IbMAPKK9 proteins. The IbMAPKK9 is marked with a red star. Ib:; It:(XP_031110493.1); In:(XP_019189439.1); Nb:(BAE95414.1); Ds:(MCD7449465.1); Na:(XP_019267338.1); St:(XP_006363984.1); Rs: Rosa hybrid cultivar(ALG02506.1); Cb:(PHT53658.1); Tw:(XP_038686910.1); Sl:(NP_001234595.1); La:(XP_019431663.1).
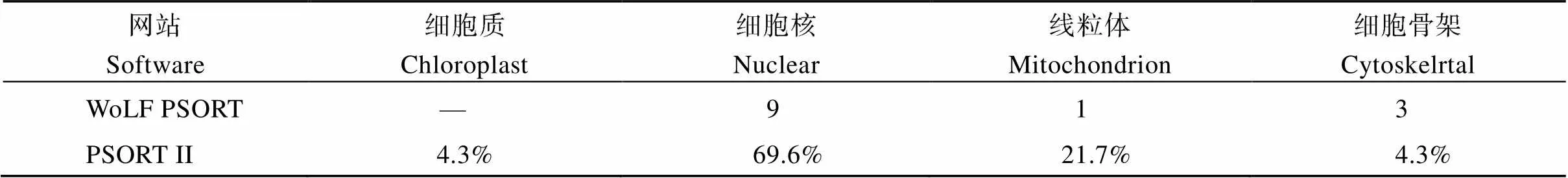
表5 IbMAPKK9蛋白亚细胞定位预测
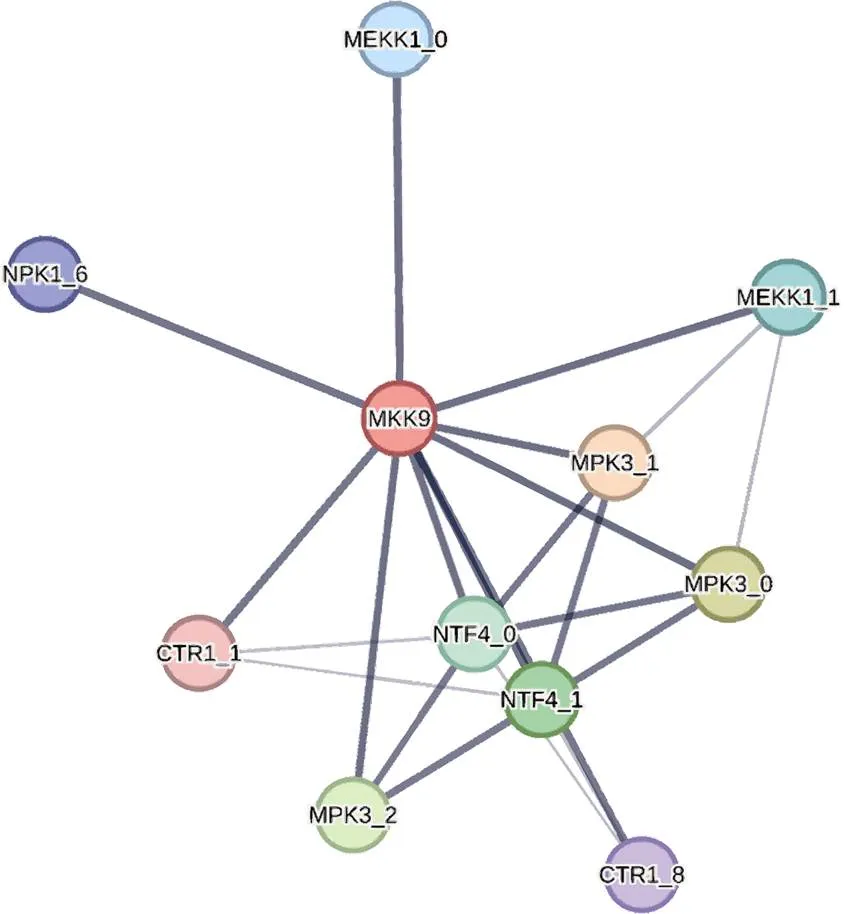
图9 IbMAPKK9的蛋白质互作网络
A: 空GFP合并图; B: 空GFP荧光; C: IbMAPKK9-GFP合并图; D: IbMAPKK9-GFP荧光。
A: null-GFP merge; B: green fluorescence of the null-GFP control; C: IbMAPKK9-GFP merge; D: green fluorescence of IbMAPKK9- GFP control.
2.3 IbMAPKK9基因的表达分析
2.3.1组织特异性表达分析 利用qRT-PCR技术分析在甘薯各器官中的表达特征(图11)发现,基因在根、茎、叶、叶柄各组织部位均表达, 无显著差异, 根中表达量最高, 其次为叶片。
2.3.2基因受病原菌Fob诱导表达
利用qRT-PCR技术分析基因在Fob侵染下的表达模式(图12)发现,响应蔓割病病原菌侵染。Fob侵染后,在“鄂薯11”茎中的转录水平在4 h内逐渐增加, 总体呈现上调趋势, 侵染后24 h与侵染前无显著差异。
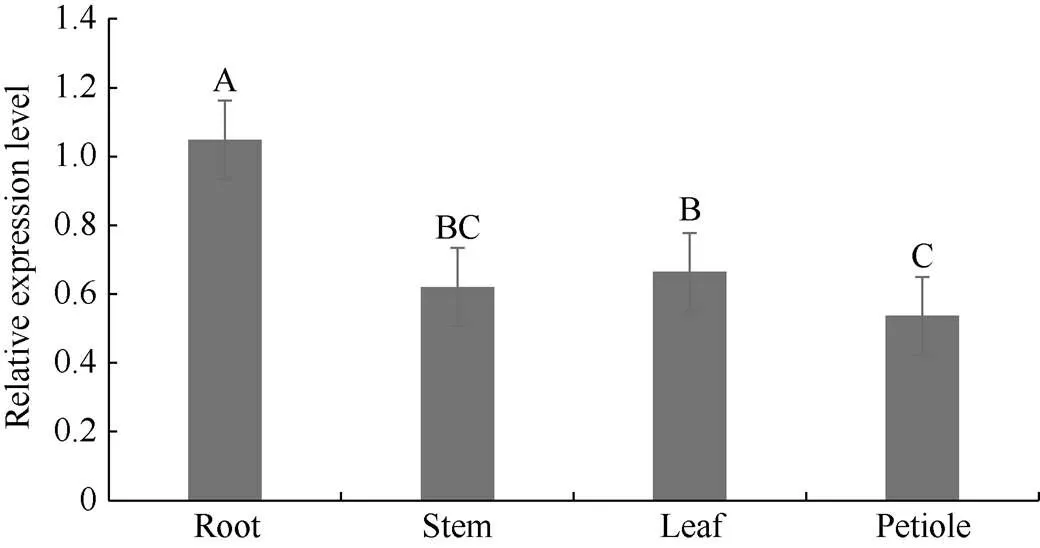
图11 IbMAPKK9基因在不同组织的表达
不同大写字母代表在< 0.01水平差异显著。
Different lowercase letters indicate significant differences at< 0.01.
不同大写字母代表在< 0.01水平差异显著。
Different uppercase letters indicate significant differences at< 0.01.
2.4 IbMAPKK9基因的瞬时功能分析
基因在烟草表皮细胞中的瞬时表达结果如图13所示, 目的基因在细胞核中表达。qRT-PCR分析结果显示(图14), 过表达后以下5个基因在48 h内显著上调, 它们分别是、、、和, 而这些基因与SA生物合成途径与信号转导途径相关, 推测介导水杨酸信号途径影响植物的抗性。
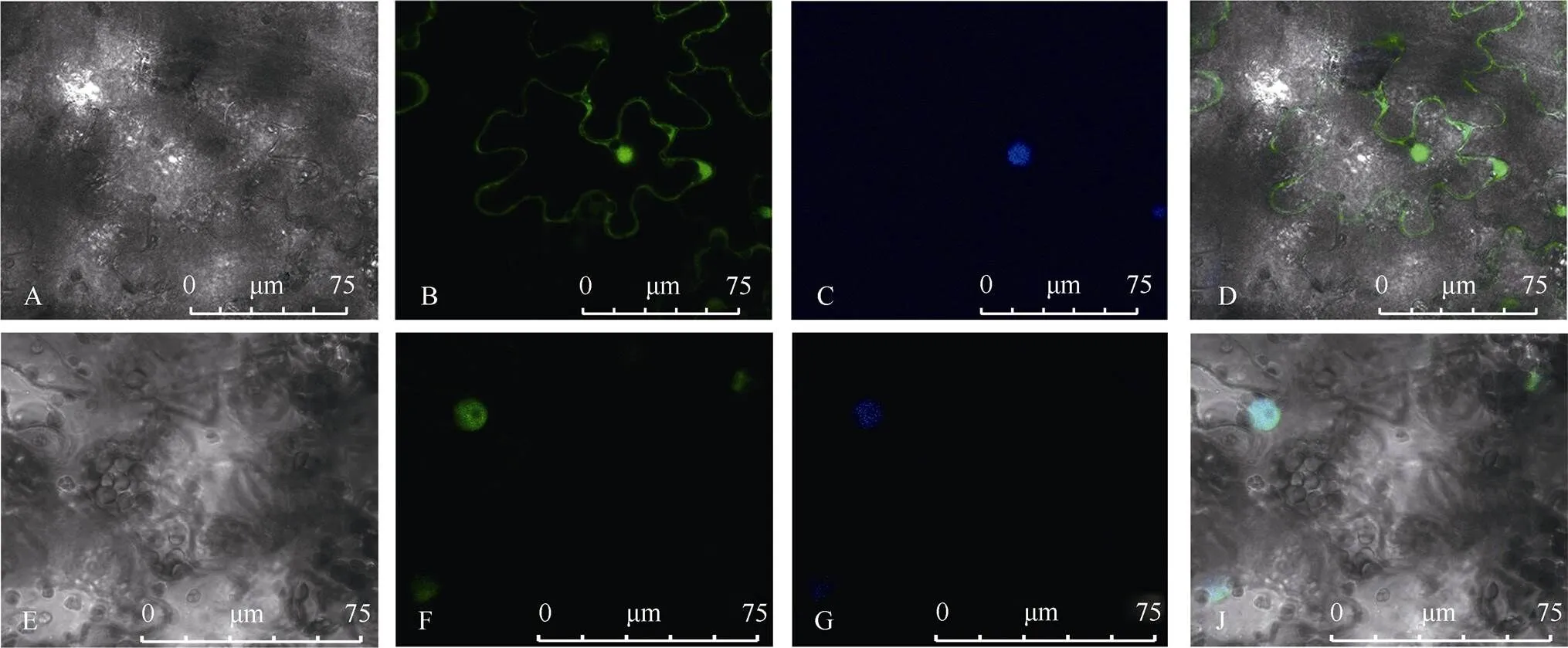
图13 IbMAPKK9基因在烟草表皮细胞中的瞬时表达
A: 空GFP明场; B: 空GFP荧光; C: 空GFP DAPI荧光染料; D: 空GFP合并图; E: IbMAPKK9-GFP明场; F: IbMAPKK9-GFP荧光; G: IbMAPKK9-GFP DAPI荧光染料; H: IbMAPKK9-GFP合并图。
A: bright field of null-GFP; B: green fluorescence of null-GFP control; C: null-GFP with DAPI; D: null-GFP merge; E: bright field of IbMAPKK9-GFP; F: green fluorescence of IbMAPKK9-GFP control; G: IbMAPKK9-GFP with DAPI; H: IbMAPKK9-GFP merge.
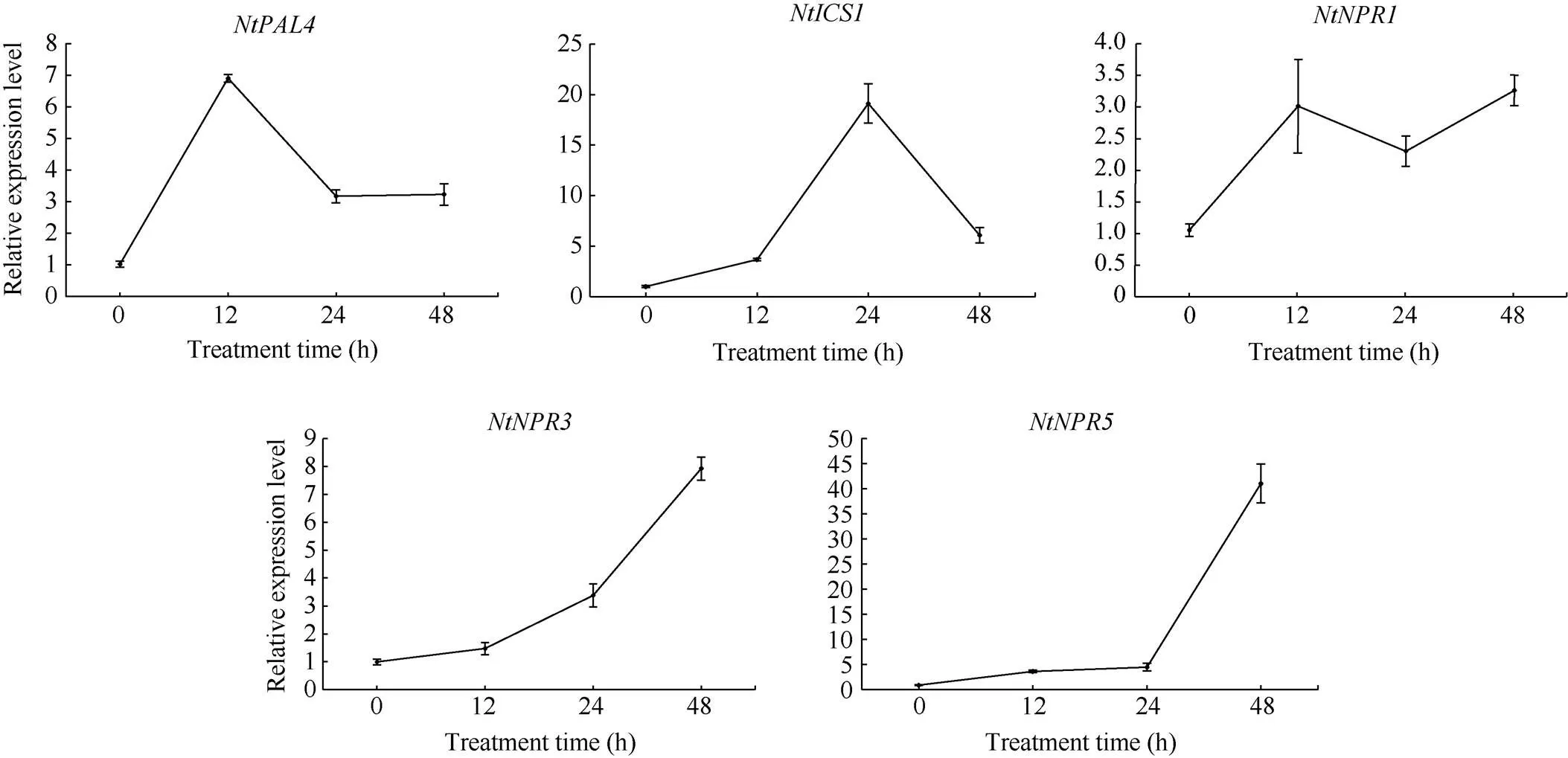
图14 烟草NtPAL4、NtICS1、NtNPR1、NtNPR3和NtNPR5的表达分析
3 讨论
丝裂原激活蛋白激酶(MAPK)级联广泛参与植物体内多种生理生化反应, 已有报道中MAPK和MAPKKK家族基因数量均较多, 对MAPKK家族基因的研究仅见于拟南芥、番茄、烟草等少数植物材料, 基因数量尤其稀少。研究发现, 一个往往参与多种作用机制且连接多个反应, 是信号从上游转导到靶点的主要端口, 在植物响应干旱、损伤、盐等胁迫过程中起到重要调节作用, 因此基因的研究对MAPK级联反应尤为重要[36]。烟草中,可以通过激活来调节盐胁迫信号[37]。基因的过表达增强了和的转录, 并正调控拟南芥对低温及盐度胁迫的抗性; 过表达则提高了转基因拟南芥植株对盐胁迫的敏感性[38-39]。过表达能够增强转基因烟草对茄疫病菌的抗性与对卵菌病原菌疫霉菌的敏感性[40]。可调节气孔大小及根毛发育以增强棉花的抗旱性[41]。通过磷酸化激活介导的ABA信号通路提高水稻对干旱胁迫的耐受性[42]。迄今为止, 有关甘薯MAPKKs家族基因的研究较少, 其响应生物与非生物逆境胁迫的调控机制尚不清楚。
本研究在高抗蔓割病甘薯品种“鄂薯11”中克隆得到, 生物信息学分析结果表明, 甘薯IbMAPKK9是等电点为8.55的不稳定亲水蛋白质, 含有含丝氨酸、苏氨酸和少数络氨酸蛋白磷酸化结合位点, 预测结果符合MAPKKs蛋白主要通过丝氨酸、苏氨酸和络氨酸残基磷酸化接收与传递信号。氨基酸序列比对结果显示, 甘薯IbMAPKK9与其他11 种植物材料的序列相似性接近80%, 均具有一个保守结构域PF00069, 说明其在进化上高度保守。同时克隆到了起始密码子ATG上游1620 bp启动子序列, PlantCARE在线分析表明启动子区包含多种激素相关及胁迫响应元件, 其中乙烯响应元件ERE、茉莉酸甲酯应答元件G-box、赤霉素应答元件P-box、水杨酸应答元件TCA-element、脱落酸应答元件ABRE和胁迫响应元件MYB、MYC的存在表明可能参与激素调节、生物胁迫或非生物胁迫的应答。qRT-PCR分析显示, 目的基因在根、茎、叶、叶柄各组织部位均表达, 且在Fob侵染后明显提高, 说明可能在甘薯早期响应蔓割病病原菌侵染中起到重要作用。
水杨酸是SAR的关键信号分子之一, 在植物免疫中发挥关键作用。在烟草中瞬时表达基因显著增强了、、、和的转录水平, 其中,被证明是SA的受体, 能够感知SA信号从而形成抗病信号转导途径, 使植物建立系统获得抗病性, NPR3是NPR1的同源蛋白[43-44],被诱导表达能够促进SA积累进而增强植物抗病性[45],参与调控植物正常生长和病原菌侵染时SA的生物合成[46], 说明可能介导SA的生物合成途径与信号转导途径。系统发育分析结果显示, IbMAPKK9蛋白在进化关系上与AtMKK7最近, 推测与AtMKK7可能具有相似的功能, 前人已经证明表达量的增加导致拟南芥激活标记突变体累积SA水平的升高, 正向调控植物基部和系统获得抗性; 组成性活跃的MKK7或MKK9的异位表达也会激活和表达[39,47-48]。以上结果表明,可能介导水杨酸诱导的信号途径从而影响植物的抗性, 有待进一步利用转基因植株进行功能验证。
4 结论
甘薯的CDS序列全长987 bp, 其编码蛋白定位于细胞核, 具有蛋白激酶家族典型特征。蛋白序列与同源物种相似度高, 在进化上具备高保守性。基因启动子范围内存在多种激素相关(茉莉酸甲酯、乙烯、脱落酸、赤霉素、水杨酸)及胁迫相关响应元件。在甘薯根、茎、叶和叶柄中均表达, 并响应甘薯蔓割病侵染, 瞬时表达引起5个与水杨酸合成途径及信号转导途径相关的基因在48 h内表达上调, 推测IbMAPKK9通过介导水杨酸信号途径影响植物的抗性。
[1] 王欣, 李强, 曹清河, 马代夫. 中国甘薯产业和种业发展现状与未来展望. 中国农业科学, 2021, 54: 483–492. Wang X, Li Q, Cao Q H, Ma D F. Current status and future prospective of sweetpotato production and seed industry in China., 2021, 54: 483–492 (in Chinese with English abstract).
[2] 刘中华, 林志坚, 李华伟, 邱永祥, 邱思鑫, 张鸿, 余华, 蓝春准. 甘薯蔓割病抗性相关SRAP标记的获得. 福建农业学报, 2017, 32: 639–644.Liu Z H, Lin Z J, Li H W, Qiu Y X, Qiu S X, Zhang H, Yu H, Lan C Z. SRAP marker associated with Fusarium-wilt resistance gene in sweet potato., 2017, 32: 639–644 (in Chinese with English abstract).
[3] 方树民, 陈玉森. 福建省甘薯蔓割病现状与研究进展. 植物保护, 2004, 30(5): 19–22. Fang S M, Chen Y S. Advances in the research of sweet potato Fusarium wilt in Fujian province.,2004, 30(5): 19–22 (in Chinese with English abstract).
[4] 雷剑, 杨新笋, 郭伟伟, 苏文瑾, 王连军. 甘薯蔓割病研究进展. 湖北农业科学, 2011, 50: 4775–4777.Lei J, Yang X S, Guo W W, Su W J, Wang L J. Advances in research on sweet potato Fusarium wilt., 2011, 50: 4775–4777 (in Chinese with English abstract).
[5] 刘意, 刘泓江, 陈培茹, 杨新笋, 雷剑, 王连军, 柴沙沙, 靳晓杰, 杨圆圆, 程贤亮, 焦春海, 张文英. 甘薯响应蔓割病病原菌侵染的基因克隆与表达分析. 中国农业大学学报, 2022, 27(6): 91–99. Liu Y, Liu H J, Chen P R, Yang X S, Lei J, Wang L J, Chai S S, Jin X J, Yang Y Y, Cheng X L, Jiao C H, Zhang W Y. Cloning and expression analysis ofgene in response tof. sp.infection in sweet potato., 2022, 27(6): 91–99 (in Chinese with English abstract).
[6] Sun T, Nitta Y, Zhang Q, Wu D, Tian H, Lee J S, Zhang Y. Antagonistic interactions between two MAP kinase cascades in plant development and immune signaling., 2018, 19: e45324.
[7] Zhang M, Zhang S. Mitogen-activated protein kinase cascades in plant signaling., 2022, 64: 301–341.
[8] Colcombet J, Hirt H.MAPKs: a complex signalling network involved in multiple biological processes., 2008, 413: 217–226.
[9] Liu Y, Leary E, Saffaf O, Frank Baker R, Zhang S. Overlapping functions of YDA and MAPKKK3/MAPKKK5 upstream of MPK3/MPK6 in plant immunity and growth/development., 2022, 64: 1531–1542.
[10] Xu J, Zhang S. Mitogen-activated protein kinase cascades in signaling plant growth and development., 2015, 20: 56–64.
[11] Zhang M, Su J, Zhang Y, Xu J, Zhang S. Conveying endogenous and exogenous signals: MAPK cascades in plant growth and defense., 2018, 45: 1–10.
[12] Krysan P J, Jester P J, Gottwald J R, Sussman M R. Anmitogen-activated protein kinase kinase kinase gene family encodes essential positive regulators of cytokinesis., 2002, 14: 1109–1120.
[13] Beck M, Komis G, Müller J, Menzel D, Samaj J. Arabidopsis homologs of nucleus- and phragmoplast-localized kinase 2 and 3 and mitogen-activated protein kinase 4 are essential for microtubule organization., 2010, 22: 755–771.
[14] Kosetsu K, Matsunaga S, Nakagami H, Colcombet J, Sasabe M, Soyano T, Takahashi Y, Hirt H, Machida Y. The MAP kinase MPK4 is required for cytokinesis in., 2010, 22: 3778–3790.
[15] Li N, Xu R, Li Y. Molecular networks of seed size control in plants., 2019, 70: 435–463.
[16] Liu Y, Zhang D, Wang L, Li D. Genome-wide analysis of mitogen-activated protein kinase gene family in maize., 2013, 31: 1446–1460.
[17] Kong X, Pan J, Zhang D, Jiang S, Cai G, Wang L, Li D. Identification of mitogen-activated protein kinase kinase gene family and MKK-MAPK interaction network in maize., 2013, 441: 964–969.
[18] Hamel L P, Nicole M C, Sritubtim S, Morency M J, Ellis M, Ehlting J, Beaudoin N, Barbazuk B, Klessig D, Lee J, Martin G, Mundy J, Ohashi Y, Scheel D, Sheen J, Xing T, Zhang S, Seguin A, Ellis B E. Ancient signals: comparative genomics of plant MAPK and MAPKK gene families., 2006, 11: 192–198.
[19] Zhan H, Yue H, Zhao X, Wang M, Song W, Nie X. Genome-wide identification and analysis of MAPK and MAPKK gene families in bread wheat (L.)., 2017, 8: 284.
[20] Chen L, Hu W, Tan S, Wang M, Ma Z, Zhou S, Deng X, Zhang Y, Huang C, Yang G, He G. Genome-wide identification and analysis of MAPK and MAPKK gene families in., 2012, 7: e46744.
[21] Gao M, Liu J, Bi D, Zhang Z, Cheng F, Chen S, Zhang Y. MEKK1, MKK1/MKK2 and MPK4 function together in a mitogen-activated protein kinase cascade to regulate innate immunity in plants., 2008, 18: 1190–1198.
[22] Qiu J L, Zhou L, Yun B W, Nielsen H B, Fiil B K, Petersen K, Mackinlay J, Loake G J, Mundy J, Morris P C.mitogen-activated protein kinase kinases MKK1 and MKK2 have overlapping functions in defense signaling mediated by MEKK1, MPK4, and MKS1., 2008, 148: 212–222.
[23] Teige M, Scheikl E, Eulgem T, Dóczi R, Ichimura K, Shinozaki K, Dangl J L, Hirt H. The MKK2 pathway mediates cold and salt stress signaling in., 2004, 15: 141–152.
[24] Sethi V, Raghuram B, Sinha A K, Chattopadhyay S. A mitogen-activated protein kinase cascade module, MKK3-MPK6 and MYC2, is involved in blue light-mediated seedling development in., 2014, 26: 3343–3357.
[25] Takahashi F, Yoshida R, Ichimura K, Mizoguchi T, Seo S, Yonezawa M, Maruyama K, Yamaguchi-Shinozaki K, Shinozaki K. The mitogen-activated protein kinase cascade MKK3-MPK6 is an important part of the jasmonate signal transduction pathway in., 2007, 19: 805–818.
[26] Bi G, Zhou Z, Wang W, Li L, Rao S, Wu Y, Zhang X, Menke F L H, Chen S, Zhou J M. Receptor-like cytoplasmic kinases directly link diverse pattern recognition receptors to the activation of mitogen-activated protein kinase cascades in., 2018, 30: 1543–1561.
[27] Shao Y, Yu X, Xu X, Li Y, Yuan W, Xu Y, Mao C, Zhang S, Xu J. The YDA-MKK4/MKK5-MPK3/MPK6 cascade functions downstream of the RGF1-RGI ligand-receptor pair in regulating mitotic activity in root apical meristem., 2020, 13: 1608–1623.
[28] Su J, Zhang M, Zhang L, Sun T, Liu Y, Lukowitz W, Xu J, Zhang S. Regulation of stomatal immunity by interdependent functions of a pathogen-responsive MPK3/MPK6 cascade and abscisic acid., 2017, 29: 526–542.
[29] Thulasi Devendrakumar K, Li X, Zhang Y. MAP kinase signalling: interplays between plant PAMP- and effector-triggered immunity., 2018, 75: 2981–2989.
[30] Kong X, Sun L, Zhou Y, Zhang M, Liu Y, Pan J, Li D. ZmMKK4 regulates osmotic stress through reactive oxygen species scavenging in transgenic tobacco., 2011, 30: 2097–2104.
[31] Wu D, Ji J, Wang G, Guan W, Guan C, Jin C, Tian X. LcMKK, a novel group A mitogen-activated protein kinase kinase gene in, confers dehydration and drought tolerance in transgenic tobacco via scavenging ROS and modulating expression of stress-responsive genes., 2015, 76: 269–279.
[32] Cardinale F, Meskiene I, Ouaked F, Hirt H. Convergence and divergence of stress-induced mitogen-activated protein kinase signaling pathways at the level of two distinct mitogen-activated protein kinase kinases., 2002, 14: 703–711.
[33] 雷剑, 杨新笋, 苏文瑾, 王连军, 柴沙沙. 十个甘薯品种对蔓割病的抗性鉴定. 湖北农业科学, 2014, 53: 5422–5423. Lei J, Yang X S, Su W J, Wang L J, Chai S S. Resistance identification of 10 sweetpotato varieties against Fusarium wilt., 2014, 53: 5422–5423 (in Chinese with English abstract).
[34] 陈选阳, 林羽立, 张招娟, 邹为坤. 一种快速检测甘薯蔓割病抗性的方法. 福建: CN105075823A, 2015-11-25. Chen X Y, Lin Y L, Zhang Z J, Zou W K. A rapid method for detecting the resistance of sweet potato to Fusarium wilt. Fujian: CN105075823A, 2015-11-25 (in Chinese with English abstract).
[35] 濮雪, 王凯彤, 张宁, 司怀军. 马铃薯基因表达分析及互作蛋白筛选与鉴定. 作物学报, 2023, 49: 36–45. Pu X, Wang K T, Zhang N, Si H J. Relative expression analysis ofgene and screening and identification of its interacting proteins in potato (L.)., 2023, 49: 36–45 (in Chinese with English abstract).
[36] Sun T, Zhang Y. MAP kinase cascades in plant development and immune signaling., 2022, 23: e53817.
[37] Kiegerl S, Cardinale F, Siligan C, Gross A, Baudouin E, Liwosz A, Eklöf S, Till S, Bögre L, Hirt H, Meskiene I. SIMKK, a mitogen-activated protein kinase (MAPK) kinase, is a specific activator of the salt stress-induced MAPK, SIMK., 2000, 12: 2247–2258.
[38] Xing Y, Jia W, Zhang J. AtMKK1 mediates ABA-induced CAT1 expression and H2O2production via AtMPK6-coupled signaling in., 2008, 54: 440–451.
[39] Xu J, Li Y, Wang Y, Liu H, Lei L, Yang H, Liu G, Ren D. Activation of MAPK kinase 9 induces ethylene and camalexin biosynthesis and enhances sensitivity to salt stress in., 2008, 283: 26996–27006.
[40] Zhang L, Li Y, Lu W, Meng F, Wu C A, Guo X. Cottonaffects disease resistance, induces HR-like cell death, and reduces the tolerance to salt and drought stress in transgenic., 2012, 63: 3935–3951.
[41] Wang C, Lu W, He X, Wang F, Zhou Y, Guo X, Guo X. The cotton mitogen-activated protein kinase kinase 3 functions in drought tolerance by regulating stomatal responses and root growth., 2016, 57: 1629–1942.
[42] Ma H, Chen J, Zhang Z, Ma L, Yang Z, Zhang Q, Li X, Xiao J, Wang S. MAPK kinase 10.2 promotes disease resistance and drought tolerance by activating different MAPKs in rice., 2017, 92: 557–570.
[43] Wu Y, Zhang D, Chu JY, Boyle P, Wang Y, Brindle I D, De Luca V, Després C. TheNPR1 protein is a receptor for the plant defense hormone salicylic acid., 2012, 1: 639–647.
[44] Zhou Y, Park S H, Chua N H. UBP12/UBP13-mediated deubiquitination of salicylic acid receptor NPR3 suppresses plant immunity., 2023, 16: 232–244.
[45] Wildermuth M C, Dewdney J, Wu G, Ausubel F M. Isochorismate synthase is required to synthesize salicylic acid for plant defence., 2001, 414: 562–565.
[46] Huang J, Gu M, Lai Z, Fan B, Shi K, Zhou Y H, Yu J Q, Chen Z. Functional analysis of thegene family in plant growth, development, and response to environmental stress., 2010, 153: 1526–1538.
[47] Yoo S D, Cho Y H, Tena G, Xiong Y, Sheen J. Dual control of nuclear EIN3 by bifurcate MAPK cascades in C2H4 signalling., 2008, 451: 789–795.
[48] Zhang X, Dai Y, Xiong Y, DeFraia C, Li J, Dong X, Mou Z. Overexpression ofMAP kinase kinase 7 leads to activation of plant basal and systemic acquired resistance., 2007, 52: 1066–1079.
Cloning and characterization ofgene associated withf. spin sweet potato
JING Xiao-Jing1,2, YANG Xin-Sun2, JIN Xiao-Jie2, LIU Yi3, LEI Jian2, WANG Lian-Jun2, CHAI Sha-Sha2, ZHANG Wen-Ying1,*, and JIAO Chun-Hai2,*
1College of Agriculture, Yangtze University, Jingzhou 434025, Hubei, China;2Food Crops institute, Hubei Academy of Agricultural Sciences, Wuhan 430064, Hubei, China;3Horticulture College, Hainan University / Key Laboratory for Quality Regulation of Tropical Horticultural Plants of Hainan Province, Haikou 570228, Hainan, China
Mitogen-activated protein kinase (MAPK) cascades are important signaling modules in all organisms, which widely exist in plants. Mitogen-activated protein kinase kinase (MAPKKs) are located in the middle of the cascade reaction pathway and play the key roles in signal divergence. The disease resistance genewas screened and cloned based ontranscriptome data in sweetpotato, which contained a 987 bp open reading frame, encoding 328 amino acids and 1 domain (PF00069). Its protein mainly consisted of α-helixes and random coils. Multiple hormones (methyl jasmonate, ethylene, abscisic acid, gibberellin, and salicylic acid) and stress-related response elements were detected in the promoter region. Homologous protein comparison showed that IbMAPKK9 was closely related to ItMAPKK9-like (XP_031110493.1), InMAPKK9-like (XP_019189439.1), SlMAPKK9 (NP_001234595.1), and StMAPKK9 (XP_006363984.1). Besides,gene encoded nuclear localization protein. The relative expression levels revealed thatwas expressed in roots, stems, leaves, and petioles in response tof. sp(Fob) infection. Transient expression analysis showed thatinduced up-regulation of 5 genes related to salicylic acid synthesis pathway and signal transduction pathway within 48 hours, suggesting thataffected plant resistance by mediating salicylic acid signal pathway. This study can provide a theoretical basis for further analysis of the biological function of.
sweet potato;; Fusarium wilt; gene clone; subcellular localization; transient expression
2023-05-24;
2023-06-04.
10.3724/SP.J.1006.2023.24284
通信作者(Corresponding author): 张文英, E-mail: wyzhang@yangtzeu.edu.cn; 焦春海, E-mail: jiaoch@hotmail.com
E-mail: 15172397885@163.com
2022-12-23;
本研究由国家重点研发计划项目(2019YFD1001300, 2019YFD1001305)和财政部和农业农村部国家现代农业产业技术体系建设专项(甘薯, CARS-10)资助。
This study was supported by the National Key Research and Development Program of China (2019YFD1001300, 2019YFD1001305) and the China Agriculture Research System of MOF and MARA (Sweetpotato, CARS-10).
URL: https://kns.cnki.net/kcms2/detail/11.1809.S.20230602.1136.004.html
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).

