一株分离自牦牛乳中的副干酪乳杆菌ZZ102对溃疡性结肠炎的缓解作用研究
侯保秋,董怡文,刘方
(1.郑州大学第五附属医院,郑州 450052;2.西藏民族大学,陕西咸阳 712000)
0 引言
炎症性肠病(IBD)是一种以非特异性为特征的慢性自身免疫性疾病[1],主要包括克罗恩病(CD)和溃疡性结肠炎(UC)[2-3],其发病机制尚不清楚,临床症状表现为持续性的腹泻,腹部疼痛,发热,呕吐等[4-5]。IBD的发病率和流行范围日益增加,我国是亚洲发病率最高的国家之一,已有超过150 万的人群患有此病[6-7]。目前,有多种方法可应用于肠道炎症的治疗,其中常规药物治疗被广泛应用,但长期服药会给机体带来不可避免的副作用[8]。因此,需寻求安全可靠且无副作用的治疗方式来缓解肠道炎症[9]。益生菌制剂辅助治疗是一种安全可靠的方式,可以通过改善肠道屏障、调节机体免疫反应等方面缓解炎症性肠病[10-12],最常见的益生菌制剂有乳酸杆菌和双歧杆菌[13-15]。Liu 等[16]使用植物乳杆菌23-1 对肥胖小鼠进行干预,结果表明干预后可有效缓解肥胖引起的氧化应激和炎症反应。Kaur 等[17]评估了含有鼠李糖乳杆菌MTCC-5897 的乳清对DSS 诱导小鼠溃疡性结肠炎的潜在保护作用,结果表明经乳清干预后,肠道中促炎因子水平显著降低,抗炎因子水平显著提高,推测其可以有效预防结肠炎诱导的炎症。因此,本研究以副干酪乳杆菌L.paracasei ZZ102 为研究对象,通过灌胃不同剂量来探究对结肠炎小鼠肠道炎症的缓解作用。
1 材料与方法
1.1 菌株、细胞及试验小鼠
11 株菌株均为实验室保藏的分离自牦牛乳中的乳酸杆菌,具体信息如表1 所示。所用细胞为Caco-2细胞(人克隆结肠癌细胞),购于中国科学院上海生命科学研究所。试验动物为48 只雄性C57BL/6 小鼠,购于北京维通利华实验动物技术有限公司。

表1 试验菌株相关信息
1.2 试剂
MRS 琼脂培养基、MRS 肉汤培养基,青岛高科技工业园海博生物技术有限公司;氯化钠,天津市东丽区天大化学试剂厂;PBS 缓冲液,北京索来宝生物科技有限公司;胰酶,Hyclone 公司;DMEM 高糖培养液,吉诺生物医药技术有限公司;葡聚糖硫酸钠,美国MP Biomedical 公司;美沙拉嗪,杭州巴洛特生物科技有限公司;MPO 检测试剂盒,南京建成生物工程研究所;各细胞因子检测试剂盒,南京建成生物工程研究所。
1.3 仪器与设备
电子天平,瑞士Mettler Toledo 有限公司;超净工作台,北京东联哈尔仪器有限公司;CO2培养箱,上海力申科学仪器有限公司;酶标仪,美国Molecular Devices 公司;高速冷冻离心机,德国Sigma 有限公司;恒温水浴锅,天津泰斯特仪器有限公司;Quick Drop 测定仪,美国Bio-rad 公司。
1.4 菌株的活化与保藏
取冻存管中的菌液,以5%的接种量于MRS 肉汤中,37 ℃培养18~24 h,获得一代菌液。取一代菌液进行三区划线,37 ℃培养48~72 h 后挑取单菌落至MRS 肉汤中继续培养18~24 h。将最终菌液与80%(V/V)灭菌后的甘油以3∶1 的比例混匀,-80 ℃保藏备用。
1.5 乳酸菌的筛选
1.5.1 细胞的培养
将Caco-2 细胞从液氮中取出,迅速放置于37 ℃水浴锅解冻,之后接种于DMEM 高糖培养液中,于CO2细胞培养箱中培养数日,次日更换细胞培养液,当有80%左右的细胞贴壁且铺满细胞培养瓶底部时即可进行传代,传至3 代平铺于细胞培养瓶的单层细胞进行后续研究。
1.5.2 乳酸菌与细胞共培养
将菌液离心后收集菌体,然后重悬于DMEM 高糖培养液中。将细胞(每孔106个)接种于六孔板中,待细胞培养至极化状态后,将重悬于DMEM 高糖培养液的乳酸菌与细胞共同培养2 h 后进行后续研究(细胞培养液需在乳酸菌加入前的24 h 更换为不含抗生素的培养基)。
1.5.3 黏附率测定
乳酸菌与细胞共培养后,用灭菌后的PBS 进行洗涤,并用胰酶消化收集的细胞,然后使用无菌生理盐水稀释到合适浓度后进行涂布,于37 ℃培养48 h 后进行菌落计数。黏附率公式如下:
黏附率=黏附后的菌落数/黏附前的菌落数×100
1.6 试验动物分组
试验动物选用6~8 周、雄性C57BL/6 小鼠,体重为(20±2)g,动物伦理审核编号KY2021004。48 只小鼠基础饲料、饮用水喂养一周后被随机分为6 组(n=8只/组):Control(对照组)、DSS(DSS 组)、DSS+106L.paracasei ZZ102(低剂量组)、DSS+107L.paracasei ZZ102(中剂量组)、DSS+108L.paracasei ZZ102(高剂量组)以及DSS+美沙拉嗪(药物组)。从第8 d 起直至结束,每天上午同一时间,低、中、高剂量组分别灌胃106、107和108CFU/mL 的L.paracasei ZZ102 菌悬液200 μL,药物组小鼠灌胃10 mg/mL 的美沙拉嗪200 μL,其余两组灌胃相同量的生理盐水。从第15 天开始,除对照组饮用正常纯净水外,其他组小鼠的饮用水均加入3%(W/V)的DSS 溶液,构建结肠炎小鼠的模型。动物试验的具体分组情况如表2 所示。

表2 动物试验的基本情况
1.7 结肠炎的评估
1.7.1 体重
建模期间,每天称量小鼠体质量并计算体质量下降率。具体计算方法如下:
体质量下降率=(W1-W2)/W1×100
W1:第14 d 的小鼠体质量(g),W2:15~21 d 的小鼠体质量(g)。
1.7.2 脾脏指数
脾脏指数的计算方法如下:
脾脏指数=脾脏质量/最终体质量×10
1.7.3 髓过氧化物酶(MPO)活性
小鼠处死后,收集全血,离心收集血清,于-20 ℃保存备用。取小鼠血清在4 ℃、3 000 r/min 离心20 min得到上清液。按照MPO 检测试剂盒对各组血清MPO的活性进行测定。
1.7.4 结肠细胞因子
取小鼠结肠组织(30 mg 左右),剪碎后置于研钵中,以1∶9 的比例加入9 倍预冷的无菌PBS 溶液研磨成浆液后以3 000 r/min 离心20 min,收集上清于-20 ℃保存。按照试剂盒说明书进行细胞因子TNF-α、IL-6、IL-1β、IL-10 含量的测定。
1.8 统计分析
采用GraphPad Prism 8.02 软件作图并对数据进行统计学分析,试验结果以平均值±标准差(Mean±SD)表示。所有试验重复3 次
2 结果与分析
2.1 各菌株黏附能力的差异
乳酸菌与肠上皮细胞的特异性黏附能力的强弱是其发挥益生作用的关键[13]。各乳酸菌菌株与Caco-2细胞的黏附结果如图1 所示。从图1 可以看出,L.casei ZZ085、L.paracasei ZZ102 和L.plantarum ZZ112具有较高的黏附率,其中L.paracasei ZZ102 的黏附率最高,达到了78.39%。剩余菌株的黏附率在19.78%到68.49%之间不等,与L.paracasei ZZ102 相比具有统计学差异(P<0.05)。因此,本研究选取L.paracasei ZZ102进行后续研究。

图1 不同菌株的黏附率
2.2 L.paracasei ZZ102 对小鼠常规指标的影响
2.2.1 体重
小鼠的体质量变化情况如图2 所示。由图可以看出,造模期间Control 组小鼠体质量呈现轻微上升趋势,而其他组小鼠体质量呈现不同程度的下降趋势。在整个造模期间,DSS 组小鼠体质量与初始体重相比下降了17%,下降趋势最大;其次为灌胃低、中剂量L.paracasei ZZ102 的小鼠,体质量分别下降了16.67%和15%。与DSS 组相比,灌胃高剂量L.paracasei ZZ102 和美沙拉嗪组的小鼠体质量下降明显减少,分别下降了13.67%和10%,表明灌胃L.paracasei ZZ102 和美沙拉嗪可以缓解小鼠的体质量下降趋势。

图2 小鼠体质量变化
2.2.2 脾脏质量与脾脏指数
脾脏是机体最大的免疫器官,是免疫细胞居住和产生应答的重要产所[18-19]。从图3 中可以看出,与Control组相比,其余5 组小鼠的脾脏质量和脾脏指数均有所增加,其中DSS 组增加最为明显。灌胃低、中、高剂量的L.paracasei ZZ102 小鼠的脾脏质量和脾脏指数均有所下降,其中灌胃高剂量L.paracasei ZZ102 小鼠的脾脏质量和脾脏指数下降最为明显,表明灌胃L.paracasei ZZ102 可以有效改善结肠炎小鼠的脾肿大,进一步调节机体的免疫功能。
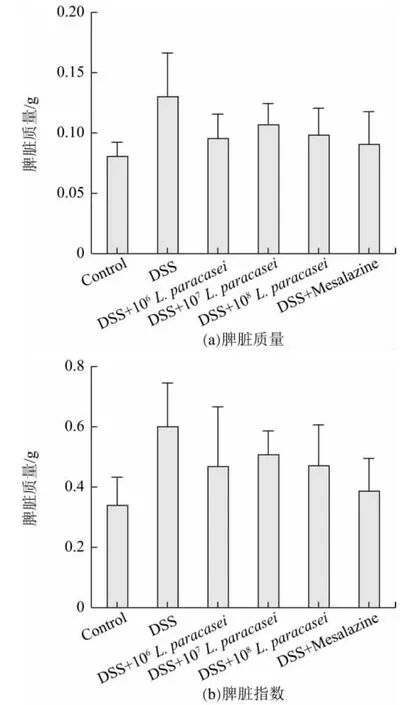
图3 小鼠脾脏质量与脾脏指数变化
2.2.3 血清MPO 活性
MPO 活性是衡量结肠炎炎症程度的重要指标之一,与肠道炎症呈正相关关系,同时还可进入到细胞外液参与循环[20]。通过灌胃不同剂量L.paracasei ZZ102 来探究小鼠血清MPO 活性的变化,结果如图4 所示。由图可以看出,与Control 组相比,DSS 组的MPO 活性显著提高(P<0.0001)。与DSS 组相比,低、中、高剂量组和药物组MPO 活性均呈现显著下降趋势(P<0.0001)。其中灌胃106、107、108L.paracasei ZZ102 组的MPO 活性分别为0.224 U/mL、0.208 U/mL、0.194 U/mL,随着L.paracasei ZZ102 剂量的增加,MPO 的活性逐渐降低,因此MPO 活性变化对L.paracasei ZZ102 呈现出一定的剂量依赖性,表明灌胃L.paracasei ZZ102 可以在一定程度上显著降低小鼠的炎症水平。
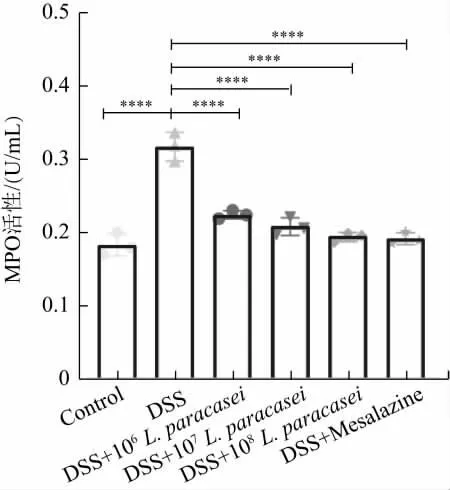
图4 MPO 活性变化
2.3 L.paracasei ZZ102 对小鼠炎症因子质量浓度的影响
2.3.1 促炎因子
在正常情况下,肠道内的促炎细胞因子和抗炎细胞因子处于一个动态平衡状态,但当肠道炎症发生时,肠道内促炎因子数量表达过多,抗炎因子表达过少,肠道内的平衡状态会被破坏[21-24]。乳酸菌可以通过调节机体免疫细胞因子的分泌来发挥其免疫作用[25]。其中促炎因子TNF-α、IL-6 和IL-1β是反应炎症程度的常规指标[26-27]。促炎因子的结果如图5(a)~5(c)所示,与Control 组相比,DSS 组小鼠的促炎因子TNFα、IL-1β和IL-6 均显著升高,表明由DSS 诱导炎症程度增加,进而诱导了多种促炎因子的分泌。与DSS组相比,灌胃低、中、高剂量L.paracasei ZZ102 以及美沙拉嗪干预的小鼠的TNF-α、IL-1β和IL-6 的含量均有不同程度的降低,表明灌胃L.paracasei ZZ102 以及药物干预均可以对结肠炎有一定的缓解作用。对于低、中、高剂量组而言,其中灌胃高剂量L.paracasei ZZ102 的效果最好,因此,促炎因子的分泌量表现出一定的剂量依赖性。
2.3.2 抗炎因子
抗炎因子IL-10 的含量变化如图5(d)所示,与Control 组比,DSS 组小鼠的IL-10 表达量轻微上升,但无统计学差异。与Control 以及DSS 组相比,灌胃106、107和108L.paracasei ZZ102 的小鼠IL-10 的分泌量均显著上调,且呈现剂量依赖性,同时美沙拉嗪组IL-10 的分泌量也呈现上升的趋势(P<0.01)。因此结果表明本研究中灌胃L.paracasei ZZ102 后可以增加抗炎细胞因子IL-10 的分泌,达到缓解小鼠的肠道炎症的作用。
3 结论
溃疡性结肠炎是一种非特异性、反复发作的慢性疾病,近几年来发病率呈逐年上升趋势[28],其发病机制受遗传、免疫、饮食、环境等多种因素影响。目前对于结肠炎的治疗主要集中在免疫抑制剂、氨基水杨酸制剂等领域[29],但这些药物价格昂贵且治疗效果不佳,需寻求天然无明显副作用的药物来治疗溃疡性结肠炎。陈岩勤等[30]研究表明微生态制剂可以降低TNF-α、IL-6、IL-17A 分泌水平,提高IL-10 含量,并有助于维持肠黏膜上皮细胞的完整,保持肠黏膜屏障功能。
本研究将筛选出的黏附能力最强的菌株L.paracasei ZZ102 应用于由DSS 诱导的结肠炎小鼠模型,通过研究表明L.paracasei ZZ102 可以有效改善小鼠的体质量减小、脾脏指数升高、MPO 活性升高等情况。通过检测结肠组织细胞因子表达水平发现,经不同剂量的L.paracasei ZZ102 灌胃后,促炎因子TNF-α、IL-1β和IL-6 的含量显著降低,抗炎因子IL-10 的含量显著升高,且与L.paracasei ZZ102 剂量呈现相关性。综上所述,益生菌制剂可有效缓解小鼠的肠道炎症,可为基于微生物法的靶向治疗IBD 提供理论参考,同时也为临床治疗肠道炎症提供依据。

