旧镇湾潮间带春秋季环境健康分析与评价
刘凤钰,周 欢,李 聪,许燕茹,饶小珍,2,林 岗,2
(1.福建师范大学生命科学学院, 福建 福州 350117; 2.福建省特色海洋生物资源可持续利用重点实验室, 福建 福州 350117;3.福建省渔业资源监测中心, 福建 福州 350003)
大型底栖动物在海洋生态系统中扮演至关重要的角色,多数生命期长、流动性差,且活动范围窄小,对环境压力极其敏感,因此,研究它们的群落变化可以很好地反映水体生态状况[1]。底栖动物是水生生态系统中连接初级生产者、分解者与捕食者(以鱼类为主)的关键环节,在水生生态系统中,底栖动物对物质循环和能量流动的作用非常重要[2],并为海洋生态监测和生态系统健康的评估提供科学依据。
大型底栖动物是易受到环境气候变化和人类活动影响的一类生物类群,对海洋环境变化的敏感性差异较大,因此可以长周期指示某一海域的生态系统健康情况[3]。潮间带处于陆海过渡带,是一个经济和渔业价值高的海洋生物的捕食场所[4]。近年来很多学者对潮间带物种多样性展开研究,如胡成业等[5]对浙江沿海沿岸岛礁区的潮间带软体动物群落结构的分析,结果表明该海域优势种在春、秋季节变化十分明显;毕耜瑶等[6]对南麂岛潮间带软体动物多样性与群落结构进行研究,结果表明该海域的软体动物在夏季受到中等强度的干扰。这些调查结果为当地生态环境的保护提供一定的参考。
旧镇湾位于福建南部沿海的漳浦县东部,处于六鳌半岛和古雷半岛北部之间,由东、西北三面环绕,是典型的淤积型海湾,半封闭性,水动力条件较差[4]。旧镇湾作为国家渔业科学观测站之一,其多年来积累了大量相关数据,为探讨旧镇湾及附近海域的生态环境变化提供了重要的基础。本研究于2020年5月(春季)及9月(秋季)采集了旧镇湾3个站位的表层沉积物,评价了表层沉积物营养盐污染状况,进一步分析了潮间带大型底栖动物群落结构、组成和分布特征,并对旧镇湾潮间带大型底栖类的物种分布格局、季节动态变化以及空间分布特征进行了探讨,为旧镇湾及福建海湾潮间带生境变化和进一步合理开发利用潮间带海洋资源提供理论基础。
1 材料与方法
1.1 站位布设
分别于2020年5月(春季)和9月(秋季),在地理坐标范围E 117°69′~117°71′、N 23°96′~24°00′的旧镇湾近岸潮间带进行生物采样和生态调查,沿海岸设置3个调查站位,分别为L1(117°71′E,24°0′N,刘坂村)、L3(117°69′E,23°98′N,白石村)、L5(117°70′E,23°96′N,北江村外)。
1.2 样品采集和分析
参照GB17378.3-2007《海洋调查规范》和GB/T12763.6-2007《海洋监测规范》[7-8],使用滩涂定量采样框采集低潮区0~5 cm内的表层沉积物,分装入清洁自封袋中。低温保存带回实验室后放置于通风处晾干、剔除杂物过筛后,对沉积物总氮(TN)和总磷(TP)分别采用半微量法和钼锑抗比色法测定,有机碳(OC)测定采用重铬酸钾氧化-分光光度法[9-10]。
根据GB17378.3-2007《海洋调查规范》和GB/T12763.6-2007《海洋监测规范》采集样品,每个断面的高、中、低潮区用不锈钢取样框各采集4个样方,每个样方面积为25 cm×25 cm,深度为30 cm,取样完毕后使用0.5 mm孔径筛网进行筛分,然后挑选样本并添加5%的中性甲醛进行固定,带回实验室处理分类、计数和称重,统计生物种名录,计算每个门类的生物量、个体数量和丰度。
1.3 评价方法
1.3.1表层沉积物营养盐污染评价指数 采用单因素污染指数、综合污染指数[9]对表层沉积物氮磷营养盐的污染程度进行分析。(1)当STN小于1.0,清洁;STN介于1.0~1.5,轻度污染;STN介于1.5~2.0,中度污染;STN大于2.0时,重度污染。(2)当STP小于0.5,清洁;STP介于0.5~1.0,轻度污染;STP介于1.0~1.5,中度污染;STP大于1.5,重度污染。(3)当F小于1.0,清洁;F介于1.0~1.5,轻度污染;F介于1.5~2.0,中度污染;F大于2.0时,重度污染。计算公式为:
Si=Ci/Cs
(1)
(2)
式中:Si表示污染物的污染指数;Ci为沉积物的实测数值;Cs为污染物的评价标准;STN=1000 mg·kg-1,STP=420 mg·kg-1。F为STN和STP的平均值。Fmax为STN和STP的最大值。
1.3.2有机污染评价指数 采用有机污染指数[10]评价海域沉积物的有机环境质量。当OI<0.05时,清洁;OI介于0.05~0.2时,轻度污染;OI介于0.2~0.5时,中度污染;OI≥0.5时,重度污染。计算公式为:
ON=TN×0.95
(3)
OI=OC×ON
(4)
式中:ON为有机氮(%),其值以总氮(TN)质量分数的95%计算;OI为有机指数(%);OC为有机碳(%)。
1.3.3Pinkas相对重要性指数 采用Pinkas相对重要性指数(Index of relative importance,IRI)[11]来确定大型底栖动物群落的优势种,这一指数可以综合考虑大型底栖动物丰度和生物量,并反映各个物种的分布状况,计算公式为:
IRI=(W+N)×F
(5)
W是各个物种生物量在生物总量中的比例;N为各个物种丰度在总丰度中的比例;F为该种出现的频率。根据程济生[12]的分类方法,将IRI>1000的种视为优势种;IRI值在100~1000的种归为重要种;IRI在10~100的种为常见种;IRI<10的种归为少见种。
1.3.4大型底栖动物群落结构多样性指数 采用Shannon-Wiener多样性指数(H′)、Pielou均匀度指数(J′)和Margalef丰富度指数(d)等指标[13-15]来评估大型底栖动物群落结构的多样性。计算公式如下:
物种多样性Shannon-Weaver指数:
(6)
物种丰富度(Margalef′ s species richness):
d=(S-1)/lnN
(7)
均匀度指数(Pielou′ s evenness):
l=H′/lnS
(8)
式中:S为样品中的种类数目;N为样品中的个体总数;Pi为样品中第i种的个体数占总个体数量的比例。
1.3.5大型底栖动物污染指数 采用大型底栖动物污染指数(Macrobenthos pollution index,MPI)对大型底栖生物群落的污染状况进行分析[16]。当MPI大于4时,严重污染;MPI介于0~4时,中度污染;MPI介于-6~0时,轻度污染;MPI小于-6时,清洁。计算公式为:
MPI=10(2+k)[∑(Ai-Bi)]/S1+k
(9)
K=│∑(Ai-Bi)│/∑(Ai-Bi)
式中:Ai为丰度累积百分比优势度;Bi为生物量累积百分比优势度;S为单位面积内生物种数量;当∑(Ai-Bi)为正值时,K=1,当∑(Ai-Bi)为负值时,K=-1。
2 结果与分析
2.1 旧镇湾潮间带春秋季环境理化指标
由表1可知,春季沉积物总氮污染指数(STN)处于0.46~1.12,均值为0.77;秋季STN在0.58~0.89,均值为0.72;3个站位均为清洁状态。春季沉积物总磷污染指数(STP)处于0.65~1.37,秋季STP在0.74~1.27,春季和秋季3个站位多为轻度污染状态。春季氮磷综合污染指数(F值)变化范围为0.78~1.14;秋季F值范围在0.84~1.08,L5站位轻度污染,L1、L3站位为清洁状态,可以看出F的评价与STN的评价结果较为一致;春季OI变化在0.18~1.11,均值为0.80,除L1站位为重度污染,其他站位处于轻度至污染状态;秋季OI变化在0.26~0.61,均值为0.74,除L5站位为重度污染,其他站位处于中度污染状态。根据春季和秋季STN和OI指数的均值可以看出秋季的环境状态好于春季。根据各项评价指数,L3站位在春季和秋季的环境状况最佳,L5站位次之,L1站位环境较差。

表1 春秋季潮间带低潮区表层沉积物营养盐污染评价指数
2.2 旧镇湾潮间带大型底栖动物类群的结构
由图1可知,春、秋两季3个站位共采集到大型底栖动物有6门86种。其中春季共发现5门61种大型底栖动物,包括软体动物28种,占全部种类的45.90%;环节动物20种,占全部种类的32.79%;节肢动物11种,占全部种类的18.03%;脊索动物1种;纽形动物1种。秋季大型底栖动物6门60种,其中软体动物28种,占全部种类的45.90%;环节动物18种,占全部种类的30.54%;节肢动物10种,占全部种类的16.95%;脊索动物2种;纽形动物1种;扁形动物1种。从物种数量来看,大型底栖动物的主要类群由软体动物、环节动物和节肢动物构成。在这两季中,大型底栖生物以软体动物居多,环节动物和节肢动物次之,而脊索动物、纽形动物、扁形动物3个门类数量较少。春季软体动物门的物种种类数与秋季相近。环节动物门也呈现类似的趋势。

图1 旧镇湾潮间带春秋季底栖动物种类构成
2.3 旧镇湾潮间带大型底栖动物优势种组成
由表2可知,春季相对重要性指数高于1000的物种共3种,分别是菲律宾蛤仔Ruditapesphilippinarum、纵带滩栖螺Batillariazonalis、腺带刺沙蚕Neanthesglandicincta,在L1、L3、L5站点均有分布,其中菲律宾蛤仔的相对重要性最高(相对重要性指数为5222),占总丰度和生物量的39.73%和31.47%。在秋季,菲律宾蛤仔、纵带滩栖螺和腺带刺沙蚕仍是旧镇湾潮间带的优势种。与春季相比,秋季古氏滩栖螺Batillariacumingi的比重升高,相对重要性指数由310升至1435,青蛤Cyclinasinensis和菲律宾蛤仔的比重下降。总的来说,春秋季节旧镇湾潮间带的大型底栖动物优势种存在差异。

表2 大型底栖动物春、秋季的相对重要性指数
2.4 旧镇湾潮间带大型底栖动物的生物量分布
由图2可知,春季各站位生物量的动态变化幅度较大,在91.23~452.54 g·m-2,平均为288.87 g·m-2。L1站位生物量最小,为91.23 g·m-2,各类群的生物量组成以软体动物门最高,为67.32 g·m-2,环节动物门最低,为5.05 g·m-2;L5站位的生物量最高,达452.54 g·m-2,L5站位各类群生物量组成也以软体动物门最高,为439.61 g·m-2,环节动物门最低,为4.01 g·m-2;春季生物量最高站位是最低站位的4.96倍。秋季各站位生物量的动态变化幅度为91.97~466.81 g·m-2,平均为291.03 g·m-2。L1站位生物量最小,为91.97 g·m-2,各类群的生物量组成以软体动物门最高,为74.57 g·m-2,环节动物门最低,为4.97 g·m-2;L3站的生物量最高,达466.81 g·m-2,L3站位各类群组成也以软体动物门最高,为448.82 g·m-2,环节动物门最低,为2.28 g·m-2。
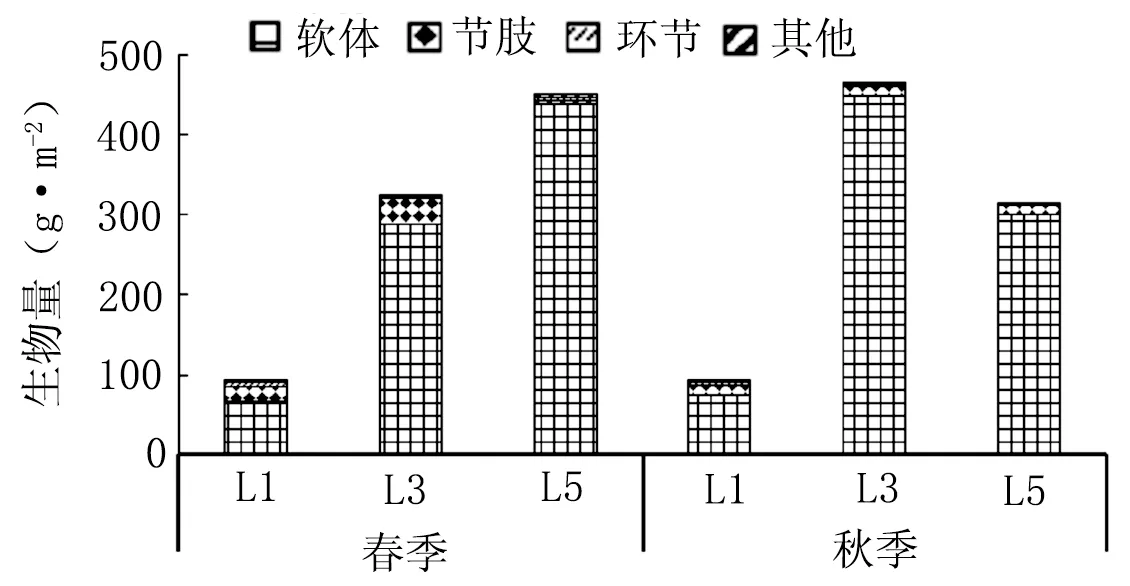
图2 春秋季节旧镇湾大型底栖动物生物量分布
从时间分布上看,春季和秋季两个季节生物量分布都不均匀。从空间分布上看,各站位之间的生物量存在一定差距。春季生物量呈现湾口站位L5相对较高,湾底L1站位较低的特点,秋季生物量呈现中部站位L3相对较高,湾底L1站位较低的特点。
2.5 旧镇湾潮间带大型底栖动物的丰度分布
由图3可知,春季大型底栖动物在各站位丰度的动态变化幅度较大,在534.4~1461.6 ind·m-2,平均为938.13 ind·m-2。L1站位丰度最小,为534.4 ind·m-2,各类群的丰度组成以环节动物门最高,为405.6 ind·m-2,节肢动物门最低,为17.6 ind·m-2;L3站的丰度最高,达1461.6 ind·m-2,各类群的丰度组成也以软体动物门最高,为1364 ind·m-2,节肢动物门最低,为32 ind·m-2;春季丰度最高站位是最低站位的2.74倍。

图3 春秋季节旧镇湾海域大型底栖动物丰度分布
秋季大型底栖动物在各站位丰度的动态变化幅度为598.4~1068 ind·m-2,平均为798.93 ind·m-2。L1站位丰度最小,为598.4 ind·m-2,各类群的丰度组成以环节动物门最高,为401.6 ind·m-2,节肢动物门最低,为22.4 ind·m-2;L3站位的丰度最高,达1068 ind·m-2,各类群组成以软体动物门最高,为846.4 ind·m-2,节肢动物门最低,为23.2 ind·m-2。由丰度分布可以看出旧镇湾的大型底栖动物丰度较高、分布不均,春季底栖动物丰度高于秋季。除L1站位,两季均以软体动物门占优势。
2.6 大型底栖动物群落结构多样性指数的季节变化
由图4可知,春季J值在0.46~0.53,均值0.50;秋季各站位J值在0.58~0.62,均值0.60。春季d值在2.24~3.80,均值2.97,秋季各站位d值在2.99~3.56,均值3.33。春季H′值在2.07~2.82,均值2.49,表明春季处于中度污染状态;秋季比春季略高,各站位H′值在2.99~3.12,均值3.04,表明秋季处于轻度污染状态。
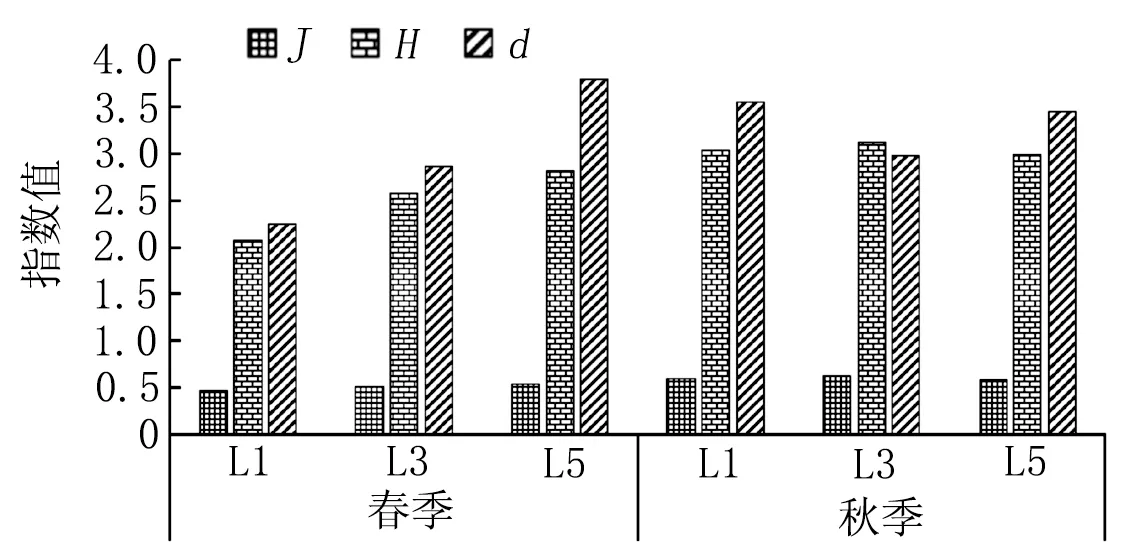
图4 旧镇湾潮间带多样性指数的季节变化
2.7 旧镇湾潮间带大型底栖动物群落污染指数
由图5可知,春季大型底栖动物MPI指数为0.35,其中L1站位的MPI指数最高,为0.85,在3个站位中受扰动的程度最大。L3站位和L5站位受扰动程度较小,且L5的MPI值小于L3,受污染程度相对较轻。整体上看,春季3个站位都属于中度污染的状态。秋季的大型底栖动物MPI指数为-0.36,其中L3站位和L5的MPI值分别为-0.10和-1.06,受扰动程度较小,属于轻度污染的状态,且L5站位的MPI值低于L3站位,受污染程度比L3站位小。秋季3个站位的MPI值均小于春季,总体看秋季受到污染的程度状况要小于春季,L5站位在春季和秋季受污染小于L3 站位和L1站位。
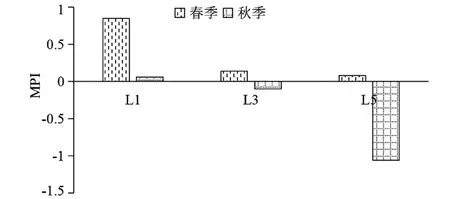
图5 春秋季旧镇湾潮间带的大型底栖动物污染指数MPI值
2.8 旧镇湾潮间带大型底栖动物优势种的历史变化
由表3可知,旧镇湾潮间带2020年春季与秋季的大型底栖动物群落结构,与前人2001年和2010年的研究结果比较分析,发现旧镇湾潮间带的大型底栖动物主要种发生了显著变化,多毛类物种逐渐成为重要种,且其丰度、生物量和多样性指数呈明显增加趋势。本研究中的L3站位在白石村滩涂,与2001年和2010年的调查站位相近。在2001年至2020年期间,旧镇湾近岸潮间带采集到的大型底栖动物种数略有下降,但各生物类群在总数上的比例基本保持稳定(表3),其中,软体动物、环节动物和节肢动物构成了大型底栖生物的主要类群。随着时间的推移,旧镇湾潮间带的主要种发生了更替现象,甲壳类物种逐渐被个体较小的多毛类和双壳类物种所取代。大型底栖动物的丰度和生物量发生较大变化,具体数据见表3,2020年的丰度是2010年的6.40倍,2001年的3.05倍;2020年的生物量是2010年的6.90倍,2001年的17.91倍。

表3 不同调查时间旧镇湾白石村附近底栖动物群落指标比较
3 讨论与结论
沉积物中的总氮(TN)和总磷(TP)含量可以用来评估水体中的营养状况和污染程度[17]。通过监测大型底栖动物,可以了解它们长期接触污染物所产生的慢性毒性效应[18]。而MPI指数作为一个综合指标,综合考虑了底栖动物的种类组成、丰度和生物量等因素,提供了更全面的水体质量和污染状况评估。因此,MPI指数相较于仅依赖沉积物环境理化指标,更能揭示水体的生态健康状况。在时间分布上,旧镇湾表层沉积物的环境理化指标和MPI指数均表明秋季的环境健康好于春季,可能是春季调查期间正值梅雨季节,降雨量增加冲刷地表,引起河流径流量增加,导致营养盐含量也相应增高[19]。在空间分布上,沉积物理化指标和MPI指数均表现为L1站位环境健康较差。旧镇湾是半封闭型的港湾,水动力条件较弱,L1是湾底站位,因此受污染程度较L5、L3站位严重;沉积物环境理化指标表明L3优于L5站位,但根据MPI指数显示L5受污染状况好于L3站位,可能是L3、L5站位均是菲律宾蛤仔养殖区,养殖户在放苗前期对底泥进行翻耕,有利于污染物的扩散,减轻污染程度。此外,L5站位靠近湾口水流速度相对较高,受海流影响较大,更有利于污染物的扩散、稀释和底栖动物的生长。
多样性指数可以用来评估海洋环境污染的状况。一般而言,Shannon-Wiener多样性指数越高,表示底层生态环境条件越好。当H′值<1时,表示重污染;1
旧镇湾自1958年起不断进行围填海工程,持续占用围垦区和滩涂用地,其中大部分用于经济贝类养殖,湾内海水养殖面积相对较大。2001年、2010年和2020年生物量相应增加,从26.07 g·m-2升高至466.81 g·m-2,均以软体动物占绝对优势且生物量随着年份逐渐增加,这与当地贝类的人工养殖有密切关系。物种多样性指数从2010年的2.85升至2020年的3.12,表明环境处于较好的状态,这可能是因为近年来进行了一系列工作,如入海排污口溯源整治和入海河流治理。这些措施改善了当地海域的水生态环境。此外,2020年在潮间带滩涂修建了贝类养殖区,主要进行滤食性贝类的养殖,包括菲律宾蛤仔和牡蛎等品种。这些养殖品种通常无须额外投饵,在其摄食过程中可有效过滤水体中微小的悬浮颗粒物质,从而改善水质的透明度,并帮助降低水中氮、磷和有机质含量,对环境起到积极的影响[23]。
综上所述,通过对旧镇湾潮间带海域3个站位的调查,共鉴定到86种大型底栖动物,春季优势种为菲律宾蛤仔、纵带滩栖螺、腺带刺沙蚕、青蛤、凸壳肌蛤、薄满月蛤;秋季优势种为纵带滩栖螺、腺带刺沙蚕、古氏滩栖螺、菲律宾蛤仔、习见圆蛤、珠带拟蟹守螺。春、秋两季大型底栖动物丰度分别为938.13、798.93 ind·m-2;平均生物量分别为288.87、291.03 g·m-2。春秋两季的物种多样性指数位于一个较高水平。综合表层沉积物污染指数、Shannon-Weaver多样性指数H′和MPI分析,认为研究海域秋季受污染扰动较春季小,环境健康状况好于春季。与2001年、2010年的调查资料进行对比,调查区域大型底栖动物的丰度、生物量和物种多样性指数等都有明显的增加。
参考论文:
[1]SHIYUN C,GONG Y,WANG H,et al.A pilot macroinvertebrate-based multimetric index(MMI-CS)for assessing the ecological status of the Chishui River Basin,China[J].EcologicalIndicators,2017,83:84-95.
[2]NTISLIDOU C,LAZARIDOU M,TSIAOUSSI V,et al.A new multimetric macroinvertebrate index for the ecological assessment of Mediterranean lakes[J].EcologicalIndicators,2018,93:1020-1033.
[3]田胜艳,张文亮,张锐.大型底栖动物在海洋生态系统中的作用[J].盐业与化工,2009,38(2):50-54.
[4]刘修德.福建省海洋数模与环境研究——旧镇湾[M].北京:海洋出版社,2010:7-15.
[5]胡成业,徐衡,邹莉,等.浙江沿岸岛礁区潮间带软体动物群落结构研究[J].水产学报,2015,39(8):1144-1154.
[6]毕耜瑶,蔡厚才,陈万东,等.南麂岛岩礁潮间带软体动物种类数量变化及其演替[J].渔业现代化,2016,43(3):65-73.
[7]国家标准化管理委员会.海洋监测规范第3部分(样品采集、贮存与运输):GB 17378.3-2007[S].北京:中国标准出版社,2008:11-13.
[8]中国国家标准化管理委员会.海洋调查规范第6部分(海洋生物调查):GB/T 12763.6-2007[S].北京:中国标准出版社,2008:48-52.
[9]陈姗,许凡,谢三桃,等.合肥市十八联圩湿地表层沉积物营养盐与重金属分布及污染评价[J].环境科学,2019,40(11):4932-4943.
[10]包宇飞,胡明明,王殿常,等.黄柏河梯级水库沉积物营养盐与重金属分布特征及污染评价[J].生态环境学报,2021,30(5):1005-1016.
[11]韩洁,张志南,于子山.渤海中、南部大型底栖动物的群落结构[J].生态学报,2004(3):531-537.
[12]程济生.黄海无脊椎动物资源结构及多样性[J].中国水产科学,2005(1):68-75.
[13]刘旭东,汪进生,孙立娥,等.渤海山东近岸海域大型底栖动物的群落结构及多样性分析[J].海洋环境科学,2021,40(6):929-936,946.
[14]林俊辉,王建军,林和山,等.福建古雷半岛周边海域春季大型底栖生物多样性现状[J].渔业科学进展,2015,36(2):23-29.
[15]牟剑锋,黄雅琴,何雪宝,等.泉州湾北岸潮间带大型底栖生物群落研究[J].应用海洋学学报,2017,36(2):158-166.
[16]蔡立哲.大型底栖动物污染指数(MPI)[J].环境科学学报,2003,23(5):625-629.
[17]李荣冠.福建滨海湿地潮间带大型底栖生物[M].北京:科学出版社,2017:287-295.
[18]黄廷林,刘飞,史建超.水源水库沉积物中营养元素分布特征与污染评价[J].环境科学,2016(1):166-172.
[19]李利强,王丑明,张屹,等.洞庭湖大型底栖动物与表层沉积物重金属研究[J].生态环境学报,2016,25(2):286-291.
[20]MINOR C E,SIMJOUW J,MULHOLLAND R M.Seasonal variations in dissolved organic carbon concentrations and characteristics in a shallow coastal bay[J].MarineChemistry,2006,101(3-4):166-179.
[21]孔繁翔.环境生物学[M].北京:高等教育出版社,2000:157-163.
[22]黄博强.陆海统筹视角下福建省海岸带土地利用变化过程与环境效应研究[D].厦门:厦门大学,2019.
[23]郑惠东.东山湾水产养殖承载力指标体系的构建与评价[J].渔业研究,2019,41(5):393-398.

