新德里番茄曲叶病毒西瓜分离物的全基因组序列测定及分析
程雨欣,胡红霞,梁燕青,钱亚娟
(浙江大学农业与生物技术学院生物技术研究所,浙江 杭州 310058)
双生病毒是一类具有孪生颗粒形态的植物单链环状DNA病毒[1],根据基因组结构、寄主和传毒介体等,双生病毒科被划分为14 个属,其中最具经济重要性的属为菜豆金色花叶病毒属(Begomovirus),该属病毒由烟粉虱传播,因此也被称为粉虱传双生病毒[2]。双生病毒寄主范围非常广泛,包括单子叶植物和双子叶植物。在我国,番茄、烟草等茄科植物是双生病毒主要的自然寄主[3]。我国已报道的双生病毒主要属于菜豆金色花叶病毒属,该属病毒根据基因组的不同分为单组分双生病毒和双组分双生病毒。单组分双生病毒只含有1个DNA-A组分,而双组分双生病毒则含有DNA-A 和DNA-B 2 个组分。DNA-A至少编码5个蛋白,在病毒链上编码外壳蛋白(coat protein, CP),在互补链上编码4 个蛋白,即AC1(复制相关蛋白)、AC2(转录激活蛋白)、AC3(复制增强子蛋白)和AC4(症状决定因子蛋白)[4]。DNA-B 编码的核穿梭蛋白(nuclear shuttle protein, NSP)和运动蛋白(movement protein, MP)与病毒在植物体内的转移及寄主范围有关;另外,在缺乏DNA-A的情况下,DNA-B不能复制[5]。DNA-A和DNA-B基因组上均含有共同区(common region,CR),该区域含有病毒复制和转录所必需的结构域及保守的9碱基茎环序列(TAATATT/AC)。
双生病毒是植物病毒中种类较多的一类病毒,在世界范围内广泛发生,对各国农业生产与经济发展造成了毁灭性损失[6-7]。新德里番茄曲叶病毒(tomato leaf curl New Delhi virus, ToLCNDV)隶属双生病毒科菜豆金色花叶病毒属,是一种双组分双生病毒,其侵染寄主后引起严重的叶片卷曲、幼叶叶脉肿胀、节间缩短、果实缩小及果皮粗糙等症状[8-10]。该病毒是东南亚、东亚、中东和地中海地区葫芦科和茄科作物主要的病毒病害之一,其大面积暴发极大降低了当地农产品的商业价值[11]。
ToLCNDV 最早于1995 年在印度番茄上被发现,之后快速蔓延至各相邻国家[12]。2012 年,在西班牙发现了ToLCNDV[13],随后几年该病毒病害在地中海地区的突尼斯和意大利等地暴发[14]。ToLCNDV的自然寄主主要为番茄,同时,该病毒还会感染葫芦科、大戟科、茄科、锦葵科、豆科等43 种其他植物[12]。我国最早于2010 年在台湾省东方甜瓜上报道了ToLCNDV[15];2022年9月在浙江省番茄上鉴定到ToLCNDV[16];2023 年,ZENG 等报道在上海地区的黄瓜、丝瓜和甜瓜上发现了ToLCNDV[17],GU等报道在上海、浙江和江苏地区的南瓜、丝瓜和甜瓜上发现了ToLCNDV[18]。
本研究通过小RNA 高通量测序和传统第一代DNA测序,在上海地区西瓜样本上首次分离到2个ToLCNDV 分离物,测序获得了这2 个分离物的DNA-A 和DNA-B 全基因组序列;在此基础上,比较了它们与国内已报道的其他ToLCNDV分离物的亲缘关系,分析了这2 个分离物的全基因组核苷酸变异情况。
1 材料与方法
1.1 植物材料
样品SH-WM1和SH-WM2于2022年9月采集于上海感病西瓜病叶上,病叶呈现叶片上卷与黄化等疑似病毒病症状。
1.2 小RNA 深度测序和数据处理
利用Trizol 试剂(日本TaKaRa 公司)从样品SH-WM1与SH-WM2的叶组织中提取总RNA,用NanoDrop 超微量紫外分光光度计(上海创赛科技有限公司)测定RNA 浓度,评估其是否满足建库质量要求。称取10 µg RNA,构建小RNA(small RNA,sRNA)文库,并委托华大科技公司通过Hiseq2500平台进行sRNA 测序。对原始数据过滤后得到高质量读长序列(clean reads),使用Velvet 软件收集18~28 nt sRNA 序列并拼接成重叠群(contigs),以17个核苷酸为最小重叠长度(k-mer)。利用BLASTn(https://blast.ncbi.nlm.nih.gov/)比对拼接序列与NCBI数据库(https://www.ncbi.nlm.nih.gov/)中病毒序列的同源关系。
1.3 全长基因组序列扩增
利用TempliPhi 100环状扩增试剂盒(上海优宁维生物科技股份有限公司)从SH-WM1和SH-WM2叶组织中富集环状DNA:在1 μL 环状DNA 样品中加入样品缓冲液5 μL,混匀后于95 ℃条件下加热3 min,在冰上冷却10 min 后依次加入0.2 μL 酶混合液和5 μL 反应缓冲液,在30 ℃条件下反应18 h,然后在65 ℃条件下反应10 min。以富集后的产物为模板,采用Phanta 高保真酶(南京诺唯赞生物科技股份有限公司),通过背靠背引物(表1)扩增DNA-A和DNA-B全长序列。

表1 引物序列信息Table 1 Information of primer sequences
1.4 pLB 平末端连接
利用pLB零背景快速克隆试剂盒[天根生化科技(北京)有限公司]进行聚合酶链反应(polymerase chain reaction, PCR)产物(SH-WM1与SH-WM2 基因组)克隆。反应体系(5 μL):目的片段1.5 μL,pLB 载体0.5 μL,T4 连接酶0.5 μL,2×反应缓冲液2.5 μL。将各试剂振荡混匀并离心至PCR 管底部,在22 ℃条件下反应10 min。
1.5 应用斑点酶联免疫吸附试验(dot-enzyme linked immunosorbent assay, Dot-ELISA)检测病毒
将经液氮速冻后的病叶研磨成均匀的粉末,按质量体积比1∶30 加入0.01 mol/L 磷酸盐缓冲液(phosphate buffered saline, PBS),以8 000 r/min 离心3 min 后,吸取上清液2 μL 并点到硝酸纤维素膜上,在室温下干燥后,用0.5%脱脂奶粉封闭0.5 h,然后加入番茄黄化曲叶病毒外壳蛋白抗体(1∶5 000稀释,由本实验室制备),在室温下孵育1 h;用磷酸盐吐温缓冲液(phosphate buffered saline with Tween-20,PBST)将膜洗涤4次后,用1∶8 000稀释的碱性磷酸酶标记的羊抗鼠IgG(美国Sigma 公司)孵育1 h;再用PBST洗涤4次后,将膜浸到碱性磷酸酶试剂中显色,最后应用Dot-ELISA法进行检测。若点样处出现紫色斑点,则为阳性样本;若未出现紫色斑点,则为阴性样本。
1.6 系统进化分析
利用SDT v1.2软件进行多序列比对,然后利用MEGA 11.0软件,采用最大似然法(maximum likelihood, ML)构建进化系统树,并应用自展法(bootstrap)通过1 000次重复进行评估。用于系统发育分析的序列从NCBI数据库中下载。将来自苘麻花叶病毒(abutilon mosaic Bolivia virus, AbMBoV)的序列作为外群。
1.7 多样性和变异分析
使用DNA序列多态性分析软件DnaSP v6分析核苷酸多样性,设置窗口长度为100 bp,步长为25 bp。用总核苷酸多样性指数(π)评估整个基因组中单个核苷酸的变异率。使用MEGA 11.0软件,采用最大似然法估算ToLCNDV全基因组的碱基替换与颠换比,分析ToLCNDV编码的不同可读框(open reading frames, ORFs)上同义突变和非同义突变的发生情况。
2 结果与分析
2.1 sRNA 深度测序
于上海田间采集叶片上卷与黄化的西瓜病叶(图1),对样品SH-WM1与SH-WM2进行sRNA高通量测序,共获得26 400 000条高质量读长序列,其中包括25 204 276 条长度为18~28 nt 的序列。将拼接后的序列在NCBI 数据库中进行BLASTn 搜索,结果显示,有2 条拼接片段比对到ToLCNDV DNA-A上,与已报道的ToLCNDV分离物的核苷酸序列相似度为92%~98%,1 条拼接片段比对到ToLCNDV DNA-B 上,与已报道的ToLCNDV 分离物的核苷酸序列相似度为96%~100%。

图1 西瓜病叶样品在田间的典型症状Fig.1 Typical symptoms of watermelon diseased leaf samples in the field
2.2 西瓜田间样品的ToLCNDV 鉴定
提取样品SH-WM1 与SH-WM2 的总DNA 并通过滚环复制(rolling circle replication, RCR)进行富集,利用背靠背引物从样品中扩增出2条3 000 bp左右的片段(图2A),测序后证实,从样品SH-WM1与SH-WM2 中扩增出的DNA-A 核苷酸全长均为2 739 bp,DNA-B 核苷酸全长均为2 693 bp。进一步利用番茄黄化曲叶病毒外壳蛋白抗体进行Dot-ELISA检测,结果显示,样品SH-WM1与SH-WM2均能与抗体进行特异性反应(图2B)。

图2 利用PCR(A)和Dot-ELISA(B)鉴定感染ToLCNDV的西瓜病叶样品Fig.2 Identification of watermelon diseased leaf samples infected by ToLCNDV using PCR (A) and Dot-ELISA (B)
2.3 ToLCNDV 西瓜分离物的基因组结构分析
进一步利用SnapGene 软件对从样品SH-WM1与SH-WM2中扩增出的DNA-A和DNA-B序列进行ORFs 预测,结果发现,DNA-A 组分病毒链编码AC1(1 086 nt)、AC2(420 nt)、AC3(411 nt)、AC4(177 nt)、AC5(486 nt)蛋白,其互补链编码AV1(771 nt)、AV2(387 nt)蛋白(图3A),DNA-B组分编码BC1(846 nt)、BV1(807 nt)蛋白(图3B)。在DNA-A 和DNA-B 基因组上均有一个9 碱基的TAATATT/AC茎环结构。

图3 ToLCNDV SH-WM的基因组结构Fig.3 Genomic structures of ToLCNDV SH-WM
在NCBI 数据库中进行BLASTn 比对,发现从样品SH-WM1 与SH-WM2 中扩增到的DNA-A 序列与已报道的ToLCNDV 中国分离物的核苷酸序列相似度≥99.16%,扩增到的DNA-B 序列与已报道的ToLCNDV 中国分离物的核苷酸序列相似度≥98.99%。根据菜豆金色花叶病毒属双生病毒种的命名规则,认为这2个病毒为ToLCNDV的不同分离物,将其分别命名为新德里番茄曲叶病毒分离物SH-WM1(tomato leaf curl New Delhi virus isolate SH-WM1,简称“ToLCNDV SH-WM1”),其DNA-A的GenBank登录号为OQ957165,DNA-B的GenBank登录号为OQ957167,以及新德里番茄曲叶病毒分离物SH-WM2(tomato leaf curl New Delhi virus isolate SH-WM2,简称“ToLCNDV SH-WM2”),其DNA-A的GenBank登录号为OQ957166,DNA-B 的GenBank登录号为OQ957168。
2.4 ToLCNDV 西瓜分离物的系统进化分析
为揭示ToLCNDV SH-WM 分离物与已报道的ToLCNDV 各分离物的进化关系,利用MEGA 11.0软件构建不同ToLCNDV分离物DNA-A与DNA-B全核苷酸的进化系统树,并将苘麻花叶病毒序列作为外群。结果(图4)表明,ToLCNDV SH-WM1 和ToLCNDV SH-WM2的DNA-A组分与14个中国分离物的DNA-A聚类在一起,且与ToLCNDV浙江分离物(GenBank登录号:OP356207)、ToLCNDV分离物0823-2(GenBank登录号:OQ190940)、ToLCNDV分离物8066(GenBank 登录号:OQ190946)等聚在一个亚组,亲缘关系更近。ToLCNDV SH-WM1 和ToLCNDV SH-WM2的DNA-B组分与ToLCNDV浙江分离物(GenBank 登录号:OP356208)的亲缘关系最近,且与14个中国分离物的DNA-B聚类在一起,而与ToLCNDV国外分离物的亲缘关系相对较远。

图4 ToLCNDV分离物DNA-A(A)与DNA-B(B)的进化系统树Fig.4 Phylogenetic trees of DNA-A (A) and DNA-B (B) of ToLCNDV isolates
2.5 ToLCNDV 西瓜分离物与国内ToLCNDV 分离物的序列相似性分析
为进一步明确ToLCNDV西瓜分离物与国内其他ToLCNDV 分离物的进化关系,我们比较了ToLCNDV SH-WM1 与ToLCNDV SH-WM2 及其他14个国内已报道的ToLCNDV分离物的核苷酸序列差异。结果(表2)显示,ToLCNDV SH-WM1 与ToLCNDV SH-WM2 全基因组核苷酸序列最为接近,与国内其他ToLCNDV分离物的DNA-A全核苷酸序列相似度为99.16%~99.67%,DNA-B 全核苷酸序列相似度为98.99%~99.44%。

表2 ToLCNDV SH-WM1和其他ToLCNDV中国分离物的核苷酸和氨基酸序列相似性比较Table 2 Alignments of sequence similarities between ToLCNDV SH-WM1 and other ToLCNDV isolates from China
进一步比对ToLCNDV西瓜分离物与国内其他ToLCNDV 分离物编码的ORFs 氨基酸序列,结果(表2)显示:ToLCNDV SH-WM1与ToLCNDV SHWM2 编码的ORFs 氨基酸序列大部分最为接近;与国内其他ToLCNDV 分离物的AC1 序列相似度为99.17%~99.44%,AC2 序列相似度为99.11%~99.41%,AC3 序列相似度为99.51%~99.75%,AC4序列相似度为100.00%,AC5序列相似度为99.59%~100.00%,AV1序列相似度为99.61%~99.87%,AV2序列相似度为99.12%~99.41%;与国内其他ToLCNDV分离物的BC1序列相似度为98.93%,BV1序列相似度为99.38%~99.87%。
与上述结果相似,利用热图对ToLCNDV SHWM1、ToLCNDV SH-WM2 与国内其他ToLCNDV分离物的全基因组核苷酸序列进行分析比较发现,不同ToLCNDV 中国分离物的DNA-A 与DNA-B序列高度相似(图5)。

图5 ToLCNDV西瓜分离物和其他ToLCNDV中国分离物的DNA-A(A)和DNA-B(B)全基因组核苷酸序列相似性比较Fig.5 Comparisons of DNA-A (A) and DNA-B (B) whole genome nucleotide sequence similarities between ToLCNDV watermelon isolates and other ToLCNDV isolates from China
2.6 ToLCNDV 中国分离物的基因组变异分析
为准确评估ToLCNDV中国分离物的遗传多样性,将ToLCNDV SH-WM1 设置为主序列,利用DnaSP v6 计算基因组中所有位点的总核苷酸多样性指数(π)。结果表明,16 个ToLCNDV 中国分离物的DNA-A 与DNA-B 在核苷酸水平的整体变异率低于3%,其中,DNA-A 的平均π值为0.005 11,DNA-B 的平均π值为0.006 32。ToLCNDV 中国分离物在基因组上的变异情况存在较明显的波动,在基因组DNA-A上变异最高的峰值位于AC1编码区域(图6A),而在基因组DNA-B 上变异最高的峰值位于BC1(MP)编码区域(图6B)。
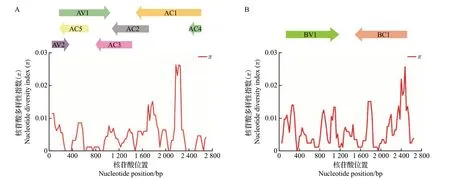
图6 ToLCNDV中国分离物DNA-A(A)和DNA-B(B)的种群变异水平Fig.6 Population variation levels of DNA-A (A) and DNA-B (B) of ToLCNDV isolates from China
2.7 ToLCNDV 中国分离物的ORFs 变异分析
采用最大似然法分析ToLCNDV中国分离物基因组上变异位点的转换比。结果显示:DNA-A 上G↔A(24.74%)与C↔T(23.40%)的转换比高于A↔T(14.65%)、G↔T(13.22%)、A↔C(12.71%)和C↔G(11.28%)的转换比(图7A),表明基因组DNA-A 中G↔A和C↔T的单核苷酸变异水平较高;在DNA-B上的转换趋势相同,G ↔A(19.05%)与C ↔T(24.81%)的转换比高于A ↔T(14.68%)、G ↔T(13.76%)、A↔C(14.31%)和C↔G(11.39%)的转换比(图7B)。
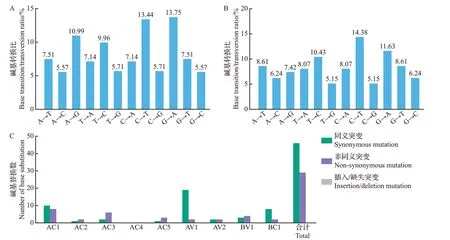
图7 ToLCNDV中国分离物的基因组变异情况分析Fig.7 Analysis of genomic variation in ToLCNDV isolates from China
统计ToLCNDV 中国分离物基因组上变异位点处的同义突变和非同义突变数,结果(图7C)显示:DNA-A 的AC1、AC2、AC3、AC4、AC5、AV1、AV2 的同义突变数分别为10、1、2、0、1、19、2 个,非同义突变数分别为8、2、6、0、3、2、2 个;DNA-B 的BV1、BC1的同义突变数为3、8个,非同义突变数为4、2个;在所有9个ORFs中都没有碱基位点的插入或缺失。这些结果表明,同义突变主要发生在基因组DNA-A的AC1、AV1中,非同义突变主要发生在基因组DNA-A 的AC1、AC3 中,而DNA-A 编码的AC4在遗传上最为稳定。
3 讨论
小RNA(sRNA)主要包括微RNA(microRNA,miRNA)、Piwi 相互作用RNA(Piwi-interacting RNA,piRNA)、干扰小RNA(small interfering RNA, siRNA)等。随着第二代测序技术的发展,sRNA 深度测序技术因具有快速灵敏的特点而被广泛应用于病毒的诊断与鉴定[19]。利用该项技术,王致远等[20]首次发现了侵染黄槿的杆状DNA病毒,赵志惠等[21]对甜樱桃上的病毒种类进行了鉴定,LI 等[22]在国内首次报道了感染葫芦科植物的西瓜绿斑驳花叶病毒(watermelon green mottle mosaic virus, WGMMV)。本研究通过sRNA 高通量测序及序列分析,在上海感病西瓜叶片上发现了ToLCNDV 的同源序列,进一步通过RCR、PCR及Dot-ELISA法在感病西瓜叶片上鉴定到2个ToLCNDV分离物。
ToLCNDV 最早在印度番茄上被报道,现在已成为影响东南亚、东亚、中东和地中海盆地葫芦科和茄科作物最主要和最具经济意义的病毒之一。ToLCNDV 的自然寄主包括番茄、马铃薯、辣椒、甜瓜、南瓜、丝瓜、黄瓜等[12,23]。在中国,ToLCNDV 分离物已在甜瓜、番茄、南瓜和丝瓜上被发现[16-18],但在西瓜寄主上的报道还是空白。在世界各地,西瓜能被10多种病毒(包括RNA和DNA病毒)感染,是全球西瓜生产中主要的制约因素之一[24]。2020 年,在国外西瓜样品上首次鉴定到ToLCNDV[25]。
与许多RNA病毒一样,为了适应寄主,菜豆金色花叶病毒属双生病毒表现出相对较高程度的种内遗传变异,主要由高频率的突变和重组共同驱动[26-30]。本研究在获得ToLCNDV SH-WM 分离物的全基因组序列后,通过构建进化系统树和热图分析发现,SH-WM分离物与已报道的国内ToLCNDV分离物聚类在一起,亲缘关系很近。通过评估所有中国分离物的单核苷酸基因组变异发现,基因组DNA-A的平均π值为0.005 11,DNA-B 的平均π值为0.006 32。根据已有报道,番茄黄化曲叶病毒(tomato yellow leaf curl virus, TYLCV)群体变异的平均π值为0.040 49,中国番茄黄化曲叶病毒(tomato yellow leaf curl China virus, TYLCCNV)群体变异的平均π值为0.104 14[28]。与这些已报道的双生病毒群体相比,ToLCNDV中国分离物的种内变异水平较低,对由这些单核苷酸变异引起的各个ORFs所发生的同义突变、非同义突变和插入/缺失的数目进行统计发现,各个ORFs的突变类型主要为同义突变。这些结果表明,国内目前发现的ToLCNDV分离物在进化过程中较为保守。
4 结论
本研究报道了西瓜上2 个新的ToLCNDV 分离物,将其暂命名为ToLCNDV SH-WM1与ToLCNDV SH-WM2。基于所有已报道的ToLCNDV中国分离物的全长基因组序列,构建了进化系统树,进行了全基因组差异与多态性分析,结果发现,与其他双生病毒群体相比,ToLCNDV 中国分离物的种内变异水平较低。

