长链非编码RNA NEAT1、miRNA-182-5p 与2 型糖尿病合并代谢性脂肪性肝病患者肝纤维化风险的相关性研究
贺佳,李永平,魏枫*,刘美岚,吴亚玲,韶龙格
1.014010 内蒙古自治区包头市,内蒙古科技大学包头医学院第一附属医院
2.014010 内蒙古自治区包头市卫生健康委员会综合保障中心
2 型糖尿病(T2DM)是常见的慢性代谢性疾病,其发病机制复杂多样,可归结为胰岛素抵抗(insulin resistance,IR)及胰岛功能衰竭[1],两者共同影响糖尿病发展的全过程。流行病学调查研究显示,预计到2030 年全球糖尿病患病人数将达到6.43 亿(11.3%),2045 年将增至7.84 亿(12.2%)[2]。T2DM 常合并代谢相关脂肪性肝病(MAFLD),MAFLD 由非酒精性脂肪性肝病(NAFLD)更名而来,2020 年22 个国际专家小组认为MAFLD 相较于NAFLD 更加适合描述与内分泌代谢功能障碍相关的肝脏疾病[3]。约55.5%的T2DM 患者合并MAFLD,且发生肝纤维化的概率为17.0%[4],两者共存不仅增加了肝硬化和肝细胞癌的发生,同时也增加了糖尿病肾病及心脑血管系统并发症的风险,严重威胁人类健康。
T2DM 合并MAFLD 的发病机制错综复杂,近年来非编码RNA 成为这一研究热点。其中长链非编码RNA核富集转录体1(long non-coding RNA-nuclear enriched abundant transcript 1,lncRNA NEAT1)异常表达与胚胎发育、细胞增殖分化、脂肪变性、氧化应激、内质网应激等生理病理进程密切相关[5]。有研究显示,lncRNA NEAT1 可参与胰岛素的合成、分泌及敏感性的调控[6]。
微小RNA(microRNA,miRNA)也是非编码RNA的一种,其中miRNA-182-5p 目前已被证明在T2DM 及其并发症的调节途径中发挥作用,并可通过调控不同信号通路来调节IR[7]。目前lncRNA NEAT1 与miRNA-182-5p 在T2DM 合并MAFLD 的研究中较少,本研究通过比较不同患者外周血中lncRNA NEAT1、miRNA-182-5p 的表达情况,分析其与肝纤维化的相关性,为临床早期诊断及防治疾病提供新的方向。
1 对象与方法
1.1 研究对象
纳入2021 年10 月—2022 年6 月在内蒙古科技大学包头医学院第一附属医院内分泌科就诊并入组国家标准化代谢性疾病管理中心(MMC)的T2DM 患者236例为研究对象,同时纳入在内蒙古科技大学包头医学院第一附属医院体检的49 名健康志愿者为健康对照组。纳入标准:(1)T2DM 诊断符合《中国2 型糖尿病防治指南(2020 年版)》[8-9];(2)MAFLD 诊断符合《代谢功能障碍相关脂肪肝的新定义:国际专家共识声明》[3];(3)年龄18~80 周岁。排除标准:(1)其他类型糖尿病及糖尿病急性并发症患者;(2)感染性疾病、免疫性疾病及肿瘤患者;(3)严重肝、肾功能不全患者;(4)近期服用影响肝功能药物的患者。本研究已通过内蒙古科技大学包头医学院第一附属医院医学伦理委员会审批(审批号:2023011),入组患者均签署知情同意书。
1.2 研究方法
1.2.1 一般资料收集:记录研究对象的年龄、性别、T2DM 病程,吸烟史(定义为吸烟≥1 支/d,连续吸烟>1 年[10])、饮酒史[定义为平均饮白酒(酒精含量>50%)≥100 mL/d,持续1 年以上[10]]等指标。测量身高、体质量、颈围(NC)、腰围(WC),计算BMI。
1.2.2 实验室指标检测:研究对象均测定血小板计数(PLT)、空腹血糖(FPG)、糖化血红蛋白(HbA1c)、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、白蛋白(Alb)、三酰甘油(TG)、总胆固醇(TC)、血尿酸(SUA)、空腹C 肽,计算改良稳态模型评估胰岛素抵抗指数(HOMA-IR),HOMA-IR=1.5+FPG(mmol/L)×空腹C 肽(pmol/L)/2 800。
1.2.3 内脏脂肪面积(VFA)、 皮下脂肪面积(SFA) 的测定: 采用生物电阻抗法( 欧姆龙DUALSCANHDS-2000)测量VFA、SFA,单位以cm2表示。
1.2.4 lncRNA NEAT1、miRNA-182-5p 的测定:采集研究对象外周血2 mL,首先用人淋巴细胞分离液提取单核细胞,后采用Trizol 法提取总RNA,采用实时荧光定量PCR(qRT-PCR)法检测lncRNA NEAT1、miRNA-182-5p 相对表达量,lncRNA NEAT1 以甘油醛-3-磷酸脱氢酶(GAPDH)作为内参,依照试剂盒(天根生化科技有限公司,货号:FP402-02)说明书进行检测,miRNA-182-5p 以U6 作为内参,依照试剂盒(诺唯赞,货号:MQ101-02)说明书进行检测。引物由生工生物工程(上海)股份有限公司合成,序列见表1。
表1 引物序列Table 1 Primer sequences
1.2.5 分组:将T2DM 患者依据《代谢功能障碍相关脂肪肝的新定义:国际专家共识声明》[3]分为T2DM 合并非MAFLD组(n=82)与T2DM合并MAFLD组(n=154)。进一步根据肝纤维化指数(FIB-4):FIB-4=(年龄×AST)/(PLT×ALT1/2)[11],将T2DM 合并MAFLD 组分为肝纤维化低危亚组(FIB-4<1.30 或年龄≥65 岁、FIB-4<2.00,n=55),肝纤维化中危亚组(1.30 ≤FIB-4 ≤2.67或年龄≥65 岁、2.00 ≤FIB-4 ≤2.67,n=69),肝纤维化高危亚组(FIB-4>2.67,n=30)。
1.3 统计学方法
采用SPSS 26.0 统计学软件进行数据分析。采用Kolmogorov-Smirnov 检验分析数据是否符合正态分布,符合正态分布的计量资料采用(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t 检验;不符合正态分布的计量资料以M(P25,P75)表示,多组间比较用Kruskal-Wallis H 检验,组间两两比较采用Mann-Whitney U 检验。计数资料以相对数表示,组间比较采用χ2检验。采用Spearman 秩相关分析探究肝纤维化高危亚组lncRNA NEAT1、miRNA-182-5p 表达水平的相关性,采用多因素有序Logistic 回归分析探究T2DM 合并MAFLD 患者肝纤维化风险的影响因素。以P<0.05 为差异有统计学意义。
2 结果
2.1 T2DM合并非MAFLD组、T2DM合并MAFLD组、健康对照组一般资料及实验室检测指标比较
3 组研究对象年龄、BMI、NC、WC、VFA、SFA、FPG、HbA1c、HOMA-IR、PLT、ALT、AST、Alb、TG、TC、SUA、lncRNA NEAT1、miRNA-182-5p 比较,差异有统计学意义(P<0.05)。组间比较结果显示,健康对照组年龄、NC、FPG、HbA1c低于T2DM 合并MAFLD 组、T2DM 合并非MAFLD 组,Alb 高于T2DM合并MAFLD 组、T2DM 合并非MAFLD 组,差异有统计学意义(P<0.05);T2DM 合并MAFLD 组BMI、WC、VFA、SFA、HOMA-IR、TG、SUA、lncRNA NEAT1 高于健康对照组、T2DM 合并非MAFLD 组,PLT 低于健康对照组、T2DM 合并非MAFLD 组,TC 低于健康对照组,差异有统计学意义(P<0.05);T2DM 合并非MAFLD 组HOMA-IR、lncRNA NEAT1 高于健康对照组,miRNA-182-5p 高于健康对照组、T2DM 合并MAFLD组,ALT、AST 低于健康对照组、T2DM 合并MAFLD组,差异有统计学意义(P<0.05)。3 组研究对象性别、T2DM 病程、吸烟史、饮酒史比例比较,差异无统计学意义(P<0.05),见表2。
2.2 肝纤维化低危亚组、肝纤维化中危亚组、肝纤维化高危亚组一般资料及实验室检测指标比较
3 组研究对象性别、BMI、NC、WC、VFA、SFA、PLT、AST、TC、lncRNA NEAT1、miRNA-182-5p 比较,差异有统计学意义(P<0.05)。组内比较结果显示,肝纤维化低危亚组VFA、SFA、AST、lncRNA NEAT1低于肝纤维化中危亚组、肝纤维化高危亚组,PLT、miRNA-182-5p 高于肝纤维化中危亚组、肝纤维化高危亚组,BMI、WC、NC 低于肝纤维化高危亚组,TC 高于肝纤维化高危亚组,差异有统计学意义(P<0.05);肝纤维化中危亚组PLT、miRNA-182-5p 高于肝纤维化高危亚组,AST、lncRNA NEAT1 低于肝纤维化高危亚组,差异有统计学意义(P<0.05)。3 组患者年龄、T2DM病程、吸烟史、饮酒史、FPG、HbA1c、HOMA-IR、ALT、Alb、TG、SUA 比较,差异无统计学意义(P>0.05),见表3。
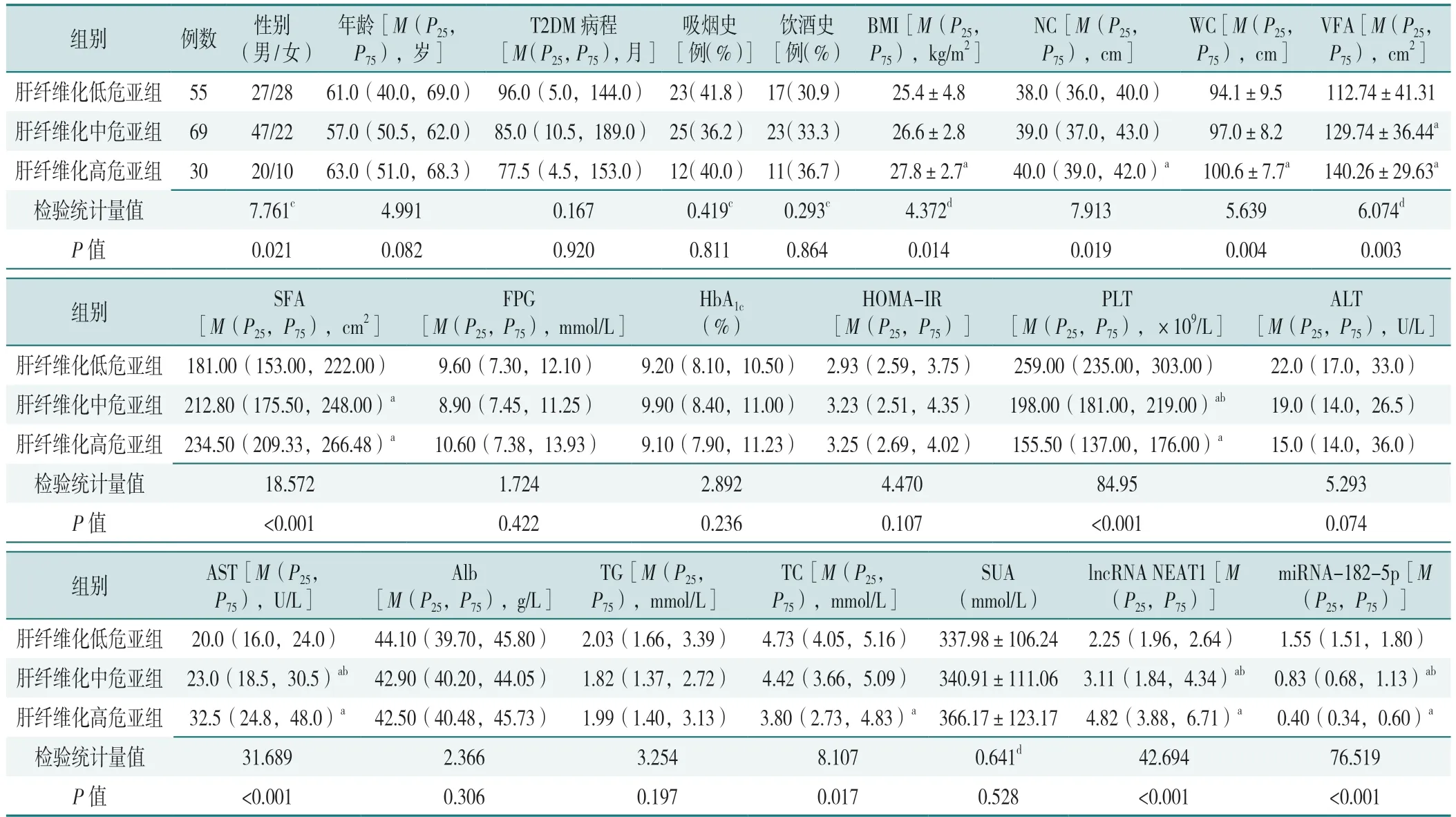
表3 肝纤维化低危亚组、肝纤维化中危亚组、肝纤维化高危亚组一般资料及实验室检测指标比较Table 3 Comparison of general information and laboratory indicators among the low-risk subgroup,medium-risk subgroup and high-risk subgroup of liver fibrosis
2.3 肝纤维化高危亚组患者lncRNA NEAT1、miRNA-182-5p 的相关性分析
Spearman 秩相关分析结果显示,肝纤维化高危亚组患者lncRNA NEAT1 与miRNA-182-5p 呈负相关(rs=-0.438,P<0.05)。
2.4 肝纤维化发生风险影响因素的多因素有序Logistic回归分析
以T2DM 合并MAFLD 患者肝纤维化危险程度为因变量(赋值:肝纤维化低危亚组=1,肝纤维化中危亚组=2,肝纤维化高危亚组=3),以性别(赋值:男=1,女=2)、lncRNA NEAT1、miR-182-5p、BMI、NC、WC、VFA、SFA、AST、PLT、TC(赋值均为实测值)为自变量进行多因素有序Logistic 回归分析,结果显示lncRNA NEAT1、VFA、miRNA-182-5p、PLT、AST 是T2DM 合并MAFLD 患者肝纤维化发生风险的影响因素(P<0.05),见表4。
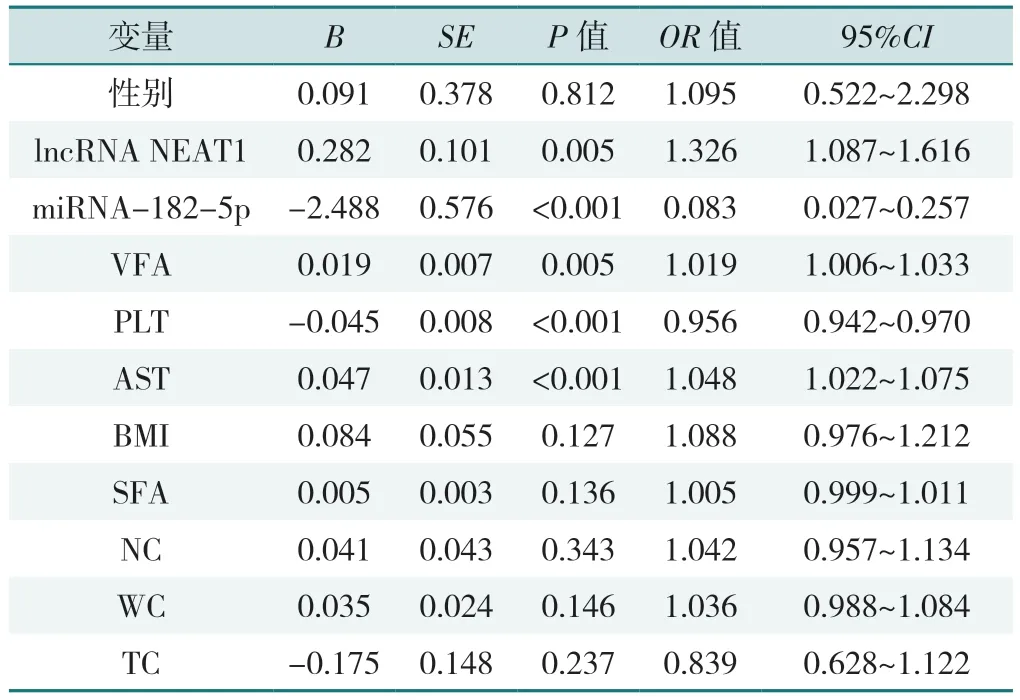
表4 肝纤维化风险影响因素的多因素有序Logistic 回归分析结果Table 4 Multilevel ordinal Logistic regression analysis of risk factors for liver fibrosis
3 讨论
目前MAFLD 已经取代慢性肝炎成为全球最常见的慢性肝脏疾病[12],最被人们接受并承认的发病机制是多重打击学说,即不良的饮食习惯、不佳的生活方式以及环境和遗传等因素导致了IR、肥胖、代谢紊乱、氧化应激、线粒体功能障碍,其共同作用导致了肝细胞损伤和纤维化,甚至可以进展为肝硬化。所以早期监测、识别肝纤维化危险程度对患者预后具有重要意义。目前肝纤维化的诊断金标准仍然是肝穿刺,但因其为有创检查,故国际上多采用FIB-4 评估肝脏纤维化程度[11]。
本研究发现T2DM 合并MAFLD 组患者BMI、WC、VFA、SFA、TG 显著升高,提示T2DM 合并MAFLD 组患者的脂肪蓄积、代谢异常更为严重,认为体质量增加及腹型肥胖可能增加单纯T2DM 人群患MAFLD 的风险。在T2DM 合并MAFLD 中发现与肝纤维化低危亚组相比,肝纤维化高危亚组患者AST、VFA、SFA、BMI、NC、WC 显著升高,同时多因素有序Logistic 回归分析发现,VFA 是T2DM 合并MAFLD 患者肝纤维化风险的影响因素,VFA 水平越高,发生肝纤维化的风险越高。YU 等[12]发现VFA 的增加与NAFLD 及肝纤维化独立相关,提示VFA 可能是MAFLD 患者生活方式改变的中心目标。内脏脂肪组织(VAT)导致病理变化的可能机制是:VFA与其独特的生理位置以及酯酶活性增强有关,从而使血液中游离脂肪酸(FFA)显著升高,并通过门脉系统直接进入肝脏,高浓度的FFA 储存在肝脏脂肪细胞,最终导致IR 和糖脂代谢紊乱的加重,其次VAT 蓄积导致肝脏脂肪变性,并可能通过脂质重配、线粒体失调、产生活性氧、脂质过氧化、内质网应激等病理生理机制引发炎症,最终由NAFLD 进展为肝纤维化[13-14]。另外一项国外的队列研究发现,NC 与血糖异常和代谢综合征标志物相关,且NC 可以在识别糖尿病前期或糖尿病患者中发挥作用,可预测MAFLD 的发生风险[15],但本研究结果不支持NC 与肝纤维化之间的关联。本研究多因素有序Logistic 回归分析结果表明,NC 不是T2DM合并肝纤维化风险的影响因素,与既往研究一致。本研究还发现PLT 下降是T2DM 合并发生肝纤维化的独立危险因素,韩孟冉等[16]研究发现,肝纤维化患者PLT/白细胞计数显著下降,并且PLT/白细胞计数是预测肝纤维化的独立危险因素,本研究结果与之一致。LIU 等[17]认为,肝脏可以产生血小板生成素(TPO),在MAFLD 病理过程中,线粒体功能发生损害,可以影响TPO 合成,从而导致PLT 降低。此外,国外学者认为IR 本身不引起PLT 降低,但是当MAFLD 存在时,IR 可能会引发PLT 降低,同时发现PLT 的降低程度与肝组织的脂肪浸润程度有关[18],本研究结果与之一致。
研究显示lncRNA NEAT1 在脂肪代谢中起着重要调控作用[19]。lncRNA NEAT1 在MAFLD 大鼠肝脏组织中呈高度表达,且lncRNA NEAT1 下调后可以通过哺乳动物雷帕霉素靶蛋白mTOR 及其下游调控蛋白核糖体S6 蛋白激酶(s6k1)信号通路来调节脂质合成缓解MAFLD[20]。还有研究发现miRNA-140 和lncRNA NEAT1 相互作用可增强lncRNA NEAT1 的表达以及稳定性,SUN 等[21]发现lncRNA NEAT1 可以与miRNA-140竞争性结合,并通过调节腺苷酸激活蛋白激酶/固醇调节元件结合蛋白(AMPK/SREBP-1)信号通路影响MAFLD 的进展,同时lncRNA NEAT1 也可以通过靶向调控Rho 相关卷曲螺旋形成蛋白激酶1(ROCK1)的miRNA-146a-5p 并进一步影响AMPK/SREBP 通路,最终增加脂肪变性,加重MAFLD 的进展[22]。
本研究发现,T2DM 合并MAFLD 患者外周血中lncRNA NEAT1 的表达显著升高,且相较于肝纤维化低危亚组与中危亚组患者,肝纤维化高危亚组lncRNA NEAT1 表达明显升高,多因素有序Logistic 回归分析发现lncRNA NEAT1 是T2DM 合并MAFLD 患者发生肝纤维化的危险因素。有学者通过体外实验证实lncRNA NEAT1 可通过与miRNA-506 竞争性结合胶质瘤相关肿瘤基因同源3(GLI3)来调节肝纤维化、炎症反应及脂质代谢[23]。故本研究认为外周血中lncRNA NEAT1 的相对表达量与进展肝纤维化有一定关系。
近年来有学者认为miRNA 在糖脂代谢疾病中起重要作用,其中miRNA-182-5p 已被证实可以影响IR 及脂质代谢[24]。本研究发现,T2DM 合并非MAFLD 组患者miRNA-182-5p 显著高于T2DM 合并MAFLD 组,这与WEALE 等[25]的研究一致,该研究纳入了1 270例受试者,发现T2DM 及糖尿病前期患者中miRNA-182-5p 显著升高。而KAROLINA 等[26]发现miRNA-182-5p 在T2DM 中表达下调,在FPG 受损的受试者中表达轻微上调,认为miRNA-182-5p 通过靶向调控叉头盒蛋白O1(FOXO1)来促进葡萄糖生成,在介导肝脏IR 信号传导效应中发挥关键作用。本研究通过分析肝纤维化低危亚组、中危亚组、高危亚组miRNA-182-5p 的表达情况,发现肝纤维化高危亚组miRNA-182-5p 显著下降。有学者发现miRNA-182-5p 在肥胖大鼠和人类VAT 中显著降低,认为其是脂肪形成的新型负调节剂[27]。日本血吸虫诱导的肝纤维化的相关研究中发现miRNA-182 呈高表达,FOXO1 低表达,两者可促进肝纤维化细胞的增殖和抑制细胞凋亡[28-29]。但miRNA-182 与T2DM 合并MAFLD 患者发生肝纤维化风险的关系仍需进一步探究。
研究发现,用脂多糖(LPS)诱导急性肺损伤小鼠和细胞模型中lncRNA NEAT1 水平升高,且lncRNA NEAT1 可以通过与miRNA-182-5p 结合调控WNT1 诱导信号通路蛋白1(WISP1)的表达,lncRNA NEAT1过表达,可以通过miRNA-182-5p/WISP1 轴抑制LPS暴露的肺泡巨噬细胞的活力,进而促进细胞凋亡和炎症[30],而lncRNA NEAT1 与miRNA-182-5p 在肝纤维化中的关系尚不清楚。本研究Spearman 秩相关分析结果发现在肝纤维化高危亚组患者中lncRNA NEAT1 与miRNA-182-5p 呈负相关,因未进行动物细胞实验,故初步认为lncRNA NEAT1、miRNA-182-5p 在T2DM 合并MAFLD 患者肝纤维化的发生和发展中起一定作用,但具体机制仍需进一步验证。
本研究存在以下局限性:许多降糖药对MAFLD 及肝纤维化有一定作用,影响复杂,分析较为困难,故本研究未分析降糖药物对疾病的影响;此外,本研究采用FIB-4 评估研究对象的肝纤维化情况,未经病理验证,故可能存在误差。
综上所述,lncRNA NEAT1 及miRNA-182-5p 可能在T2DM 合并MAFLD 患者及肝纤维化患者中起重要作用,提示高lncRNA NEAT1、高VFA、低miRNA-182-5p、低PLT 可能是患者肝纤维化风险的独立危险因素。本研究为进一步明确外周血中lncRNA NEAT1、miRNA-182-5p 对肝纤维化的作用机制提供了新的思路,同时为T2DM 合并MAFLD 患者发生肝纤维化的预防提供了新的方向。
作者贡献:贺佳、魏枫负责研究的构思及设计;贺佳、李永平负责研究的实施,论文的撰写及修订;刘美岚、吴亚玲、韶龙格负责数据的收集及整理;贺佳、刘美岚负责统计学处理及绘制图表;魏枫负责文章的质量控制,对文章整体负责,监督管理。
本文无利益冲突。

