血清白介素6、空腹血糖水平与冠心病及不良心血管事件关系的研究
林小梅,祖姆热提·阿布都克依木,马春晖,徐梦鸽,马巨星,李霞*
1.830011 新疆维吾尔自治区乌鲁木齐市,新疆医科大学第五附属医院全科医学科
2.830011 新疆维吾尔自治区乌鲁木齐市,新疆医科大学第五附属医院急诊医学科
冠心病(coronary heart disease,CHD)为我国常见的慢性病之一,其高患病率及致死率威胁着人类身心健康。然而传统危险因素仅解释了部分CHD 的发生原因,越来越多的研究发现炎症反应是CHD 发生和进展的关键驱动因素[1]。炎症反应中所涉及的各种炎症因子及相关通路不仅参与CHD 进程中动脉斑块的启动,也加剧了局部内皮细胞凋亡、单核细胞聚集以及新生血管生成,导致斑块形成、破裂和脱落,引发心肌局部缺血或梗死。在众多炎症因子中,白介素(IL)6 是血管炎症级联反应主要参与者。据报道,抑制IL-6 释放可以降低相关炎症反应及血管内皮损伤,达到控制CHD 病程进展的作用[2]。此外,糖尿病及糖尿病前期已被证明与心血管疾病独立相关。在妊娠妇女体内,血糖作为连续变量与胎儿特定心脏畸形概率具有直接相关性[3]。同时,高糖状态还可以加剧血管内皮细胞凋亡[4]。因此,空腹血糖(FPG)水平上升可在一定程度上增加人群的CHD 患病风险。目前多数研究仅表明血清IL-6 水平、糖尿病与冠状动脉狭窄程度相关[5-7]。本文通过分析血清IL-6、FPG 水平与CHD 血管病变严重程度、临床分型及不良心血管事件之间的关系以探讨炎性因子、血糖水平在CHD 发病中的作用。
1 对象与方法
1.1 研究对象
纳入2020 年9—11 月就诊于新疆医科大学第五附属医院的CHD 患者为研究对象。纳入标准:(1)年龄≥18 岁;(2)参照《稳定性冠心病基层诊疗指南(2020 年)》[8]中关于CHD 的诊断标准,即经冠状动脉造影检查发现心外膜下冠状动脉直径狭窄>50%,且患者有典型心绞痛症状或无创性检查显示患者有心肌缺血证据。排除标准:(1)急慢性感染性疾病;(2)心肌炎、心肌病及进展期肾脏疾病、肝脏疾病等;(3)自身免疫性疾病、血液系统疾病及恶性肿瘤;(4)近3个月内曾接受大手术或发生脑血管意外及卒中。本研究按照赫尔辛基宣言进行,经新疆医科大学第五附属医院医学伦理委员会批准(伦理审批号:XYDWFYLSH-2022-042)。患者均了解本研究内容并签署知情同意书。最终纳入80 例患者,其中男31 例,女41 例,平均年龄(63.7±10.8)岁,稳定型心绞痛患者34 例,急性冠状动脉综合征患者46 例。
1.2 研究方法
1.2.1 患者入院后第2 天空腹采集2 mL 静脉血液样本,静置30 min 后2 000 r/min 离心20 min(离心半径13.5 cm),收集上清液,快速冻存于-20 ℃冰箱。采用酶联免疫吸附法(ELISA)检测血清IL-6 水平,所选试剂盒由上海酶联生物有限公司提供。操作步骤严格按照ELISA 试剂盒上的要求进行。
1.2.2 收集患者的一般资料:性别、年龄、BMI、收缩压(SBP)、舒张压(DBP)、吸烟情况、高血压、糖尿病、冠状动脉造影结果;收集患者实验室检查结果:血清IL-6、FPG、三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白(LDL-C)等。血脂水平及FPG 由新疆医科大学第五附属医院检验科采用贝克曼LX-20 全自动生化分析仪检测。由专业医护人员使用医用电子血压计测量血压,测量前患者休息5 min,取坐位测量右肱动脉血压2 次(每次间隔时间为1 min),结果取平均值[9]。
1.2.3 吸烟定义为每日吸1 支及以上香烟或烟草制品,且总时长>1 年。高血压定义为在未使用降压药物的情况下,非同日3 次测量诊室血压,收缩压≥140 mmHg和/或舒张压≥90 mmHg[9]。糖尿病定义为FPG ≥7.0 mmol/L 或糖负荷后2 h 血糖≥11.1 mmol/L[10]。
1.2.4 采用Gensini 积分法[11]评定冠状动脉狭窄程度。Gensini 积分法将冠状动脉分为14 段,总分为各节段狭窄程度与对应的权重系数(狭窄程度:0~25%=1,26%~50%=2,51%~75%=4,76%~90%=8,91%~99%=16,100%=32;狭窄部位:左主干=5,左前降支近段=2.5,回旋支近段=2.5,前降支中段=1.5,右冠状动脉、前降支远段、回旋支远段、回旋支中段、左心室后侧支、钝缘支动脉、第一对角支、心尖支=1,第二对角支=0.5)乘积之和,通常Gensini 积分越高代表冠状动脉狭窄程度及CHD 严重程度越重。
1.2.5 依据Gensini 积分评分标准,将患者得分结果按中位数分为轻度狭窄组(A 组,Gensini 积分≤33.25 分,n=40)和中重度狭窄组(B 组,Gensini 积分>33.25 分,n=40)。根据冠状动脉造影结果,将患者按照病变支数分为单支病变组(n=28)、双支病变组(n=21)及多支病变组(病变支数≥3,n=31)。根据患者临床分型,将患者分为稳定型心绞痛组(n=34)和急性冠状动脉综合征组(n=46)。
1.2.6 患者出院后第6、12、18 及24 个月进行门诊随访或电话随访,随访终点为发生不良心血管事件(包括心源性死亡、复发性心肌梗死和靶血管血运重建及心力衰竭),并记录发生终点事件的时间点,末次随访时间为患者出院后2 年。
1.3 统计学方法
采用SPSS 25.0 统计学软件进行数据分析。符合正态分布的计量资料以(±s)表示,两组间比较采用独立样本t 检验,多组间比较采用ANOVA 方差分析,组间两两比较采用LSD-t 检验;计数资料以相对数表示,组间比较采用χ2检验。采用Spearman 秩相关分析探讨血清IL-6、FPG 水平与患者相关资料的关系。采用Kaplan-Meier 法绘制患者的生存曲线,生存曲线的比较采用Log-rank 检验。采用单因素及多因素Cox 比例风险模型探究CHD 患者不良心血管事件发生风险的影响因素。绘制IL-6 预测不良心血管事件发生的受试者工作特征曲线(ROC 曲线)。以P<0.05 为差异有统计学意义。
2 结果
2.1 不同Gensini 积分分组患者一般资料及实验室检查结果比较
A 组与B 组性别、年龄、BMI、SBP、DBP、TC、TG、LDL-C、HDL-C 及吸烟、糖尿病、高血压比例比较,差异均无统计学意义(P>0.05);A 组IL-6、FPG 低于B 组,差异有统计学意义(P<0.05),见表1。
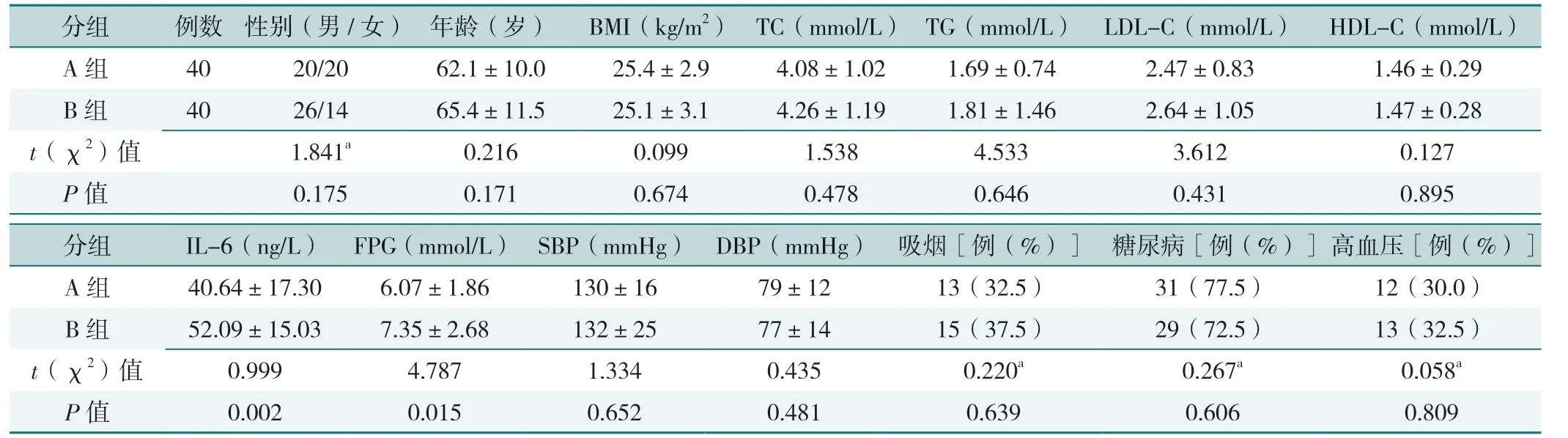
表1 不同Gensini 积分患者一般资料及实验室检查结果比较Table 1 Comparison of general data and laboratory test results between the two groups of different Gensini score
2.2 不同病变支数分组患者血清IL-6、FPG 水平比较
3 组患者血清IL-6、FPG 水平比较,差异有统计学意义(P<0.05);其中多支病变组患者血清IL-6 水平高于单支病变组,FPG 水平高于双支病变组(P<0.05),见表2。
表2 不同病变支数患者血清IL-6、FPG 水平的比较(±s)Table 2 Comparison of serum IL-6 and FPG in patients with different numbers of lesions
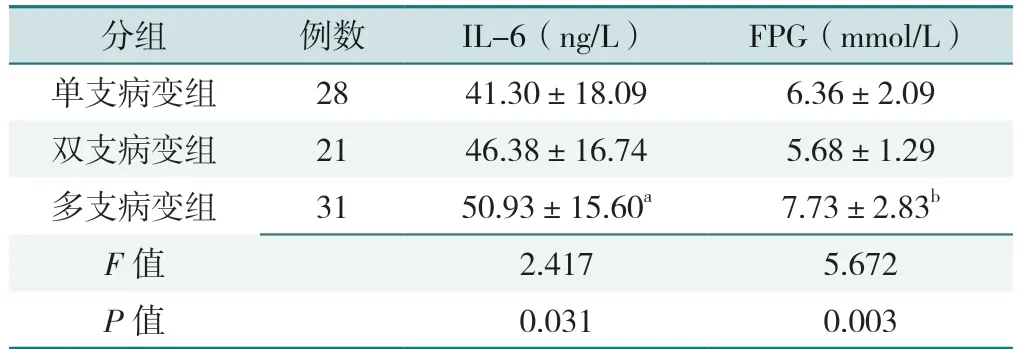
表2 不同病变支数患者血清IL-6、FPG 水平的比较(±s)Table 2 Comparison of serum IL-6 and FPG in patients with different numbers of lesions
注:a 表示与单支病变组比较P<0.05,b 表示与双支病变组比较P<0.05。
分组例数IL-6(ng/L)FPG(mmol/L)单支病变组2841.30±18.096.36±2.09双支病变组2146.38±16.745.68±1.29多支病变组3150.93±15.60a7.73±2.83b F 值2.4175.672 P 值0.0310.003
2.3 不同临床分型分组患者血清IL-6、FPG 水平的比较
急性冠状动脉综合征组患者血清IL-6、FPG 高于稳定型心绞痛组,差异有统计学意义(P<0.05),见表3。
表3 不同临床分型分组患者血清IL-6、FPG 水平的比较(±s)Table 3 Comparison of serum IL-6 and FPG levels in patients with different clinical subtypes
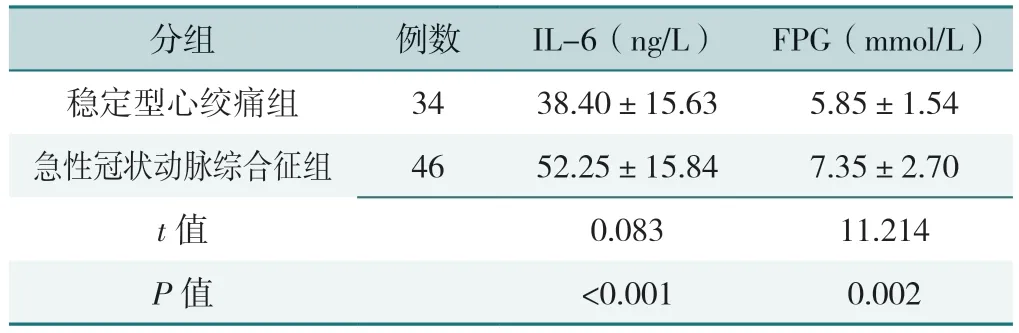
表3 不同临床分型分组患者血清IL-6、FPG 水平的比较(±s)Table 3 Comparison of serum IL-6 and FPG levels in patients with different clinical subtypes
分组例数IL-6(ng/L) FPG(mmol/L)稳定型心绞痛组3438.40±15.635.85±1.54急性冠状动脉综合征组4652.25±15.847.35±2.70 t 值0.08311.214 P 值<0.0010.002
2.4 血清IL-6、FPG 水平与CHD 患者资料的相关性分析
Spearman 秩相关分析结果显示,血清IL-6 与临床分型、冠状动脉病变支数、Gensini 积分、性别、TG、FPG 有相关性,FPG 与临床分型、冠状动脉病变支数、Gensini 积分、年龄、IL-6 有相关性(P<0.05),见表4。
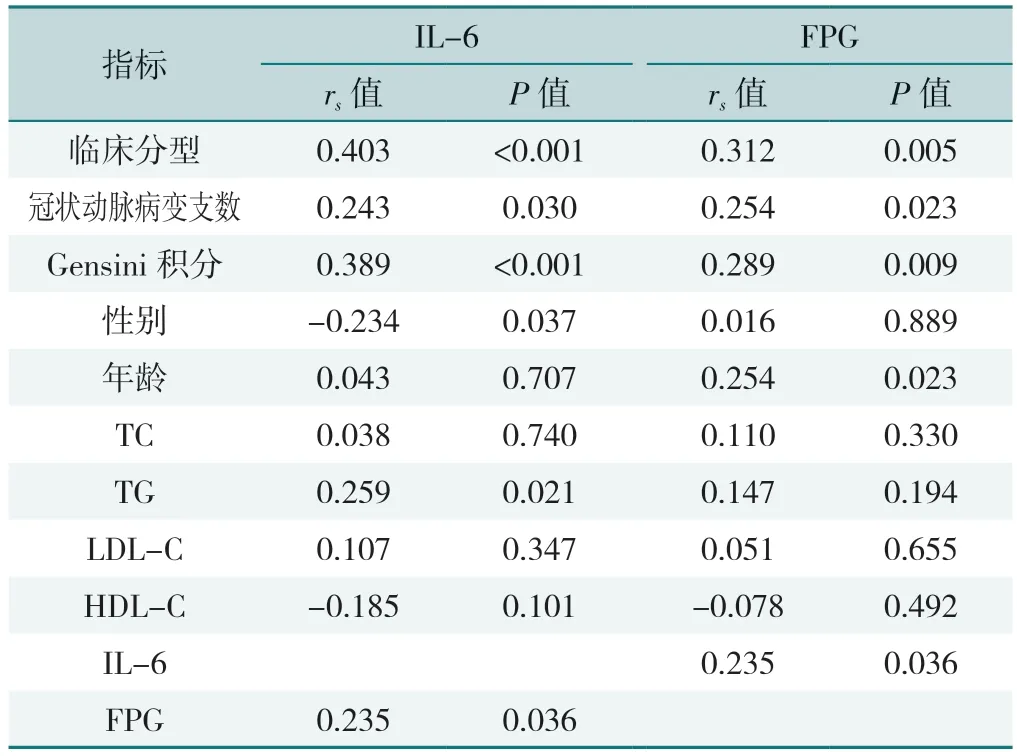
表4 血清IL-6、FPG 水平与CHD 患者资料的相关性分析Table 4 Correlation analysis of serum IL-6,FPG levels with general data of CHD patients
2.5 患者随访结果分析
对CHD 患者进行为期2 年的随访,发生不良心血管事件者共计45 例。将患者按IL-6 中位表达水平(45.8 ng/L)者分为IL-6>45.8 ng/L 组(n=39)和IL-6 ≤45.8 ng/L 组(n=41),FPG 以参考值上限(6.1 mmol/L)作为分组标准,将患者分为FPG>6.1 mmol/L 组(n=36)和FPG ≤6.1 mmol/L 组(n=44)。Log-rank 检验结果显示,IL-6>45.8 ng/L 组不良心血管事件发生率高于IL-6 ≤45.8 ng/L 组(76.9% 与36.6%;χ2=16.075,P<0.001)、FPG>6.1 mmol/L 组不良心血管事件发生率高于FPG ≤6.1 mmol/L 组(69.4% 与45.5%;χ2=4.292,P=0.038),差异有统计学意义,见图1、2。
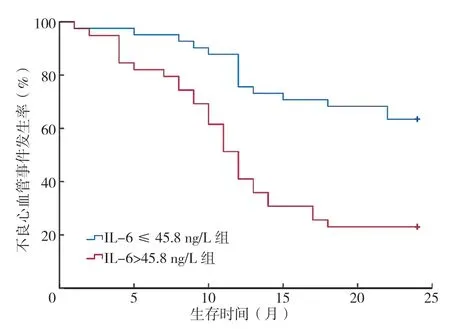
图1 不同IL-6 水平复合终点事件发生率比较Figure 1 Comparison of the incidence of complex endpoint events at different IL-6 levels

图2 不同FPG 水平复合终点事件发生率比较Figure 2 Comparison of the incidence of complex endpoint events at differen FPG levels
2.6 患者发生不良心血管事件影响因素的单因素与多因素Cox 比例风险模型分析
以患者是否发生不良心血管事件为因变量(赋值:否=0,是=1),以性别(赋值:女=0,男=1)、年龄(赋值:≤65 岁=0,>65 岁=1)、临床分型(赋值:稳定型心绞痛=0,急性冠状动脉综合征=1)、冠状动脉病变支数(赋值:单支病变=0,双支及多支病变=1)、Gensini 积分(赋值:≤33.25 分=0,>33.25 分=1)、IL-6(赋值:≤45.8 ng/L=0,>45.8 ng/L=1)、FPG(赋值:≤6.1 mmol/L=0,>6.1 mmol/L=1)为自变量,纳入单因素Cox 比例风险模型分析,结果显示年龄>65 岁、冠状动脉病变支数双支或多支、Gensini 积分>33.25 分、IL-6>45.8 ng/L 和FPG>6.1 mmol/L 是CHD 患者发生不良心血管事件的影响因素(P<0.05),见表5。将单因素分析中有统计学意义的结果纳入多因素Cox 比例风险模型分析(赋值同上),结果显示IL-6>45.8 ng/L 是CHD患者发生不良心血管事件的影响因素(P<0.05),见表5、6。
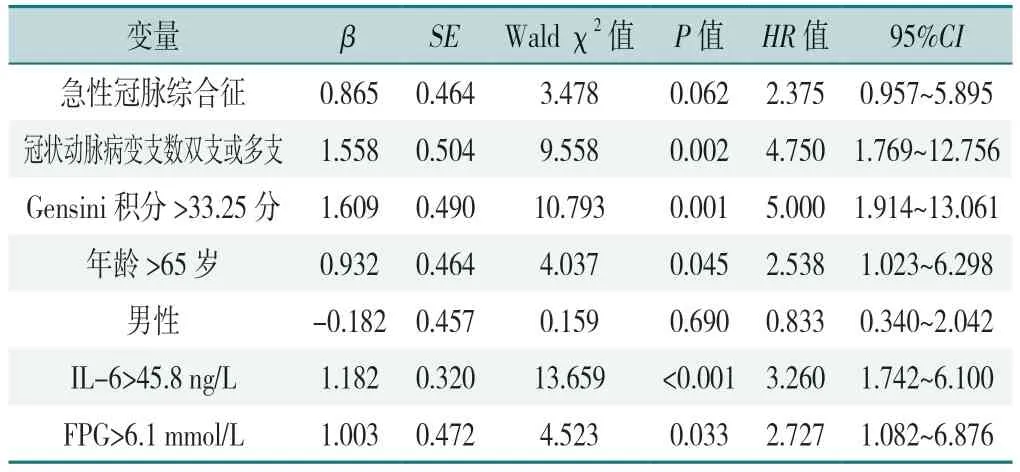
表5 CHD 患者发生不良心血管事件影响因素的单因素Cox 比例风险回归分析结果Table 5 Univariate Cox proportional hazards regression analysis of the influencing factors of adverse cardiovascular events in CHD patients
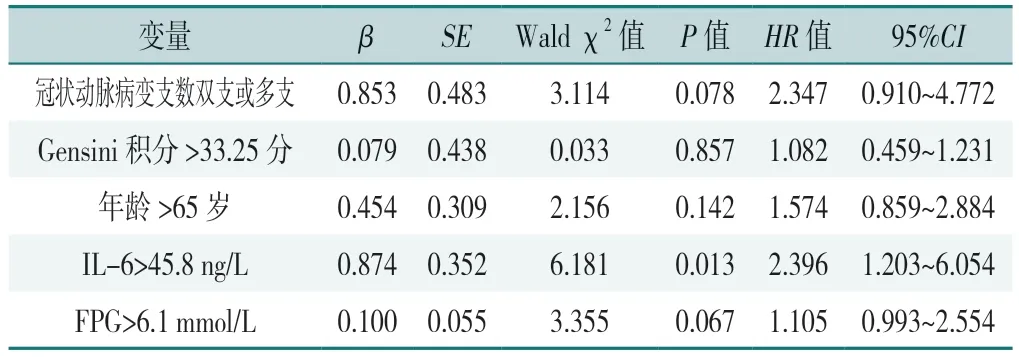
表6 患者发生不良心血管事件影响因素的单因素Cox 比例风险回归分析结果Table 6 Multivariate Cox proportional risk regression analysis of factors affecting adverse cardiovascular events in CHD patients
2.7 IL-6 对CHD 患者发生不良心血管事件的预测价值
绘制IL-6 预测CHD 患者发生不良心血管事件的ROC 曲线,结果显示IL-6 预测患者发生不良心血管事件的ROC 曲线下面积为0.769(95% CI=0.658~0.880),最佳截断值为40.97 ng/L,灵敏度为0.867,特异度0.683,见图3。
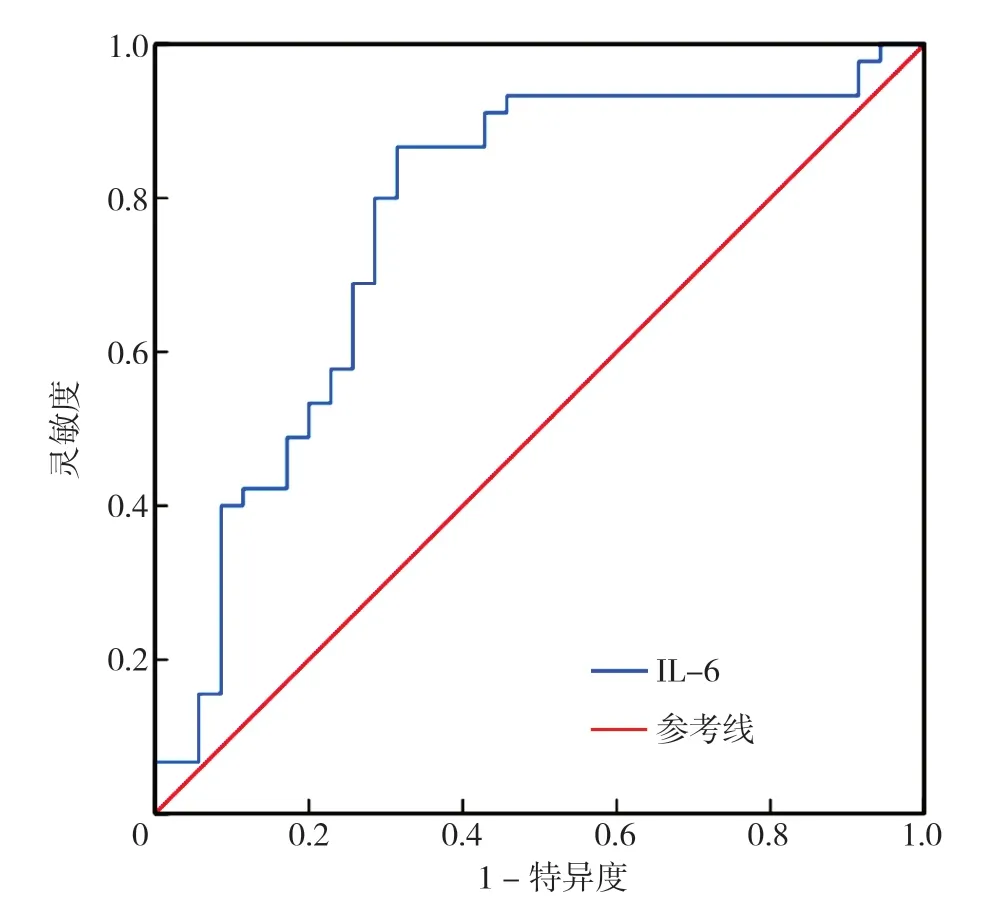
图3 IL-6 预测CHD 患者预后的ROC 曲线Figure 3 ROC curve of serum IL-6 level predicting the prognosis of CHD patients
3 讨论
CHD 是指冠状动脉血流受限引起的心肌缺血、缺氧或坏死性疾病,动脉粥样硬化引起的动脉内膜的不对称局部增厚是血流受限的主要原因。尽管对血脂和高血压等传统危险因素进行了有效治疗,但CHD 仍然是造成我国人口死亡和残疾的主要原因[12]。研究发现,血清IL-6 水平可预测动脉病变的严重程度和斑块的脆弱性及进展[13]。且单次测定IL-6>1 ng/L 时可以使动脉粥样硬化性心血管疾病评分检测心血管疾病的准确性提高38%[14]。本研究表明血清IL-6 水平与临床分型、冠状动脉病变支数及冠状动脉狭窄严重程度有相关性,这与以往相关研究报道一致[15]。区分稳定型心绞痛与急性冠状动脉综合征(包括不稳定型心绞痛、急性心肌梗死等)的标准是冠状动脉内的斑块是否为易损斑块。易损斑块的主要病理特征包括巨噬细胞浸润、局部炎性反应、大脂质核心和薄纤维帽。薄纤维帽抵御炎症侵袭能力弱,斑块发生破裂及内出血风险较高,导致CHD病情进展。故本研究证明了血清IL-6 水平或许与斑块稳定性相关。研究发现,血清IL-6 是心血管疾病死亡的预测因子,其水平升高与长期心血管死亡风险增加有关[16]。本研究进一步表明血清IL-6 水平高表达可增加CHD 患者不良心血管事件的发生风险,可预测不良心血管事件的发生。
IL-6 是急性炎症反应中常用的参考指标,由IL-6基因编码并由某些免疫和非免疫细胞分泌,是一种参与免疫、感染和炎症机制以及中枢神经系统生理功能的细胞因子[17]。IL-6 主要作用于血管内皮,通过Janus 激酶信号转导与转录激活因子3(JAK/STAT3)通路、核因子κB(nuclear factor kappa-B,NF-κB)通路,直接激活或抑制相应靶基因转录,上调肿瘤坏死因子α(TNF-α)、IL-6、血管-细胞黏附分子-1 和细胞间黏附分子-1,促进单核细胞、内皮细胞黏附并且向内皮下转移,催化和放大炎性反应和毒性作用,促进冠状动脉斑块发生[18]。吴坤等[19]发现在心肌缺血患者中,血清IL-6 水平增高会引起心脏容积、心室舒张末期血流流速/舒张早期血流流速(A/E)等增加,左心室射血分数降低。这是由于在心肌缺血再灌注期间,心肌细胞释放IL-6,其通过Ca2+/钙调蛋白依赖性蛋白激酶Ⅱ依赖性激活STAT3,诱导心肌细胞肥大,引起明显的左心室肥大和舒张期松弛受损[20]。动物实验发现,IL-6的基因缺失减轻了小鼠的心脏纤维化和功能障碍[21]。遗传性IL-6 信号转导缺陷降低了克隆造血中的心血管风险,抑制IL-6 表达能延缓小鼠动脉粥样硬化的发展[22]。此外,不良心血管事件的发生可能是由炎症介导的,ALMUWAQQAT 等[23]证明心血管细胞再生能力降低与全身炎症标志物增加有关。最新CANTOS 试验也发现,抑制IL-6 信号转导可降低不良心血管事件的发生风险[24]。本研究提示,血清IL-6 可用于预测CHD 患者2 年内不良心血管事件的发生风险,且IL-6 ≥40.97 ng/L 时发生风险高。故监测血清IL-6 水平可为临床工作中CHD 患者病情变化提供预警。
除了炎症因子IL-6 对心脏的影响外。血清高葡萄糖水平也可调节心肌细胞、成纤维细胞和心脏巨噬细胞中的多种细胞内信号通路,这些信号通路通过活化NF-κB 促进IL-6 的表达[20]。WANG 等[7]对298 例接受冠状动脉造影的CHD 患者随访血管造影发现,与血糖正常患者相比,FPG 受损和糖尿病患者的Gensini积分以及患病血管数量增加更明显,冠状动脉病变的进展也更迅速。本研究进一步证明血清FPG 水平与CHD临床分型、冠状动脉病变支数、Gensini 积分及IL-6 水平呈正相关。内皮细胞是心脏脉管系统的核心组成部分,当其暴露于高葡萄糖水平时,可激活IκB 激酶β和NF-κB 信号转导,促进炎症因子表达的上调、胰岛素敏感性降低和一氧化氮产生减少,使得内皮屏障功能受损,冠状动脉内皮完整性被破坏,从而引起内皮下脂质堆积,管腔发生狭窄[20]。而当冠状动脉发生狭窄时,心肌供血不足,在缺血缺氧状态下,内皮细胞自身调控增强糖酵解以满足自身对能量及物质代谢的需求。过度增加的血清葡萄糖在缺血缺氧条件下无法充分代谢,过度增强的糖酵解会进一步抑制线粒体的氧化呼吸链,使活性氧、乳酸和某些蛋白酶活性增加,破坏细胞外基质,导致炎性细胞浸润血管壁从而加剧冠状动脉狭窄程度[25]。这表明FPG 受损存在时,其对冠状动脉的危害就已经出现。因此,血清FPG 高表达可提示CHD 患者预后不良。
由于本研究所纳入的样本量较少,导致组间差异性相对较弱,后期应进行更大样本量、多中心、前瞻性的研究;其次只纳入了血清IL-6、FPG 水平,后期应完善糖耐量试验、糖化血红蛋白及多种炎症因子的测定,进一步探讨炎症、糖代谢与CHD 的关系。
综上所述,炎症因子IL-6、FPG 在CHD 病情评估中具有重要作用。二者均与CHD 临床分型、冠状动脉狭窄程度及冠状动脉病变支数相关,血清IL-6、FPG高表达增加了CHD 患者再发不良心血管事件的风险,且血清IL-6 可预测CHD 患者不良心血管事件的发生风险。
作者贡献:林小梅负责论文撰写;林小梅、马春晖、徐梦鸽、马巨星负责数据收集和整理;马春晖负责数据的处理;祖姆热提·阿布都克依木、李霞共同制订总体研究目标。
本文无利益冲突。

