ANKRD66高表达是结肠癌不良预后的有效预测指标
赵海远,刘 刚,李 阳,杨年钊,赵 军
皖南医学院弋矶山医院//皖南医学院第一附属医院胃肠外科,安徽 芜湖241001
结肠癌(COAD)是全球第3大常见癌症,每年约有185万例发病病例和88万例死亡[1,2]。虽然其预后和治疗效果与肿瘤的分子机制密切相关,但目前COAD的形成和进展的分子机制仍不清楚,这阻碍了该疾病的有效治疗,近年免疫检查点抑制剂已经彻底改变了癌症治疗,目前努力在寻找预测指标和肿瘤免疫治疗的新方法[3-5]。ANKRD6位于染色体6(q14.2-q16.1)上,其特征是存在锚蛋白重复结构域,并作为信号通路的适配器[6,7]。通过JNK途径促进细胞增殖和侵袭,并可能通过WNT通路调控肿瘤免疫微环境[8,9]。它已被证明在许多细胞过程中发挥作用,包括细胞周期进程、DNA修复和细胞凋亡,但ANKRD6在COAD中具体的通路及其科研求证方法鲜有报告[10,11]。ANKRD6在非小细胞肺癌、乳腺癌和人类胶质瘤中高度表达,过表达是预后不良的预测因子[12-15]。有泛癌分析显示[16],在结直肠癌组织标本中,ANKRD6的表达明显高于癌旁组织,但其是否能调控肿瘤细胞的增殖和侵袭及分子机制等,有待于相关的基础实验证明,有关ANKRD6基因表达高低的生存影响及具体影响因素也未做具体分析,更缺少预后生存分析模型直观展示。因此,本研究旨在探究ANKRD6在COAD中的表达、生物功能及对预后的影响,为COAD的早期诊断和治疗提供新的思路。
1 资料和方法
1.1 数据采集和预处理
利用The Cancer Genome Atlas(TCGA)数据库(https://portal.gdc.cancer.gov/)的结肠癌(COAD)的RNA-Seq数据,获得521例COAD患者与41例正常组织的基因表达、免疫浸润以及相关患者的临床信息[17]。然后,在R软件使用Bioconductor package包进行数据处理,校正P<0.05。并按照TCGA提供的出版指南进一步分析所有数据[18]。
1.2 基因和数据筛选
通过R 软件提取TCGA 数据库中目标分子ANKRD6[ENSG00000135299.17]和所有基因的数据,并进行Pearson 相关性分析。使用阈值|Cor|>0.5&P<0.05筛选出436个基因,使用survival包进行批量拟合生存回归分析。最终选择与COAD生存预后相关的851个蛋白编码基因,并筛选条件为Cox回归分析HR>1和P<0.05。
1.3 方法
1.3.1 细胞和样品 人结肠癌细胞HT-29、HCT116、CaCO-2、RKO和人正常结肠上皮细胞CCD841由本实验室保存。分别按照ATCC网站描述的培养方法培养细胞。结肠癌和癌周组织的组织20例样本采集自在本机构接受结肠癌手术治疗的患者。将提取的组织储存在-80 ℃或4%多聚甲醛中以供进一步研究。本研究经皖南医学院弋矶山医院伦理委员会批准(编号:KJ20201008),所有患者均签署知情同意书。
1.3.2 细胞培养和转染 为进行细胞转染实验,先在37 ℃、5%CO2的培养箱中铺板培养细胞。在细胞对数生长期时,使用胰酶制成3~5×104/mL的细胞悬液,适量接种到培养板中并继续培养,确保在转染时铺板量达到15%~30%。使用NanoTrans 40将3种ANKRD6 siRNA转染到细胞中,包括一种三保一的设计,并设siCtrl作对照。48 h后收集细胞进行相关检测。其中,siCtrl(NC)的序列为5'-TTCTCCGAACGTCACGT-3',ANKRD6 siRNA#1 的序列为5'-GGUGCAUGUUAAAGAUUC ATT-3',ANKRD6 siRNA#2的序列为5'-CCCUGGAC AGACAAGACAATT-3',ANKRD6 siRNA#3的序列为5'-GCAGAUACGACCAUUGUUATT-3'。
1.3.3 CCK-8检测 在细胞转染24 h后,我们用胰酶将孔板内的细胞消化下来,并在倒置显微镜下使用细胞计数板计数。按照6000/孔的细胞密度在96孔板中接种细胞悬液(100 μL/孔),并设置每组5个副孔。24 h后,向每孔加入10 μL的CCK-8溶液(注意不要在孔内产生气泡),并将培养板放置于37 ℃、5%CO2的培养箱中孵育3 h。在孵育期结束后,我们使用酶标仪测定吸光度A450nm,将其记为第1天,并在同一时间连续监测3 d的吸光度。
1.3.4 细胞迁移侵袭实验 使用孔径为8 mm 的Transwell室(Corning Incorporated)进行细胞迁移和侵袭实验。首先,将约6×104敲减了ANKRD6基因的结肠癌细胞(siANKRD6)或其对照载体转染的细胞(siCtrl)接种于上室,并使用无血清培养基进行培养。接着,在下室中加入含20%FBS的培养基作为趋化剂。在孵育48 h后,我们使用4%多聚甲醛进行固定处理。随后,对迁移或侵入到下表面的细胞进行10%结晶紫染色,并在高倍视野下使用显微镜计数。
1.3.5 RNA提取与实时定量PCR 首先收集对数生长期的细胞,使用miRNA提取试剂盒提取总RNA并比色法测量RNA 浓度和A260/A280比值以确保RNA 质量良好。然后使用逆转录试剂盒将mRNA反转录为cDNA,反应体系为20 μL,根据逆转录反应程序,在37 ℃下反应15 min,85 ℃下反应5 s,最后在4 ℃下保存。接着使用PCR试剂盒检测ANKRD6在各细胞系中的表达,反应体系为20 μL,反应程序为:95 ℃预处理30 s,随后进行40个循环反应,其中每个循环的反应包括95 ℃变性5 s,60 ℃退火30 s。使用Human GAPDH基因作为内参,计算每个基因的相对表达水平以2(Ct内参基因-Ct目的基因)进行统计分析。
1.3.6 蛋白提取与Western blot 检测 首先使用含有Protease Inhibitor Cocktail的总蛋白提取试剂盒提取细胞的总蛋白,并用BCA 定量试剂盒测量总蛋白的浓度。取60 μg总蛋白加入上样缓冲液,进行电泳。在冷却条件下转膜,使用5%脱脂牛奶进行封闭,加入ANKRD6 和GAPDH 一抗,进行洗涤后加入相应二抗。使用ECL化学发光液进行检测,显影和定影,最后使用ImageJ软件进行分析。
1.3.7 免疫组织化学 对样本进行石蜡包埋、切片并进行抗原修复。使用非特异性结合阻断剂阻止非特异性背景结合,接着加入ANKRD6的兔多克隆一抗。进行洗涤步骤后,使用抗小鼠/兔二步法检测试剂盒加入相应二抗。进行洗涤步骤后,使用合适的显色试剂进行显色。去色、脱水、透明化并封片后,使用显微镜观察和采集图像。IHC染色结果由两名不知道临床样本来源的病理学家进行分析和评分,根据阳性表达的位置进行棕色区域的评分。
1.3.8 ANKRD6免疫浸润分析 使用R中的GSVA包[19]进行ssGSEA分析,探究ANKRD6与24种免疫细胞的特征基因之间的相关性。利用Spearman 相关性和Wilcoxon秩和检验分析ANKRD6高表达组和低表达组之间的免疫细胞浸润情况。
1.3.9 ANKRD6的相关基因集富集分析 首先,从TCGA数据库中获取与ANKRD6相关的前436个基因以及与COAD生存相关的851个基因。随后,进行基因本体论(GO分析)和KEGG通路分析,通过R中clusterProfiler包[20]进行富集分析,并通过ggplot2包进行可视化。P<0.05时认为差异具有统计学意义。
1.4 统计学分析
采用SPSS 25.0、GraphPad Prism 6.0 和R 脚本/Bioconductor 软件包进行统计分析和绘图。采用Mann-WhitneyU检验比较不同组之间ANKRD6的表达。根据ANKRD6的表达水平,将患者分为高危组和低危组,并使用Kaplan-Meier生存分析和log-rank检验构建COAD的生存曲线。使用单因素Cox分析和多因素Cox 回归分析,探究ANKRD6 是否能够有效预测COAD的预后。此外,采用基于nomogram模型的方法来预测患者的生存,使用R 软件中的"rms"包进行构建。使用校准曲线、决策曲线图(DCA)和特征曲线(ROC)来验证nomogram 模型的准确性和性能表现。采用Spearman相关检验评估ANKRD6表达与感兴趣的靶标之间的相关性。使用Student'st-test 检验和Kruskal-Wallis检验进行两组之间的比较。P<0.05时认为差异有统计学意义。
2 结果
2.1 ANKRD6 在COAD中的差异表达
免疫组织化学法结果显示,与相应的癌周组织相比,ANKRD6 蛋白在COAD 组织中高表达(图1A)。qRT-PCR 结果显示,与结肠上皮细胞CCD841 相比,ANKRD6 的mRNA 和蛋白表达在结肠癌细胞系HT-29、HCT116、CaCO-2和RKO中上调(图1B)。使用R软件分析来自TCGA 数据库不同T分期、N分期、stage分期、脉管侵犯和神经侵犯的COAD样本中ANKRD6 的表达,结果显示,ANKRD6的表达在进展期的指标T3-4、N2-3和StageⅢⅣ均呈现高表达(P<0.01,图1D~F)。有脉管和神经侵犯的样本中同样呈现高表达(图1G,H)。高表达的ANKRD6 在COAD 患者中总生存期(OS)和无疾病间隔(DFI)均减低(图1I、J)。
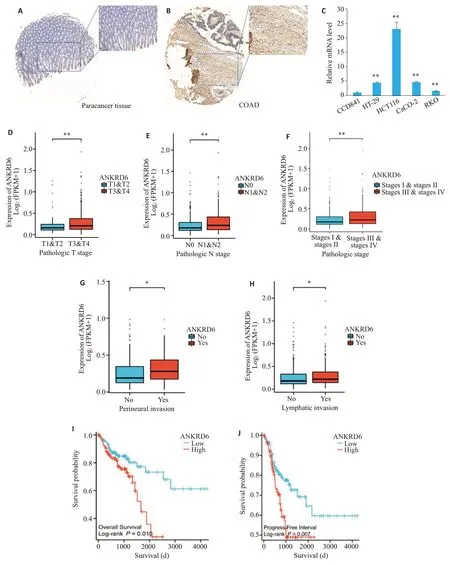
图1 COAD中ANKRD6的差异表达Fig.1 Differential expression of ANKRD6 in COAD.A,B:Immunohistochemical detection of ANKRD6 protein expression in COAD cancer tissues and paracancerous tissues.C: qRT-PCR detection of ANKRD6 mRNA expression in COAD cell lines HT-29,HCT116,CaCO-2 and RKO and in colonic epithelial cell line CCD841.**P<0.01 vs CCD841.D:Expression of ANKRD6 in COAD samples with different T stages.E: ANKRD6 expression in COAD samples with different N stages.F:ANKRD6 expression in COAD samples with different pathological stages.G,H: ANKRD6 expression in COAD samples with vascular and neural invasion.I,J:Prognostic value of ANKRD6 in predicting overall survival(OS)and progress-free interval(DFI).*P<0.05;**P<0.01;***P<0.001.
2.2 建立COAD预后的预测模型
单变量Cox 分析显示,年龄、T 分期、N 分期、M分期、Stage 分期和高表达的ANKRD6 与OS 显著相关(P<0.05,图2A)。多变量Cox回归分析显示年龄、N分期、M分期和Stage分期与OS显著相关(P<0.05,图2B)。我们构建了一个包括上述因素的Nomogram列线图来预测COAD的预后(图2C),列线图的C-index值为0.739(0.700~0.777)。列线图的1、3、5 年OS 的Calibration 校准曲线显示,在主要参数中实际概率和模型预测的概率之间有良好的拟合性(图2D)。DCA中很大区间内的阈值高于参考线,净收益较大,表明使用Nomogram 预测1、3、5 年OS 预后准确性较高(图2E~G)。ANKRD6的ROC分析支持该评分的诊断准确性(AUC=0.724,95%CI:0.652-0.796,图2H)。
2.3 ANKRD6表达与免疫浸润之间的关系
巨噬细胞的浸润水平与ANKRD6表达明显正相关(Spearman R=0.495,P<0.001,图3B),并且在ANKRD6高表达组中明显更高(P<0.001,图3A)。另一方面,Th17细胞的浸润水平与ANKRD6的表达呈明显的负相关(Spearman R=-0.283,P<0.001,图3B),并且在ANKRD6 高表达组中明显降低(P<0.001,图3A)。Tcm、Tem、Mast cells、NK cells、iDC、Neutrophils、Tgd、pDC、Th1 cells、T helper cells、DC、TFH、Eosinophils、B cells、T cells、和TReg细胞与ANKRD6表现出正相关,NK CD56bright细胞和Th2细胞与ANKRD6呈负相关(图3B)。评估24种不同的肿瘤浸润免疫细胞亚群的比例之间的不同程度的相关性,并通过热图来显示(图3C)。
2.4 ANKRD6的功能富集分析
通过共表达热图对ANKRD6相关基因可视化,红点表示与ANKRD6正相关的前15个基因,绿点表示与ANKRD6负相关的后15个基因(图4A)。分析ANKRD6相关基因在GO和KEGG数据库的富集情况,发现这些基因中主要富集在Wnt信号通路,血管内皮生长因子受体信号通路和钙信号通路等(图4B)。进一步分析COAD生存预后相关的基因,将ANKRD6相关的436个基因与COAD生存预后密切相关的851基因取交集得到11个共同基因(图4C)。分析这11个基因的两两相关性,结果通过网络图和热图进行展示(图4D、E)。
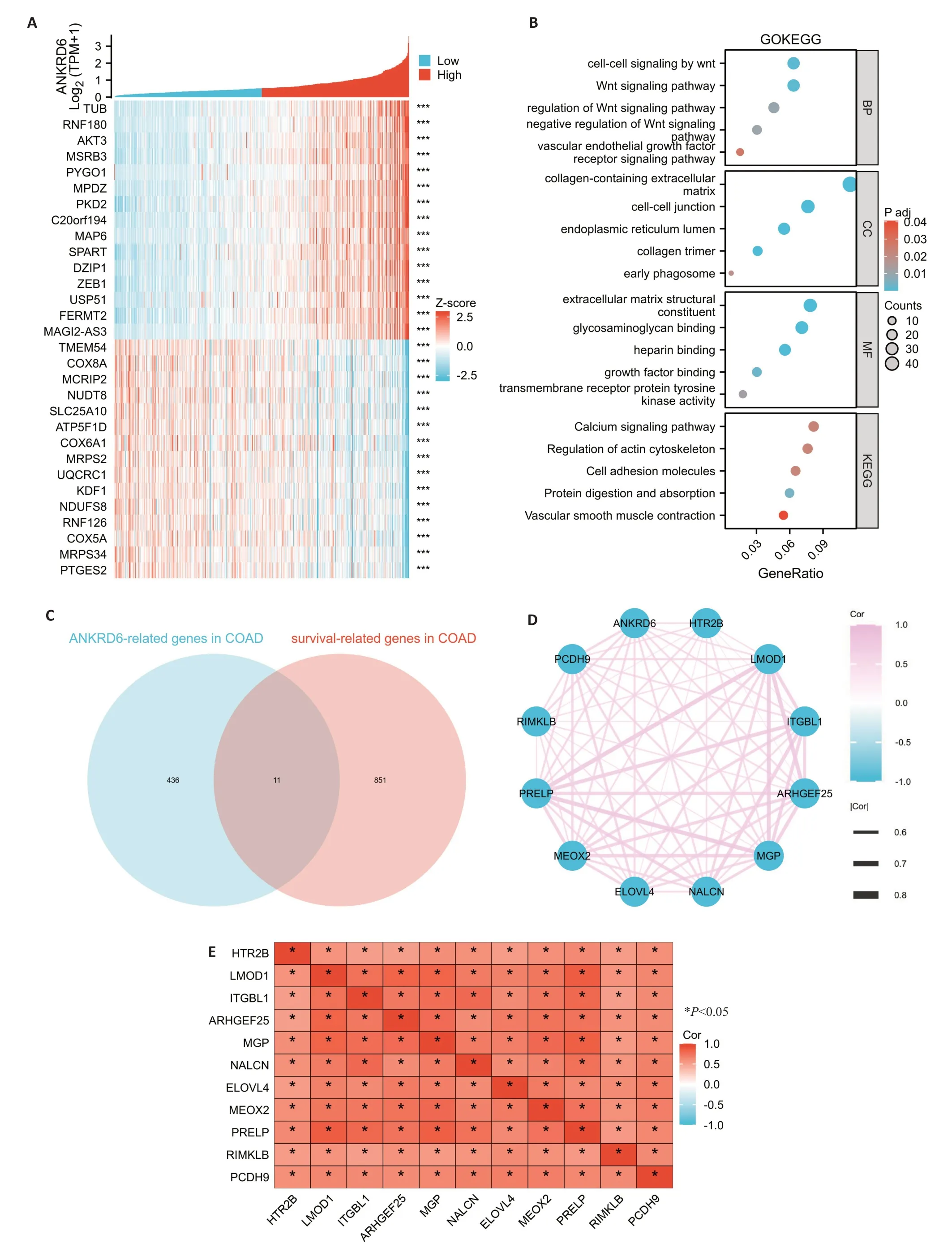
图4 ANKRD6相关基因的功能聚集和相互作用网络分析Fig.4 Functional aggregation and interaction network analysis of ANKRD6-related genes.A: Heat map of the top 30 genes positively(red)and negatively(blue)associated with ANKRD6 in COAD.B:GO and KEGG enrichment analysis of ANKRD6-associated genes in COAD.C:Venn diagram of genes closely associated with ANKRD6 in COAD and genes encoding proteins associated with survival prognosis in COAD.D,E:Network and heat map of the intersecting genes.
2.5 体外评价ANKRD6的功能
敲低的siANKRD6 被用来研究ANKRD6 在COAD细胞系中的功能,使用qRT-PCR和Western blot验证转染效率(图5A、B);流式细胞术检测细胞周期,结果显示,相比对照组,siANKRD6组处于S期的细胞减少、G2/M的细胞减少,处于G1期的细胞增多(P<0.01,图5C);CCK-8的结果显示,与siCtrl组相比siANKRD6组细胞增殖减缓(图5D);细胞迁移和侵袭实验的结果显示,ANKRD6 的敲低后对COAD 细胞系的细胞48 h 迁移率减少和侵袭转移率降低(P<0.05,图5E、F)。
3 讨论
本研究重点是探究ANKRD6在COAD的表达机制、患者预后关系以及其参与COAD细胞增殖、侵袭和转移的机制,同时也探究了ANKRD6对COAD作用的机制,包括其对Wnt信号通路的激活和与免疫浸润细胞的关系。COAD是一种常见的恶性肿瘤,其发展涉及多个基因和通路[21,22]。通过免疫组织化学方法和qRTPCR技术,我们发现ANKRD6在COAD组织和细胞系中显著的高表达。近年来,临床研究表明脉管侵犯和神经侵犯是结肠癌预后不良的重要因素之一[23],但其机制鲜有报道。本研究发现,ANKRD6表达水平与进展期的T、N和stage分期、脉管侵犯和神经侵犯相关,表明ANKRD6可能在COAD的发生和发展中扮演重要的角色。同时,高表达的ANKRD6与COAD患者的总生存期和无疾病间隔均显著降低,进一步验证了以上观点。为进一步验证ANKRD6在COAD细胞系中具有促进细胞增殖、侵袭和转移的功能,本研究敲低了ANKRD6的表达,结果发现细胞周期被阻滞在G1期,导致细胞增殖速率降低,同时细胞迁移和侵袭能力也减弱。以上结果提示ANKRD6在COAD细胞系中是一个重要的促进因子,可能通过影响细胞周期、细胞增殖和侵袭来影响COAD的发展。
Nomogram列线图在预测肿瘤的预后方面具有重要的意义,它通过单变量和多变量Cox回归分析,该模型可以确定与肿瘤OS相关的因素,它将这些因素以图表形式展现出来,为医生和患者提供了一种简单、直观的工具来预测患者的生存期和预后[24]。本研究使用单变量和多变量Cox回归分析,确定了与COAD总生存期相关的因素,结果表明,年龄和肿瘤分期是影响结肠癌患者总体生存期的重要因素。基于上述结果,本研究构建了一个Nomogram列线图预测COAD的预后。列线图的C-index值为0.735,表明该模型具有较高的预测准确性。此外,列线图的Calibration校准曲线表明,在主要参数中实际概率和模型预测的概率之间有良好的拟合性。决策曲线分析显示,基于Nomogram列线图可以有效预测患者的1年、3年和5年生存期的净收益均保持较高的水平。这表明,Nomogram列线图可以作为一种有效的工具来预测COAD患者的预后。
免疫治疗已经成为癌症治疗中的一项重要策略,尤其是抗CTLA-4、PD-1和PD-L1的抗体已经被证明在治疗多种恶性肿瘤中具有显著的疗效[25]。然而,目前对于这些治疗的免疫反应机制以及免疫微环境的生物学特征还存在许多不清楚的地方[26]。对于免疫治疗策略的设计而言,对这些生物学特征的深入研究显得尤为重要[27]。先前研究表明ANKRD6可能在结肠癌的免疫侵袭中发挥特殊作用,尤其是CD4+T细胞、巨噬细胞和DCs 的浸润,与我们研究的部分结果的相同,但ANKRD6在其他免疫细胞中相关性未做报道。本研究使用Spearman相关分析发现,ANKRD6表达与巨噬细胞等多种细胞的浸润水平呈正相关;然而,ANKRD6表达与Th17、NK CD56bright和Th2细胞的浸润水平呈负相关。ANKRD6表达与多种免疫细胞亚群的正相关表明ANKRD6可能在促进免疫细胞在肿瘤微环境中的浸润和激活中起着作用。具体而言,与巨噬细胞的正相关可能表明ANKRD6在促进巨噬细胞浸润和极化为M2型表型中发挥了作用,后者M2巨噬细胞受IL-4、IL-13、IL-10和CSF-1的作用经历选择性激活,并优先分泌抗炎细胞因子,包括转化生长因子β(TGF-β)、IL-10以及蛋白酶(如精氨酸酶-1和MPPs)[28,29]。M2巨噬细胞在限制免疫反应、诱导血管生成和组织修复方面起着关键作用。因此,M2样巨噬细胞的存在与促肿瘤活性相关[30]。另一方面,ANKRD6 表达与Th17、NK CD56bright 和Th2细胞的负相关可能表明ANKRD6在抑制这些免疫细胞亚群的浸润和激活中发挥作用。Th17细胞已被认为促进炎症和肿瘤生长,而NK CD56bright和Th2细胞则与肿瘤微环境中的免疫抑制相关[31]。总体而言,本研究结果表明,ANKRD6可能在COAD的肿瘤微环境中调节免疫细胞的浸润和激活中发挥复杂和动态的作用。需要进一步的研究来阐明这些观察结果的分子机制,并探究在COAD靶向治疗中ANKRD6的潜在临床意义。
为了深入探究ANKRD6在COAD中的生物学功能,我们进行了GOKEGG功能富集分析,结果发现这些基因主要富集在Wnt信号通路、血管内皮生长因子受体信号通路和钙信号通路等关键生物过程和信号通路,有文献证实这些通路与结肠癌密切相关。我们推断ANKRD6在结肠癌症发生和发展过程中发挥着重要的作用,并且可能是通过参与这些关键通路来实现的。本研究进一步对ANKRD6相关基因与COAD生存预后相关的基因进行了交集分析,共获得了11个共同基因,进行相关性分析后显示它们具有显著的关联性,其中ITGBL1是一种整合素结合蛋白,是肿瘤相关基因之一。有研究表明,ITGBL1在多种癌症中的表达水平都显著增高,主要通过调节肿瘤微环境中的血管生成、成纤维细胞激活等因素,从而影响肿瘤的发生和发展[32]。与此同时,ARHGEF25也是一个编码Rho GTP酶激活因子的基因,它在细胞极性、细胞迁移和侵袭、细胞黏附和增殖等生物学过程中也发挥着重要作用[33,34]。这些基因与ANKRD6的相关性暗示了ANKRD6是通过参与免疫微环境生物学过程来促进细胞侵袭和增殖的重要角色。
以上研究均表明ANKRD6 在结肠癌患者中具有预后价值。然而,这项研究存在一些局限性和需要进一步验证的方面。首先,关于ANKRD6 在免疫浸润中起着重要作用,但缺少具体的细胞和方式的数据支持。这意味着虽然已经发现了ANKRD6 的重要性,但并不清楚它是如何在免疫浸润中发挥作用的。因此,需要进一步的研究来确定ANKRD6 在哪些细胞和方式中发挥作用,以更好地理解其作用机制。其次,关于ANKRD6 富集通路缺少细胞和动物模型,需要进一步验证其在人体中的可行性和应用性。虽然已经发现了ANKRD6 富集通路的存在,但需要进行更多的基础实验来验证其功能及可能的机制。这需要在细胞和动物水平上进行实验,并且需要大量的临床数据来验证这些发现是否与患者的预后相关联。
综上所述,本研究说明了ANKRD6在结肠癌中具有重要作用,提供了关于ANKRD6 在结肠癌中的功能及预后的证据,为结肠癌的诊断、寻找潜在治疗靶点、个体化治疗及预后评估提供参考。
- 南方医科大学学报的其它文章
- 高表达分泌颗粒蛋白II增加结直肠癌细胞对奥沙利铂的耐药性
- Neutrophil-lymphocyte and platelet-lymphocyte ratios for assessing disease activity in patients with rheumatoid arthritis receiving tofacitinib treatment
- 淫羊藿素通过调控铁死亡增加鼻咽癌细胞的放射敏感性
- 靶向结直肠癌的小白菊内酯脂质体纳米颗粒诱导程序性坏死并改善T细胞耗竭
- 二甲双胍减轻阿霉素诱导的心脏毒性:基于AMPK通路
- 甲基转移酶样3抑制剂STM2457通过调节线粒体功能改善代谢相关脂肪性肝病