大黄素对胶原诱导性关节炎大鼠的骨保护作用::基于抑制铁死亡和降解基质金属蛋白酶
周思聪,杨 威,曾 丽,曹春浩,袁 速,荣晓凤
重庆医科大学附属第一医院中西医结合科,重庆400016
类风湿关节炎(RA)是一种慢性自身免疫性疾病,主要病理表现为滑膜增生,最终可导致患者关节破坏、功能丧失[1,2]。RA患者的功能丧失主要源于其晚期骨结构损伤[3,4]。近年研究主要集中在成纤维细胞样滑膜细胞(FLS)的增殖、炎症因子对破骨细胞和成骨细胞的影响,破骨细胞和成骨细胞影响骨侵蚀和骨修复的机制,然而,鲜有研究关注铁死亡与RA骨关节结构损伤之间的联系。
铁死亡与诸多疾病的病理过程有明显相关性,例如抑制肿瘤增殖、抑制病毒抗原抗体反应、减少滑膜成纤维细胞的异常增殖和滑膜炎症[5,6]。随着人们逐渐重视铁元素在RA成纤维滑膜细胞和软骨细胞程序性死亡中的作用[7-9]。研究者发现在RA患者和佐剂型关节炎(AA)大鼠的成纤维滑膜细胞和软骨细胞中发生了丰富的铁死亡过程,抑制这一过程已被初步证实能够有效缓解关节损伤[3],然而,目前抑制RA铁死亡以延缓骨破坏的药物仍需进一步研究。在前期研究中我们发现大黄素能有效抑制成纤维滑膜细胞增殖、调控RANKL/OPG等多条信号通路以延缓RA关节结构损伤[10,11],本文将在此基础之上进一步探讨大黄素能否通过干预调节铁死亡来降低基质金属蛋白酶的表达从而抑制RA关节的骨破坏,为大黄素延缓类风湿关节炎骨破坏提供实验依据。
1 材料和方法
1.1 材料
1.1.1 实验试剂Ⅱ型胶原、不完全弗氏佐剂(Chondrex);缩甲基纤维素钠(雷根生物技术有限公司);丙二醛检测试剂盒(南京建成公司);GPX4 蛋白抗体(Abmart);ACSL蛋白抗体、FTH1蛋白抗体、SLC7A11蛋白抗体、GAPDH抗体、山羊抗兔HRP二抗、山羊抗小鼠HRP二抗(abcam)。
1.1.2 实验仪器 超高速离心机(Thermo Fisher);光学显微镜(Zeiss);电泳仪、电转仪器、酶标仪(Bio-Rad);500 μL全玻璃注射器(PEACE);高速匀浆仪(IKA)。
1.1.3 实验药物 大黄素Emo(成都百科通生物科技有限公司);甲氨蝶呤MTX(上海上药信谊药厂有限公司,2.5 mg/粒。
1.1.4 实验动物 SPF 级7~8 周雌性SD 大鼠[批号:SYXK(渝)2018-0003;重庆医科大学动物实验中心],实验经过重庆医科大学附属第一医院伦理委员会批准(动物伦理编号:2022-K296)。
1.2 方法
1.2.1 动物造模与分组 7~8周雌性SD大鼠适应性喂养7 d后,除正常组大鼠10只正常饲养外,40只大鼠用于胶原诱导型关节炎(CIA)大鼠模型CIA造模,将等体积的牛二型胶原(2 mg/mL)和不完全弗氏佐剂在冰水浴中使用高速匀浆仪混合均匀,至乳滴不能在水中扩散后,每只大鼠尾静脉注射200 μL乳液。7 d后对动物进行二次免疫,步骤同前。21 d后,按照关节炎评分标准筛选造模成功的大鼠,分为CIA模型(Model)组10只(相应剂量CMC-Na灌胃)、甲氨蝶呤(MTX,0.2 mg/kg,3 次/周)组10只、低剂量大黄素(Emo,40 mg·kg-1·d-1)组10只、高剂量大黄素(Emo,80 mg·kg-1·d-1)组10只,常规称重,给药21 d后,采用戊巴比妥麻醉于腹主动脉处取血,离心后得血清于-80 ℃冻存;脱颈处死后取左膝关节和左踝关节于-80 ℃冻存,右膝关节和右踝关节于4%多聚甲醛固定。
1.2.2 关节病变评估 从第1次免疫之后每日采用0~4级关节评分法进行大鼠关节病变评分。后肢关节肿胀程度评分按照以下标准:0分,无肿胀和泛红;1分,轻度肿胀或者泛红;2分,中度肿胀和泛红同时存在;3分,严重肿胀和泛红同时存在;4分,严重肿胀和泛红,并且出现关节僵硬和活动明显受限。
1.2.3 大鼠足趾肿胀度测量 使用足容积排水法测量大鼠踝关节及以下部位的体积。在第1次免疫前和在免疫后的每2 d进行1次踝关节和足趾体积测量。
1.2.4 踝关节组织病理学HE染色 取材后将踝关节脱钙石蜡固定至脱水:依次将切片放入环保透明剂(1)和(2),每次浸泡10 min;依次浸泡无水乙醇、95%乙醇、75乙醇各5 min,蒸馏水冲洗。再用苏木精染色液(Harris)染色4 min,蒸馏水冲洗2 min,1%盐酸乙醇分化,蒸馏水冲洗,稀碳酸锂水溶液返蓝后蒸馏水冲洗2 min加入伊红染液浸泡30 s,无水乙醇中脱色2 min,最后封片固定用光学显微镜采集图像后分析。
1.2.5 踝关节组织病理学番红固绿染色 Weigert苏木精染色5 min,蒸馏水冲洗后,1%盐酸酒精分化1 s,蒸馏水冲洗5 min,固绿染液滴染5 min,水洗去多余染液直至镜下观察软骨无色,番红O染液滴染3 min,倾去多余染液,在4份无水乙醇中分化5 s、2 s、5 s,快速风干后,置二甲苯透明3 min,中性树胶封片固定用光学显微镜采集图像后分析。
1.2.6 踝关节免疫组织化学染色 将各组大鼠踝关节切片放入干燥箱内,66 ℃烤片30 min,二甲苯脱蜡,梯度乙醇水化,柠檬酸盐修复液加热2 min抗原高压修复。在5% BSA 中封闭30 min,在37 ℃孵育GABA 一抗(1∶100)60 min,蒸馏水冲洗之后孵育二抗(1∶100)孵育30 min,蒸馏水冲洗。滴加DAB显色剂,碳酸锂溶液蓝化30 s,漂洗,脱水封片。随机选取不同组大鼠踝关节切片在光学显微镜下观察关节MMP3和MMP13表达情况。
1.2.7 丙二醛含量试剂盒检测脂质过氧化水平 取膝关节软骨组织在液氮中切成小块后置于匀浆管中,加入适当RIPA裂解液后低速匀浆,将匀浆后对液体离心取上清,使用TBA法检测丙二醛(MDA)的含量。标准曲线样本制备和试剂加样实验步骤参照试剂盒说明书进行,使用酶标仪检测各样本吸光度。
1.2.8 免疫蛋白印记试验检测关键蛋白 在冰上用RIPA裂解缓冲液裂解踝关节,并使用蛋白质分析试剂盒以牛血清白蛋白(BSA)为标准测定蛋白质含量。每个样品在十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDSPAGE)凝胶上分离,然后转移到硝化纤维素膜上。用QuickBlock 拦截后封闭缓冲液(Beyotime Biotechnology)封闭,然后在4 ℃条件下,将相应的膜与抗ACSL4 抗体(1∶10 000,abcam)、SLC7A11(1∶1000,abcam)、GPX4(1∶500,abmart)、FTH(1∶1000,abcam)、GAPDH(1∶10 000,abcam)一级抗体分别一起孵育过夜。在用Tris缓冲盐水(TBS)洗涤膜5 min,3 次后,添加适当的辣根过氧化物酶(HRP)结合的山羊抗小鼠和山羊抗兔二级抗体(1∶1000,abcam)孵育2 h。通过增强化学发光(ECL)试剂检测蛋白质。通过图像进行蛋白质水平半定量统计
1.2.9 统计学分析 采用GraphPad Prism 9.0对实验结果进行分析,计量资料采用均数±标准差表示。所有实验进行3次独立重复,所得实验数据均满足参数检验标准,多组间比较采用单因素方差分析。动物实验中样本计算的检验效能power=0.9,计算得出最小样本量为9。采用双侧检验,P<0.05认为差异具有统计学意义。
2 结果
2.1 各组大鼠足趾体积和AI指数情况
Model组大鼠足趾均有不同程度的红肿变形、皮温升高,AI评分大于4分,部分大鼠出现关节畸形、行动障碍;与Model组相比,MTX组和Emo高低剂量组关节红肿减轻,足趾体积和AI指数明显降低,少见关节畸形和行动障碍;与MTX组相比,Emo高低剂量组的AI指数降低更明显,少见关节畸形;与Emo低剂量组相比,Emo高剂量组大鼠关节红肿减轻更明显,足趾体积和AI指数降低,未见明显关节畸形和行动障碍(图1)。
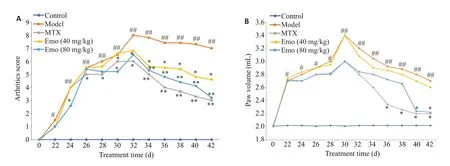
图1 各组大鼠足趾体积和AI指数情况Fig.1 Effects of emodin on severity of arthritis in collagen-induced arthritis(CIA)rats.A:Arthritis score index of the rats.B:Rat paw volume.Data are presented as Mean±SE and analyzed using one-way ANOVA followed by ANOVA test.#P<0.05,##P<0.01 vs control group;*P<0.05,**P<0.01 vs Model group.
2.2 各组大鼠踝关节软骨病理变化情况
HE染色和番红固绿染色显示,Normal组大鼠踝关节结构完整,表面平滑,软骨细胞排列整齐,关节腔未见成纤维滑膜细胞增殖侵袭,未见炎症细胞浸润;Model组大鼠踝关节表面粗糙有明显破损,软骨细胞丢失排列紊乱,关节腔有成纤维滑膜细胞和炎症细胞浸润;MTX组大鼠踝关节表面有粗糙和破损,滑膜增生不厚,未见炎症细胞浸润;Emo低剂量组大鼠踝关节表面稍有粗糙和磨损,滑膜增生不明显,有少量炎症细胞浸润;Emo高剂量组大鼠踝关节软骨表面极少见粗糙和磨损,滑膜增生不明显,有极少量炎症细胞浸润(图2)。
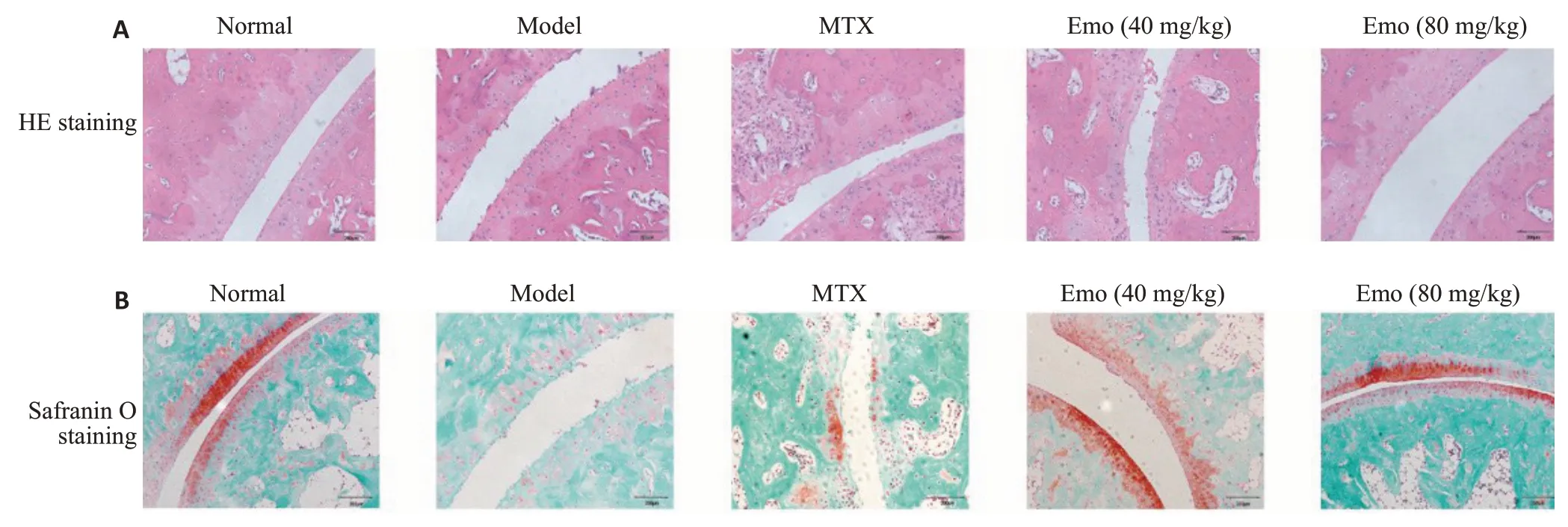
图2 各组大鼠踝关节病理学改变情况Fig.2 Effect of emodin on ankle cartilage destruction in CIA rats assessed by HE staining (A) and Safranin O staining (B)(Original magnification:×100,Scale bar=200 μm).
2.3 各组大鼠踝关节MMP3和MMP13表达情况
免疫组织化学检测结果显示,与Normal组相比,Model组大鼠踝关节MMP3和MMP13的蛋白表达含量明显增多;与Model组相比,MTX组和Emo各剂量组MMP3和MMP13的蛋白表达含量均明显降低;Emo各剂量组均优于MTX组,其中Emo高剂量组优于Emo低剂量组,差异有统计学意义(P<0.05,图3)。
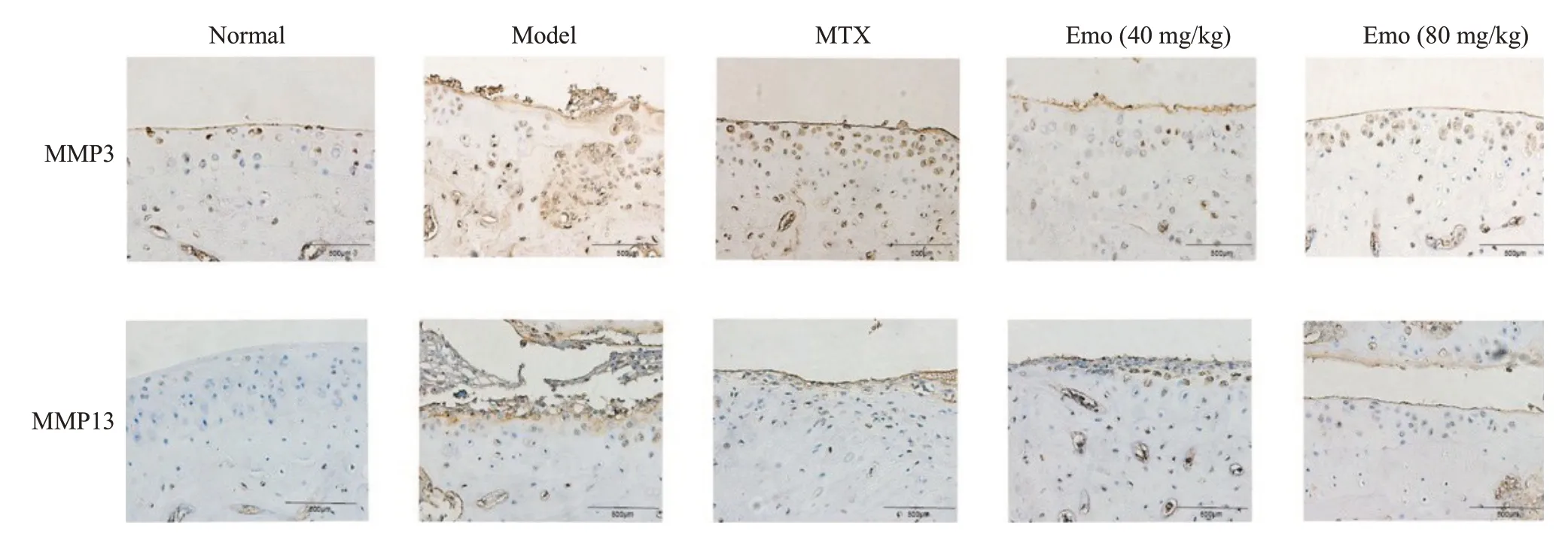
图3 各组大鼠踝关节MMP3和MMP3表达情况Fig.3 Immunohistochemical staining for detecting the expressions of MMP3 and MMP3 in the ankle joints of the rats in each group(×200,Scale bar=500 μm).
2.4 各组大鼠膝关节脂质过氧化水平情况
丙二醛含量试剂盒检测结果显示,与Normal组相比,Model 组的MDA 含量明显升高(P<0.001);与Model组相比,MTX组、Emo各剂量组的含量均明显降低(P<0.05);与MTX组相比,Emo各剂量组变化相当(P>0.05);与Emo低剂量组相比,Emo高剂量组降低明显,差异有统计学意义(P<0.05,图4)。
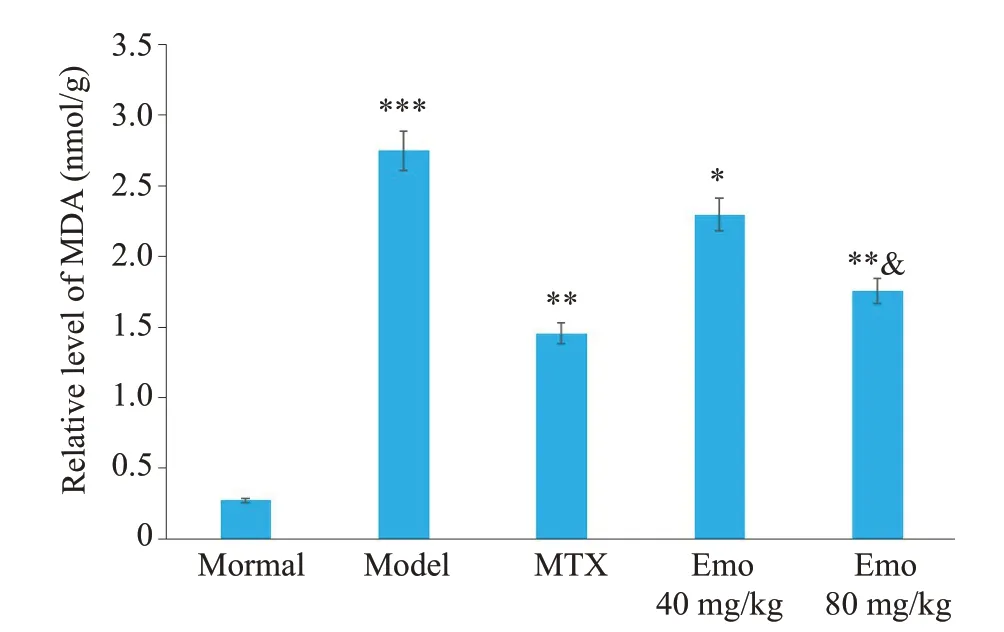
图4 各组大鼠膝关节脂质过氧化水平情况Fig.4 Malondialdehyde(MDA)content kits detect lipid peroxidation levels (Mean±SE).***P<0.01 vs normal group;*P<0.05,**P<0.01 vs Model group;&P<0.05 vs Emo 40 mg/kg group.
2.5 各组大鼠铁死亡相关信号通路蛋白表达情况
Western blotting法检测结果显示,与Normal组相比,Model组的ACSL4含量明显升高,SLC7A11、GPX4、FTH1含量明显降低(P<0.05);与Model组相比,MTX组ACSL4含量降低,SLC7A11含量升高(P<0.05),Emo高剂量组的ACSL4含量降低,SLC7A11、GPX4、FTH1的表达显著升高(P<0.05);与MTX组相比,Emo高剂量组ACSL4含量明显降低,SLC7A11、GPX4、FTH1含量明显升高(P<0.05),差异有统计学意义(图5)。
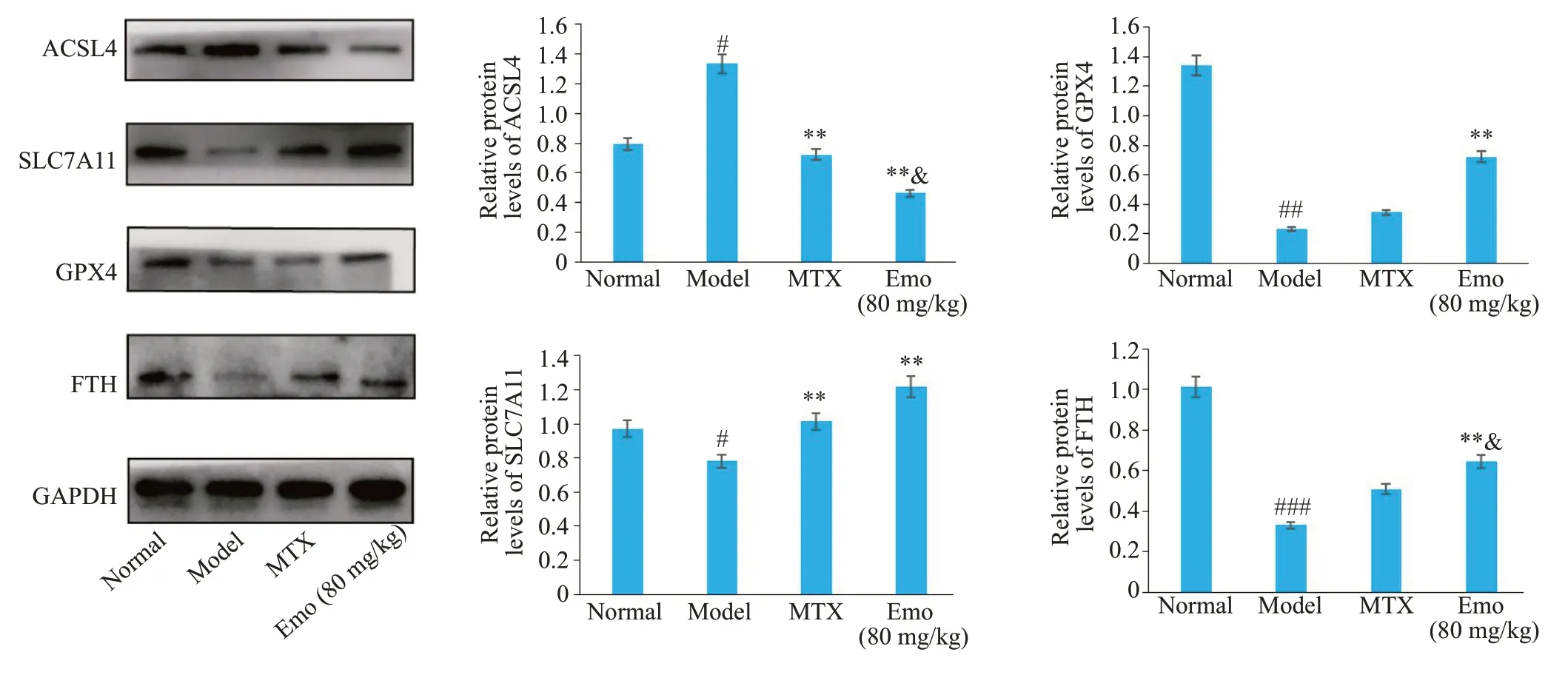
图5 各组大鼠踝关节铁死亡相关信号通路蛋白的表达Fig.5 Western blotting for detecting protein expressions of ACSL4,SLC7A11,GPX4 and FTH1(Mean±SE).#P<0.05,##P<0.01,###P<0.001 vs normal group;*P<0.05,**P<0.01 vs Model group;&P<0.05 vs MTX group.
3 讨论
RA是一种慢性炎症性自身免疫性疾病,常累及多关节,致残率高。其主要病理表现为滑膜炎症和关节结构损伤[3,4],发病原因和机制尚未完全清楚。
铁死亡是一种以脂质过氧化为主要特征的铁依赖性非经典程序性死亡形式,其触发方式主要包括激活GSH/GPX4 途径、甲羟戊酸(MVA)途径和铁积累途径[10]。有研究显示在RA患者的血清、滑膜和软骨中都发现了铁死亡相关指标ROS和脂质过氧化物水平的升高[11];而过量的ROS会进一步刺激炎症反应[12],炎症产生的自由基会通过诱导MMP的活化,从而降解关节聚集蛋白多糖,最终导致软骨破坏和骨侵蚀。其中MMP3可以直接降解无滑膜覆盖的软骨和骨成分[13];MMP13存在于RA患者的软骨和滑膜液中,是降解II型胶原蛋白、多聚蛋白聚糖等细胞外基质的主要蛋白酶,MMP13还可以促进滑膜炎症,诱导滑膜增生,导致单核细胞浸润从而加重RA炎症反应和骨破坏[14]。在骨关节炎的关节腔中注射铁死亡发生抑制剂可以延缓退行性骨破坏的进展[15,16],但目前仍没有发现可以靶向阻断RA软骨细胞铁死亡的药物。
我们临床遴选的复方大黄散用于RA急性期可有效减轻关节肿胀疼痛,降低患者血清RANKL水平[12-14]。方中君药大黄的主要成分大黄素(1,3,8-三羟基-6-甲基蒽醌),是一种天然蒽醌类衍生物[17],可以抑制细胞生长活性,诱导凋亡,具有抗肿瘤、解痉、止咳、利尿等作用[17]。虽然大量研究证明了大黄素在RA治疗中有抑制MAPK和NF-κB等炎症通路的作用[18-20],但尚未证实大黄素对RA骨破坏是否有抑制作用,故本研究进一步探讨明确大黄素基于抑制铁死亡同时降解基质金属蛋白酶对RA骨保护作用的机制。
本研究结果显示,CIA大鼠足趾红肿,组织病理显示踝关节表面粗糙有明显破损,软骨细胞丢失、排列紊乱、关节腔有成纤维滑膜细胞和炎症细胞浸润;关节软骨组织的MMP3、MMP13和MDA表达含量显著升高,同时ACSL4含量升高,SLC7A11、GPX4、FTH1含量降低。表明RA大鼠受自由基攻击程度提高,通过提高ACSL4含量,促进多不饱和脂肪酸发生脂质过氧化,合成易被氧化的磷脂酰乙醇胺和磷脂酰肌醇,促进铁死亡发生[21];抑制System XC-信号通路,降低FTH1含量,释放Fe2+,导致脂质过氧化程度加重[22],MDA产生增多[23]。抑制SLC7A11摄取导致下游还原型谷胱甘肽(reduced glutathione,GSH)耗竭,GPX4活性降低、细胞抗氧化能力降低、活性氧(reactive oxygen species,ROS)含量增高诱导铁死亡[24]。铁死亡过程中过量ROS诱导MMP3、MMP13的活化,进而抑制软骨蛋白聚糖的产生[25],促进软骨细胞凋亡,引起关节骨侵蚀性破坏。
大黄素(Emo)干预后,大鼠的踝关节炎症明显减轻,病理显示骨与软骨表面极少见粗糙和磨损、滑膜增生不明显、极少量炎症细胞浸润,优于甲氨蝶呤组,且80 mg/kg组效果优于40 mg/kg组。课题组前期实验结果显示,大黄素能抑制RA大鼠IL-1β、MMP10、TNF-α等多种细胞因子表达[26,27]、抑制RA 成纤维滑膜细胞ERK1/2、p38MAPK、NF-κB等信号通路[28,29],表明Emo对RA有明确的炎症抑制和骨保护作用。Emo干预后大鼠踝关节软骨组织的MMP3、MMP13、MDA 和ACSL4表达含量明显降低,SLC7A11、GPX4、FTH1含量明显升高,说明其机制可能与抑制关节骨组织铁死亡信号通路、减轻脂质过氧化过程、降低基质金属蛋白酶的产生相关。因此降低铁死亡过程中脂质过氧化程度有利于关节炎症的控制,关节结构损伤的改善。
综上所述,我们检测证实了RA的软骨组织中存在铁死亡生物过程,这可能与关节组织中ACSL4表达的增高抑制了System XC-信号通路,从而降低了FTH1的表达,导致脂质的过氧化相关。同时铁死亡过程诱导激活了MMP的过度活化,驱动关节炎症进展,促进了RA骨破坏的发生。大黄素可以明显减轻CIA大鼠关节炎症、改善关节骨侵蚀,起到了骨保护作用,其机制可能与抑制CIA大鼠踝关节骨组织铁死亡信号通路,减轻脂质过氧化过程,降低基质金属蛋白酶的产生相关。这可能是RA未来治疗的新策略之一。
- 南方医科大学学报的其它文章
- 高表达分泌颗粒蛋白II增加结直肠癌细胞对奥沙利铂的耐药性
- Neutrophil-lymphocyte and platelet-lymphocyte ratios for assessing disease activity in patients with rheumatoid arthritis receiving tofacitinib treatment
- 淫羊藿素通过调控铁死亡增加鼻咽癌细胞的放射敏感性
- 靶向结直肠癌的小白菊内酯脂质体纳米颗粒诱导程序性坏死并改善T细胞耗竭
- 二甲双胍减轻阿霉素诱导的心脏毒性:基于AMPK通路
- 甲基转移酶样3抑制剂STM2457通过调节线粒体功能改善代谢相关脂肪性肝病