β-羟基丁酸抑制肺腺癌细胞增殖、迁移及侵袭的作用机制
黄云龙,朱玉峰,石 瑾,刘 蓉,曾 婷,韩良辅
1佛山复星禅诚医院肿瘤中心,广东 佛山 528041;2南方医科大学南方医院,广东 广州510515
近年来,癌症的发病数和死亡数呈逐年递增趋势,其中肺癌的发病数和死亡数均居所有癌症之首[1]。临床上将肺癌分为小细胞肺癌和非小细胞肺癌,约85%的肺癌都属于非小细胞肺癌,其中肺腺癌的发病率最高,占所有类型肺癌的40%以上[2]。肺腺癌一般采用化疗进行治疗,然而,肺腺癌容易对化疗药产生耐药性,限制了化疗在肺腺癌中的应用[3]。靶向药治疗肺腺癌近年得到较大的发展[4],但其高昂的价格也限制了使用。目前已有很多临床前研究表明生酮饮食(KD)可以抑制多种癌症,涉及的机制包括调控Warburg 效应、炎症、MMP-9、组蛋白乙酰化、糖酵解,抑制p53突变以及激活AMPK途径[5,6]。有研究报道KD可抑制小鼠肺癌细胞增殖并增强对化疗药物的敏感性,但也有其他学者通过临床研究指出KD并不能改善肺癌患者的预后,其可能原因是肺癌患者对KD治疗方案的依从性差[7-10]。同时,由于KD是一种饮食方式,在不同的肿瘤环境下,KD发挥作用的成分和机制可能不同。因此,探索KD饮食发挥抗肿瘤作用的小分子化合物及其具体作用机制,发现用于治疗肺癌的新药物,有助于解决KD直接用于临床肺癌治疗的局限性。
β-羟基丁酸(BHB)是长时间运动、饥饿或缺乏碳水化合物的情况下,葡萄糖的供应不足以满足身体的能量需求时,在肝脏肿由脂肪酸合成并从肝脏向外周组织输送能量的基本载体。有研究指出KD的摄入能明显提升血液中BHB的浓度[11]。有临床研究表明,KD提高了放疗患者的空腹BHB浓度,也改善了患者身体组分和生活质量[12]。这提示BHB可能是KD发挥抗肿瘤作用的小分子化合物。
GPR109A是一种G蛋白偶联受体,被报导可作为BHB的受体被激活,进一步上调抑癌基因Hopx的表达,发挥抑制结肠癌进展的作用[13,14]。有研究指出,KD或者BHB可通过GPR109A激活巨噬细胞的神经保护亚群发挥了神经保护的作用[15]。这提示BHB 和GPR109A之间密切的联系,但目前BHB与GPR109A在肺癌中的作用还未有报道,因此本研究尝试探究BHB对肺腺癌A549细胞的作用及其调控机制,为BHB的临床应用和肺癌治疗提供理论依据。
1 材料和方法
1.1 材料
人肺腺癌细胞A549,小鼠肺癌细胞LLC,F-12K培养基,LLC 细胞专用培养基(普诺赛);胎牛血清(Gibco);BHB(MACKLIN);EdU 细胞增殖检测试剂盒,CCK-8 试剂盒(碧云天生物);Transwell 小室,Matrigel基质胶(Corning);BCA蛋白定量试剂盒(碧云天生物);GPR109A一抗、β actin 一抗、HRP标记二抗(Thermo Fisher)。
1.2 方法
1.2.1 细胞培养 本研究选择肺腺癌细胞系A549 和LLC(普诺赛),A549细胞所用培养基为含10%胎牛血清的F-12K培养基,LLC细胞使用专用培养基,培养温度为37 ℃,培养箱气体为95%的空气和5%的CO2。
1.2.2 细胞增殖测定 取处于对数期的A549 细胞或LLC细胞,以2×105/孔接种于6孔板,细胞贴壁后饥饿4 h,分组设置为0、5、10 mmol/L 3组,0 mmol/L组加入PBS,其他两组分别加入5、10 mmol/L 的BHB 处理,36 h后按照试剂说明书进行孵育、固定、通透、洗涤、染色和荧光检测。
1.2.3 细胞活性测定 取生长状态良好的细胞制备成一定浓度的细胞悬液,100 μL/孔加入96孔细胞培养板中,细胞数目为8000/孔。37 ℃培养箱培养3 h使细胞贴壁,然后加入不同浓度(0、5、10 mmol/L)的BHB处理,处理后不同时间点(0、1、2、3 d)取细胞进行后续实验。取10 μL CCK-8溶液加入96孔细胞培养板,在37 ℃培养箱中继续孵育2 h,然后测定波长的吸光度A490nm。
1.2.4 细胞迁移测定 培养板接种细胞前先用marker笔在6孔板背面画横线标记。细胞消化后以5×105/孔种入6孔板,待细胞铺满板底后,用10 μL枪头垂直于孔板建立细胞划痕,尽量保证各个划痕宽度一致。用PBS清洗干净游离细胞,然后分别加入0、5、10 mmol/L的BHB,拍照记录,然后将培养板放入培养箱培养,36 h时拍照记录细胞迁移情况,计算细胞的迁移距离,计算公式为:细胞迁移距离=0 h划痕宽度-36 h划痕宽度。
1.2.5 细胞侵袭测定 对数期细胞在含有10%FBS的培养基中培养2~3代,待细胞汇合达到80%左右,饥饿处理24 h。铺胶:4 ℃溶解基质胶过夜;4 ℃预冷小室、培养板和枪头;在4 ℃用无血清的冷培养基稀释基质胶,加入到小室的上层,铺匀在膜上;立即将铺好的基质胶的细胞小室至于培养板中,37 ℃孵育1 h。细胞用PBS清洗1次,胰酶消化,然后用含5%BSA的无血清培养基中和,1500 r/min离心10 min。用无血清培养基重悬细胞,调整细胞密度。取上述细胞液加入小室,下室加入含有10%FBS的培养基。37 ℃孵育48 h。孵育结束后,小心去除细胞小室,吸掉上层培养液,PBS清洗1次,4%多聚甲醛固定5 min,0.5%结晶紫染色20 min。PBS洗掉多余染料,立即用棉签擦去滤膜上层的细胞,室温静置风干,显微镜下观察滤膜下层的细胞,随机选取不同的视野计数并算均值。
1.2.6 GEPIA2在线分析 利用GEPIA2在线工具(http://gepia2.cancer-pku.cn/#index)对肺腺癌(LUAD)的数据集进行GPR109A表达差异分析。
1.2.7 RT-PCR 样品用1 mL冰PBS洗1次,加入1 mL Trizol,室温静置20 min。加入0.2 mL氯仿混匀,室温静置5 min,4 ℃,12 000g离心15 min,取上清(约60%体积),加入0.5 mL异丙醇,混匀,室温静置10 min,4 ℃,12 000g离心10 min,弃上清,加入1 mL75%乙醇,混匀,4 ℃,12 000g离心5 min,弃上清,室温下干燥10 min。加10 μL DEPC水溶解RNA,进行核酸定量,判断RNA纯度,并计算逆转录cDNA时所需RNA体积,在20 μL反应体系中RNA的总量为2 μg。根据说明书,取逆转录好cDNA 2 μL在冰上避光加入事先已经配好的Sybr反应体系中,放入real time PCR 仪,95 ℃30 s 预变性,95 ℃变性5 s,退火30 s,共40个循环,检查融合曲线,再根据Ct值计算GPR109A的相对表达量,以β-actin作为内参(人GPR109A 引物Forward:ATGTTGGCTATG AACCGCCAG,Reverse:GCTGCTGTCCGATTGGA GA;人β-actin 引物Forword:CATGTACGTTGCTAT CCAGGC,Reverse:CTCCTTAATGTCACGCACGAT;小鼠GPR109A 引物Forward:CTGGAGGTTCGGAG GCATC,Reverse:TCGCCATTTTTGGTCATCATG T;小鼠β-actin 引物Forword:GGCTGTATTCCCCTCC ATCG,Reverse:CCAGTTGGTAACAATGCCAT GT)。
1.2.8 Western blot检测 提取细胞蛋白质,离心后的上清蛋白用BCA法定量后,使每个加样孔道中蛋白量为50 μg。每个蛋白样品加入5×上样缓冲液(4:1,v/v),95~100 ℃煮5 min,离心混匀,上样,进行SDS-PAGE 电泳。卸下分离胶覆上PVDF膜电转。电转后浸于1%TBST溶解的5%脱脂奶粉中室温缓慢摇动封闭1 h;封闭完成将膜置于一定稀释比例的特异性一抗在室温缓慢摇动1 h,放入4 ℃冰箱过夜。室温平衡30 min后用1%TBST洗脱5 min,洗3次。将膜放入HRP标记二抗中室温缓慢摇动孵育1 h,1%TBST 洗脱10 min,洗3次。取ECL试剂盒中的发光底物溶液和增强剂溶液(1×)各0.5 mL,混匀后加入膜上作用1~3 min,于ECL成像系统成像,结果用ImageJ软件进行分析。
1.2.9 细胞转染与筛选 GPR109A的shRNA质粒委托吉玛基因构建。为扩增质粒,将10 μL甘油原菌接种到50 mL加氨苄西林(1∶1000稀释)的LB培养基中。转速240 r/min,温度37 ℃,培养14~16 h。在大肠杆菌DH5a中扩增并使用质粒Midi试剂盒纯化质粒。通过测定280和260 nm处的紫外吸收度来确定浓度和纯度。所有质粒的A260/A280比值均为1.9~2.0。转染前24 h 将750W 细胞置于15 cm 板中,使转染时细胞融合达到70%~90%。准备两个5 mL 无菌试管,标记DNA 和PEI。将50 μg DNA稀释到2 mL PBS中,150 μL PEI原液稀释到2 mL PBS中。一次将稀释的PEI加入稀释的DNA中,然后通过轻轻地上下移液两3次将溶液混合。室温孵育15~30 min,使PEI/DNA复合物形成。轻轻滴加2 mL PEI/DNA复合物至培养皿中的细胞。轻轻搅拌混合,在37 ℃5%CO2培养箱中孵育3~6 h。转染后,除去带有PEI/DNA复合物的旧培养基,每盘加入20 mL新鲜完全培养基。在37 ℃5%CO2的培养箱中孵育1夜。收取细胞用于后续实验。
1.2.10 IC50测定 取状态良好的细胞接种于96孔板,于37 ℃、含5%CO2空气及100%湿度的培养箱中培养24 h。细胞贴壁后分别加入0、5、10、20、40、80 mmol/L的BHB处理。在培养箱中继续培养24 h后,每孔加入10 μL CCK-8溶液,继续在培养箱中孵育4 h,最后用酶标仪测定450 nm处的吸光度A,用Graphpad Prism 8软件计算IC50。
1.2.11 异种移植实验 选取5~6周龄的裸鼠12只适应性饲养1周后,随机分为3组:Control组、BHB组、sh-GPR109A+BHB组,6只/组,Control组和BHB组在右腋皮下接种A549细胞,sh-GPR109A+BHB组接种敲低GPR109A 的A549 细胞。取LLC 细胞和敲低GPR109A的LLC细胞以同样的分组在免疫系统正常的balb/c小鼠中进行异种移植瘤实验。细胞接种当天为D0,D0开始,BHB组和GPR109A+BHB组小鼠灌胃给予BHB[80 mg/(d·只)]连续21 d,Control组灌胃给予同体积无菌水。分别于第9、12、15、18、21天用游标卡尺测量每个小鼠的肿瘤大小,21 d时处死动物,取皮下肿瘤拍照、称重、测量并计算肿瘤体积。肿瘤体积计算公式:体积=(长径×短径2)/2。本研究通过南方医院实验动物伦理委员会审查(批号:IACUC-PROJECT-20220624-002)。
1.3 统计学分析
所有数据采用Graphpad Prism 软件统计分析。计量资料以均数±标准差表示,两组之间比较采用独立样本t检验,多组之间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 BHB抑制A549细胞和LLC细胞的增殖、迁移以及侵袭
经过不同浓度的BHB处理A549细胞后,EdU染色结果显示,与对照组相比,5 mmol/L和10 mmol/L BHB处理能抑制A549细胞的增殖,且10 mmol/L BHB处理的抑制效果更为显著(图1A、B,P<0.001)。CCK-8结果显示,BHB以浓度依赖方式降低A459细胞活性(图1C,P<0.001)。同样的处理在LLC细胞中产生了一致结果(图1D~F,P<0.01)。BHB处理同样抑制了A459细胞和LLC细胞的迁移和侵袭,且高浓度BHB处理对A549细胞的抑制效果更显著(图1G~N,P<0.001)。
2.2 BHB可上调A549细胞和LLC细胞中GPR109A的表达
在GEPIA2 数据库中对肺腺癌的数据集进行GPR109A表达差异分析中发现,GPR109A在肺腺癌病人中的表达显下调(图2A,P<0.01)。利用A549细胞在体外进行验证,结果显示在用不同浓度的BHB处理A549细胞后,细胞中GPR109A的mRNA和蛋白表达水平均随BHB浓度升高而上升(图2B~D,P<0.01)。类似结果也在LLC细胞中得到证实(图2E~G,P<0.01)。
2.3 BHB 部分通过介导GPR109A 抑制A549 细胞和LLC细胞的增殖、迁移和侵袭
PCR和Western blot结果显示,GPR109A表达量明显降低,GPR109A 被成功敲低(图3A、B,P<0.001)。CCK-8 结果显示在敲低GPR109A 后,A549 细胞对BHB的IC50高于对照组(图3C,P<0.05)。跟前述结果一致,在sh-NC转染的A549细胞中,BHB能抑制细胞增殖、迁移和侵袭的能力(图3D~F,sh-NCvssh-NC+BHB,P<0.001)。当在A549细胞中敲低GPR109A后,BHB对A549细胞增殖,迁移和侵袭的能力的抑制作用被减弱(图3D~F,sh-GPR109A#3vssh-GPR109A#3+BHB,P<0.01)。在LLC细胞中重复这些实验也得到相一致的结果(图4A~F,P<0.05)。
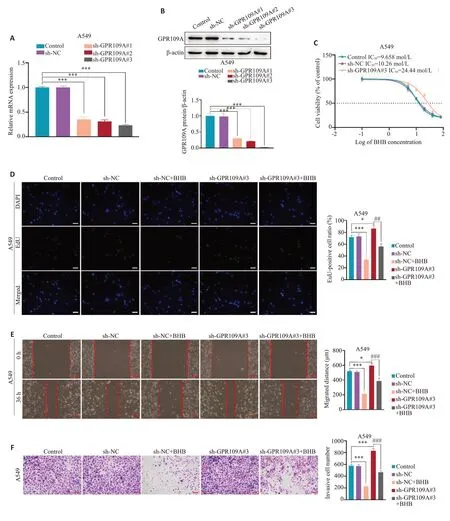
图3 BHB对A549细胞的抑制作用是由GPR109A部分介导的Fig.3 Inhibitory effects of BHB on A549 cells are partly mediated by GPR109A.A,B:Transfection efficiency of shRNA evaluated using RT-qPCR and Western blotting.C: Viability of A549 cells with GPR109A knockdown evaluated using CCK-8 assay to determine the IC50 of BHB.D:EdU assay for detecting changes in BHB-induced inhibition of cell proliferation.E:Scratch assay for detecting changes in BHB-induced inhibition of cell migration;F: Transwell assay for detecting changes in BHB-induced inhibition of cell migration.Scale bar:100 μm;*P<0.05,***P<0.001;##P<0.01,###P<0.001.
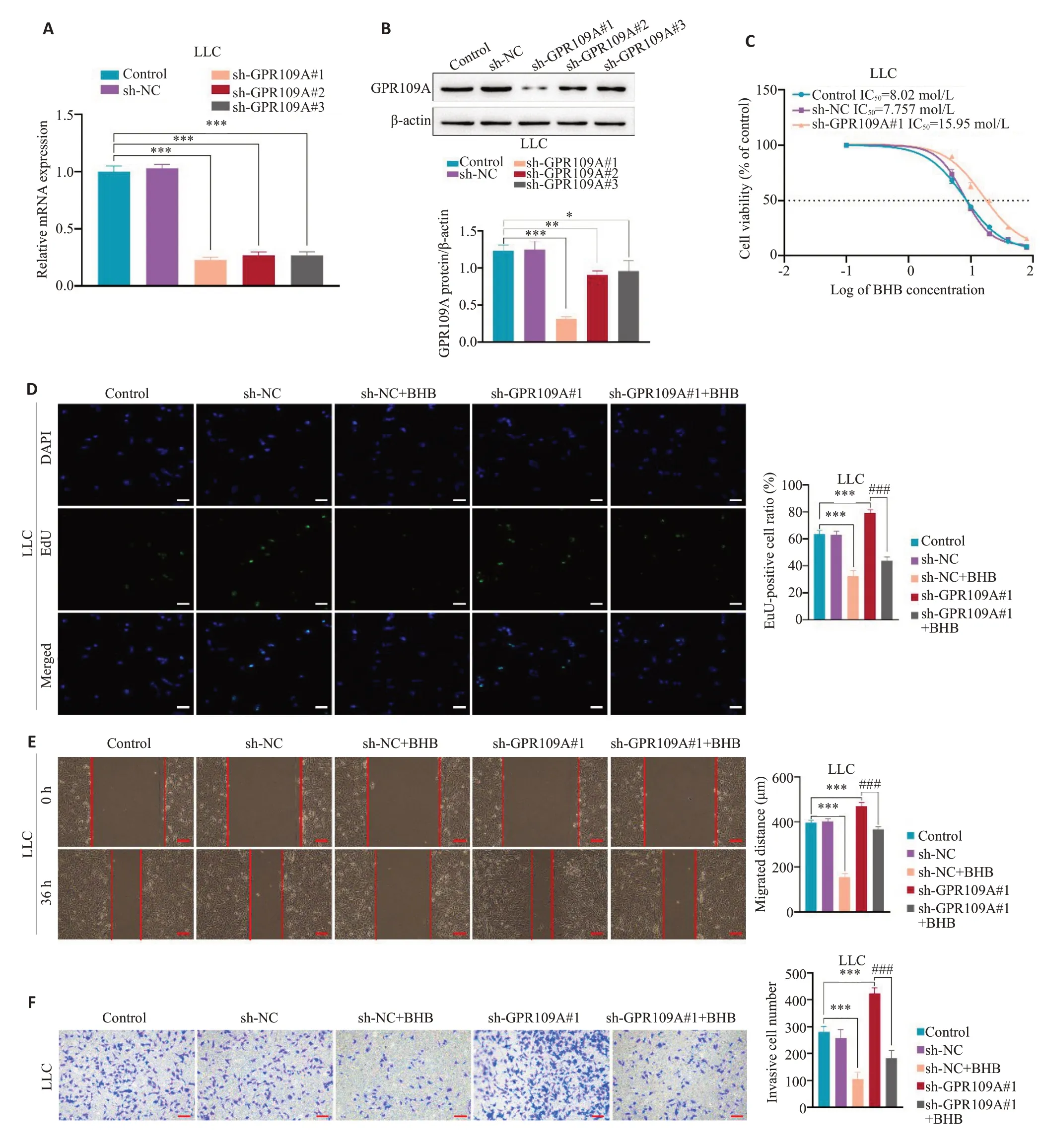
图4 BHB对LLC细胞的抑制作用是由GPR109A部分介导的Fig.4 GPR109A partly mediates the inhibitory effects of BHB on LLC cells.A,B:Transfection efficiency of shRNA evaluated using RT-qPCR and Western blotting.C:CCK-8 assay for determining viability of LLC cells with GPR109A knockdown to calculate the IC50 of BHB.D: EdU assay for detecting changes in inhibitory effect of BHB on cell proliferation.E: Scratch assay for detecting changes in inhibitory effect of BHB on cell migration.F: Transwell assay for detecting changes in inhibitory effect of BHB on cell migration.Scale bar:100 μm;*P<0.05,**P<0.01,***P<0.001;###P<0.001.
2.4 BHB抑制小鼠体内的肿瘤生长
本研究构建了A549细胞裸鼠异种移植模型,进一步验证BHB的体内抗肿瘤作用。结果显示,在第21天时,BHB组的小鼠体内肿瘤质量和体积均明显小于对照组(图5A~C,P<0.05),而sh-GPR109A+BHB组小鼠肿瘤质量和体积与对照组差异无统计学意义(图5A~C,P>0.05)。BHB 组小鼠肿瘤中GPR109A 的mRNA 和蛋白表达量也均低于对照组(图5D~F,P<0.05),但sh-GPR109A+BHB组小鼠与BHB组小鼠的GPR109A表达量无明显差异(图5D~F,P>0.05)。由于BHB可能会对机体免疫系统产生影响,本研究进一步利用免疫系统正常的balb/c小鼠构建异种移植模型,实验结果显示BHB在balb/c小鼠体内同样部分通过介导GPR109A抑制肿瘤生长(图5G~L,P<0.05)。

图5 BHB的体内抗肿瘤作用Fig.5 Antitumor effect of BHB in nude mouse models bearing xenografts derived from A549 and LLC cells with or without GPR109Aknockdown.A:Gross observation of the dissected tumors on day 21.B:Comparison of tumor weight.C:Growth curve of the tumors in nude mice.D,F:mRNA and protein expressions of GPR109A in the tumor samples.G:Gross observation of the dissected tumors from Balb/c mice on day 21.H:Weight of the tumors from Balb/c mice.I:Growth curve of the tumors in Balb/c mice.J,L:mRNAand protein expression of GPR109Ain the tumor samples.*P<0.05,***P<0.001;#P<0.05,##P<0.01,###P<0.001.
3 讨论
在肺癌的多种亚型中,肺腺癌最为常见,而且由于化疗和靶向治疗的局限,患者预后较差[2]。除了常用的手术、放疗和化疗之类的治疗手段,KD也被部分研究人员用于干预肺腺癌,例如有研究发现KD可以抑制人肺癌A549细胞裸鼠皮下移植瘤的生长[16]。另有研究表明KD可抑制人神经母细胞瘤裸鼠皮下移植瘤的生长,指出其可能的抗肿瘤机制与细胞自噬有关[17]。有研究者也指出KD可在结直肠癌荷瘤小鼠体内发挥抗肿瘤效果,而且验证了KD代谢产物BHB体外抑制上皮细胞增殖和肿瘤生长[18]。上述研究表明了KD和BHB抑制肿瘤发展的潜力,但是BHB在肺癌中是否有类似作用却鲜有研究。本研究结果显示,BHB可在体外抑制肺癌A549细胞和LLC细胞的活性、增殖、迁移和侵袭能力。此外,本研究发现BHB能有效地抑制裸鼠和balb/c小鼠体内移植瘤的生长,结果初步证实了BHB对肺癌的抑制作用。
GPR109A是BHB的受体,被报道可在多种疾病中发挥调控作用,如研究发现BHB可在老年小鼠体内通过GPR109A/AMPK通路抑制肝内质网应激和脂质积累,揭示其改善与年龄相关的肝脏脂质积累的潜力[19];有研究发现BHB可部分通过激活GPR109A直接抑制肥大细胞的功能,进而抑制Ⅱ型固有淋巴细胞介导的气道炎症[20];另有发现BHB可通过介导GPR109A调节诸如阿兹海默症、帕金森症、中风及病理性疼痛等神经疾病[21]。基于此,本研究进一步探索BHB对A549细胞和LLC 细胞的抑制作用是否也是通过GPR109A 来介导。通过GEPIA2在线数据库分析GPR109A基因在肺腺癌中的差异化表达以及用不同浓度BHB处理A549细胞和LLC细胞,结果显示GPR109A在肺腺癌病人中的表达明显下降,而BHB处理能上调GPR109A的表达,这表明BHB对A549细胞和LLC细胞的抑制作用可能是由GPR109A介导。接着在A549细胞和LLC细胞中敲低GPR109A,并分别给予不同处理,实验结果进一步确定BHB对A549细胞和LLC细胞的抑制作用是部分通过GPR109A介导的。这些发现首次指出BHB在A549细胞和LLC细胞中部分通过介导GPR109A发挥其抗肿瘤特性的调控机制。
目前已有很多临床前研究表明KD可以抑制多种癌症[5,6],但也有报道显示KD可以对肿瘤的发生及发展起到促进作用。例如,生酮饮食增加了血清中酮体之一的乙酰乙酸的水平,导致表达BRAF v600e的人类黑色素瘤细胞在异种移植小鼠模型中的肿瘤生长潜力增强[22]。在结节性硬化症大鼠模型中,虽然KD可以通过上调抑癌基因Nrf2、p53和OGG1α抑制肾癌的早期生长,但是长期KD 干预反而最终通过上调ERK1/2 和mTOR促进了肾癌的发展[23]。虽然摄入KD可以抑制前列腺的发展,但是在肥胖小鼠中,KD并不能延缓前列腺的进展[24,25]。上述结果表明,KD对肿瘤的作用可能因肿瘤发病原因,肿瘤局部微环境不同而发挥截然相反的作用。同时,由于患者通常对KD的依从性较差,且应用KD干预可能带来的肾结石、骨代谢异常和高胆固醇血症等潜在危害,KD的临床应用仍存在较大局限[26]。因此明确KD干预中发挥作用的关键分子可有助于解决KD临床应用的局限,而本研究的结果初步证实KD的代谢产物BHB对于肺腺癌的抗肿瘤作用,并进一步阐释了其可能的调控机制,展现了BHB替代KD用于治疗肺腺癌的前景。
综上所述,本研究证实了BHB可在体外抑制肺腺癌A549 细胞和LLC 细胞的增殖、迁移和侵袭,并且BHB可以抑制裸鼠和balb/c小鼠体内的肿瘤生长。本研究也初步确认BHB部分通过介导GPR109A来发挥其抗肿瘤作用,为BHB临床治疗肺腺癌提供了理论基础,也为解决KD治疗肺腺癌的局限提供了新的见解。
- 南方医科大学学报的其它文章
- 高表达分泌颗粒蛋白II增加结直肠癌细胞对奥沙利铂的耐药性
- Neutrophil-lymphocyte and platelet-lymphocyte ratios for assessing disease activity in patients with rheumatoid arthritis receiving tofacitinib treatment
- 淫羊藿素通过调控铁死亡增加鼻咽癌细胞的放射敏感性
- 靶向结直肠癌的小白菊内酯脂质体纳米颗粒诱导程序性坏死并改善T细胞耗竭
- 二甲双胍减轻阿霉素诱导的心脏毒性:基于AMPK通路
- 甲基转移酶样3抑制剂STM2457通过调节线粒体功能改善代谢相关脂肪性肝病