载脂蛋白E基因多态性和早发性阿尔茨海默病关系的Meta分析
周杰超
广东省江门市五邑中医院检验科,广东江门 529000
早发性阿尔茨海默病(EOAD)定义为发病年龄在65岁之前的阿尔茨海默病(AD),EOAD患者通常呈现为疾病进展更具侵袭性和更短的相对生存时间[1]。人类载脂蛋白E(ApoE)是由299个氨基酸残基组成,可结合胆固醇和磷脂,以3种常见的亚型(ApoE2、ApoE3和ApoE4)存在,且参与大脑多种代谢调节和信号传导,故与AD的发生发展息息相关[2]。ApoE亚型影响AD发病中淀粉样蛋白(Aβ)斑块的聚集和清除,3种亚型影响Aβ病理性聚集能力依次为ApoE4>ApoE3>ApoE2,与ApoE3纯合子相比,认知正常的ApoE4携带者大脑表现出更高的Aβ和tau水平,而ApoE2携带者具有较低的Aβ水平[3-4]。鉴于公开发表的有关ApoE基因与EOAD的文献为单中心、研究病例较少、研究结果存在差异,本文对上述研究文献综合分析,以评价ApoE基因对EOAD的影响。
1 资料与方法
1.1文献检索 以“阿尔茨海默病(Alzheimer′s disease)、载脂蛋白E(Apolipoprotein E)、基因多态性(Gene polymorphism)”等为关键词,检索方式以主题、题名或关键词“AND”“OR”组成相应高级检索信息,检索中国知网数据库、万方数据库、维普网数据库、中国生物医学文献服务系统、PubMed、Embase、Web of Science、Cochrane数据库。检索时间为建库至2022年11月16日。
1.2文献的纳入和排除标准
1.2.1纳入标准 (1)AD的诊断符合《精神疾病诊断与统计手册五版》(DSM-IV、DSM-V)及美国国立神经病及语言交流障碍及卒中研究所和阿尔茨海默病及相关疾病协会(NINCDS-ADRDA)、美国国立老化研究所和阿尔茨海默病学会(NIA-AA)的诊断标准;(2)年龄≤65岁的AD患者;(3)纳入文献符合伦理审查或有知情同意;(4)标本类型为血液。
1.2.2排除标准:(1) Meta分析、综述、重复发表、研究对象为动物和未具体说明的文献;(2)研究设计为非病例对照的文献;(3)比较组之间不均衡、基线不一致、难以对比的文献;(4)研究对象无健康或良性患者组、无具体年龄和性别等基本描述的文献;(5)数据不全或计算有误的文献;(6)没有伦理审批或知情同意的文献;(7)纽卡斯尔-渥太华量表(NOS)评分≤5分的文献。
1.3纳入文献的质量评价分析、发表偏倚检测与数据提取 由2名独立的研究者采用NOS对符合纳入标准的文献从研究对象的选择、可比性和暴露3方面进行质量评价,总分为10分,评分≥5分为高质量文献,如2名研究者的评价意见不一致,交由第3名人员进行评价,对该研究再次进行质量评价后决定是否纳入。采用Review manager 5.3和STATA15.1进行发表偏倚分析。文献提取的数据包括第一作者、发表时间、种族、国家地区、性别、年龄、AD诊断标准、标本检测类型和方法及样本量、ApoE基因型和基因频率等。
1.4统计学处理 采用Review manager 5.3和STATA15.1统计软件对提取数据进行Meta分析。采用Mantel-Haenszel法绘制森林图,描述优势比值比(OR)和95%置信区间(95%CI),检验水准为α=0.05,以P<0.05为差异有统计学意义。研究异质性以OR的Cochrane Q 检验和I2统计量分析,P>0.1或I2<50%表示异质性较小采用固定效应模型,P≤0.1或I2≥50%表示异质性较大采用随机效应模型。采用Egger′s检验分析发表偏倚,P<0.05说明纳入文献存在发表偏倚,也可通过漏斗图作辅助判断,漏斗图两侧不对称说明存在发表偏倚。敏感性分析采用Review manager 5.3对数据进行更换合并模型的方法分析,更改模型前后OR值和P值变化不大认为本研究敏感性低。
2 结 果
2.1纳入文献的基本信息和质量评分 通过检索数据库得到文献2 457 578篇,进一步将以上所有数据库的高级检索信息关系改为“与、AND”之后检索,将检索到的文献以文献纳入和排除标准筛选,最终纳入9篇中英文文献,纳入文献的EOAD组和对照组在病程、年龄等方面基线统一,纳入总人数为2 937例,其中EOAD组948例,对照组1 989例。NOS评分>5分,表示本次纳入文献均为高质量文献。
2.2异质性、发表偏倚和敏感性分析 Meta分析结果显示,E2E4与E3E3、E3与E4相比较存在异质性,运用随机效应模型分析数据,其他对比组合异质性较小,使用固定效应模型合并结果。Egger′s检验结果显示E3E3与E4E4、E3E4与E4E4的比较组合存在发表偏倚,P<0.05,但是其CochraneQ检验和I2的P>0.1且I2<50%,这时仍然使用固定效应模型合并分析结果,分析结果需谨慎。结果显示所有相比较的组合中两种合并模型的OR值、P值变化不大,故本次纳入的文献敏感性低。见表1。
2.3各效应量合并分析
2.3.1ApoE 基因分型与 EOAD 的关系 将ApoE基因分型进行比较并组成15种组合,根据模型的OR值和P值判断EOAD的保护因素和风险因素,OR值越小且P<0.05,保护作用越大,反之风险越大。Meta分析结果显示,E2E2与E3E4、E4E4相比为EOAD的保护因素,同理可以推断出其他组合的保护因素。见表1。组合中OR值最为显著的有:E2E2/E4E4,E2E3/E4E4,E3E3/E4E4,见图1~3,漏斗图中只有E3E3/E4E4组合呈现不对称,但异质性小。
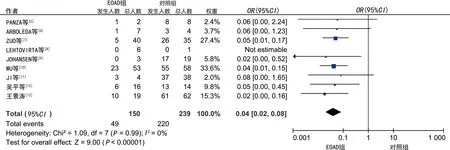
注:Heterogeneity为异质性分析,I 2为异质性大小。
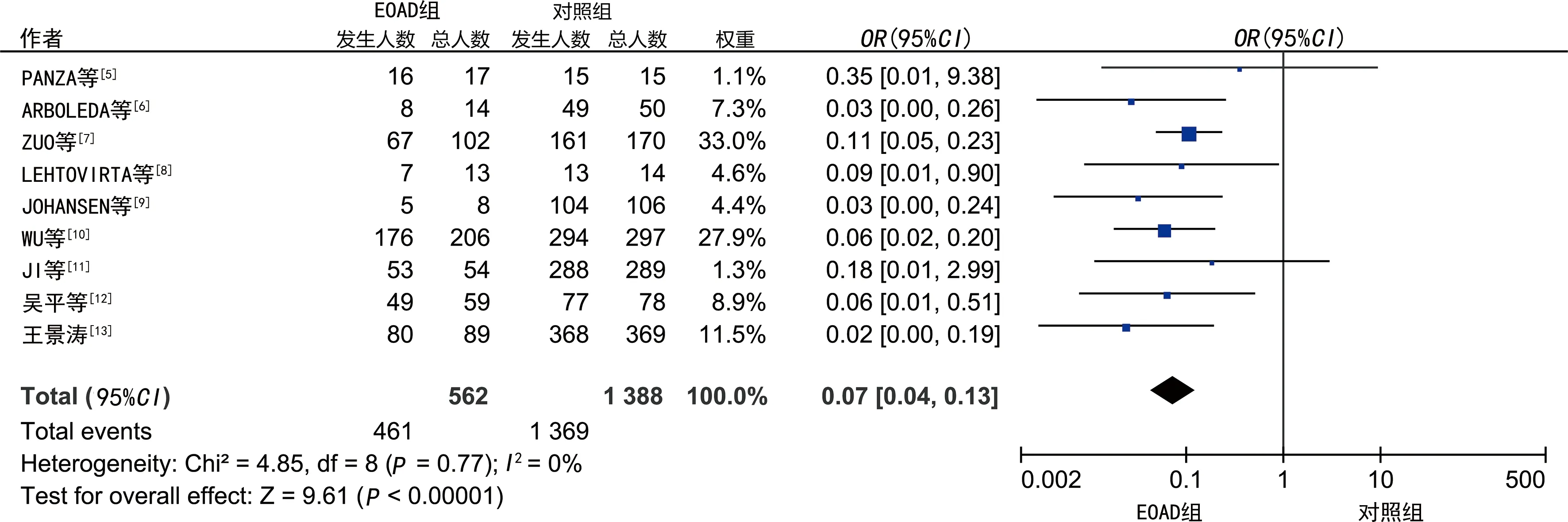
注:Heterogeneity为异质性分析,I 2为异质性大小。
2.3.2ApoE 等位基因与EOAD的关系 采用与基因分型同样的组合和判断方法,将ApoE 等位基因E2、E3、E4相比组成3种组合。Meta分析结果显示,E2与E3、E4相比为EOAD的保护因素,E3与E4相比为EOAD的保护因素。见表1。组合中OR值较为显著的有E2/E4,E3/E4,见图4~5,漏斗图中只有E3/E4组合呈现不对称,但Egger′s检验不存在发表偏倚。
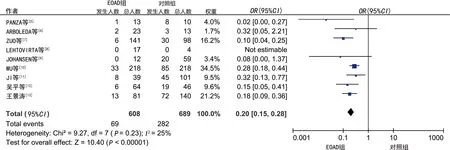
注:Heterogeneity为异质性分析,I 2为异质性大小。
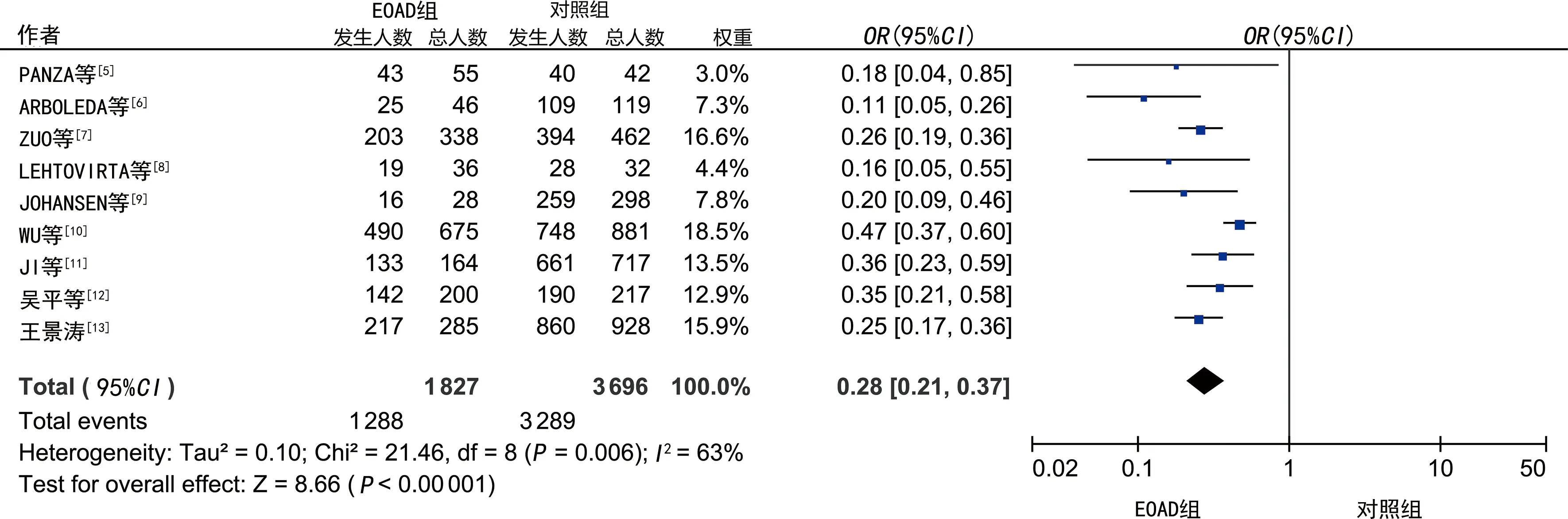
注:Heterogeneity为异质性分析,I 2为异质性大小。
3 讨 论
EOAD的首发症状在30~65岁,大多数被诊断为EOAD的患者年龄在45~60岁,除了记忆障碍的典型临床表现外,还报道了视觉、语言、行为、运动功能和执行障碍等非典型临床表现。EOAD的患病率相对较低,早老素1(PSEN1)、早老素2(PSEN2)和淀粉样蛋白前体(APP)中的常染色体显性突变仅占所有EOAD病例的10%(占所有AD的1%),而大多数EOAD的原因无法解释,其中ApoE与Aβ互相作用从而影响EOAD的进展[14]。
研究显示,携带ApoE4基因和较高的医疗负担导致12.9%的轻度认知障碍(MCI)患者进展为AD,提高收入和教育水平、增加社交活动和减少日常压力能降低AD的转化[15]。一项研究表明,携带ApoE4和白细胞介素6-174位点(IL-6-174 C)等位基因可能是早期(<50岁)非典型临床表现EOAD的发病因素[16],其他ApoE基因型亦可能同时影响EOAD的进展,且ApoE在EOAD和LOAD发病机制中可能发挥不同的作用。一项关于小鼠的研究显示,与携带ApoE2、ApoE3基因的小鼠相比,携带ApoE4的小鼠能上调磷脂和鞘脂的水平促进AD发生,相反ApoE2携带者可能具有保护作用[17]。一项60%非裔美国人和40%欧洲裔美国人的研究队列显示,随着年龄的增长,携带ApoE2基因的人群认知能力下降缓慢,而携带ApoE4的人群下降较快[18]。伴随年龄的渐增,ApoE2携带者对非痴呆老年人的认知影响具有保护作用,与ApoE E3E3纯合子相比,ApoE2携带者发生AD的风险降低约50%[19]。ApoE激活神经元信号通路的效力为ApoE4>ApoE3>ApoE2,ApoE4可能通过信号传导的方式增加APP基因的表达,加速AD的发病[20]。由此可见,虽然研究已显示AD患者中ApoE2和ApoE3被认为是可能的保护因素,ApoE4为风险因素,但EOAD的发病机制十分复杂,包括内源性因素和外源性因素(环境、饮食、教育等),ApoE基因如何在EOAD复杂的发病机制中参与大脑多种信号通路和代谢调节值得探讨,也为后续研究EOAD的早期精准诊疗提供参考依据。研究报道,ApoE4可能直接或间接与一种参与细胞凋亡起始的细胞表面受体(FAS)介导的细胞凋亡途径共同参与EOAD发病过程[21]。ApoE与大脑神经元细胞骨架蛋白tau蛋白、微管蛋白、肌动蛋白等蛋白质相互作用,直接或间接参与AD早期发病过程[22-23]。一项小鼠模型实验显示,ApoE敲除(ApoE-/-)小鼠的突触功能下降、炎症程度与年龄增长呈正相关[24],表明ApoE影响大脑tau蛋白和Aβ蛋白的形成。ApoE能与ApoE受体结合并激活一系列信号通路反应,刺激转录因子AP-1,进而增强APP的转录,从而增加Aβ水平促进AD发病,ApoE基因刺激Aβ蛋白产生的效力为ApoE4>ApoE3>ApoE2[25]。一种与早发性家族性AD(EOFAD)相关的罕见功能丧失变异体干扰了人小胶质细胞(HM)的溶酶体活性,损害溶酶体功能,导致AD病理性蛋白积聚,此过程ApoE可能与其互作,使用AAV技术在小鼠中将其过度表达,显著加重了小鼠脑组织Aβ病理和 Aβ介导的神经变性[26]。MARTENS等[4]提出一种AD发病中的ApoE级联假说,从ApoE 结构差异、脂质化、寡聚化、蛋白质水平再到受体结合,产生的生物变化会引起一系列反应,其中胞内脂质外排能力为ApoE2>ApoE3>ApoE4。有研究显示,ApoE mRNA诊断AD的曲线下面积(AUC)为0.886,特异度较高,灵敏度高,可作为早期诊断AD的潜在生物标志物[27]。MCI或症状前痴呆患者与对照组之间存在ApoE基因差异甲基化,表明ApoE基因的甲基化可作为AD早期诊断的生物标志物[28]。主观认知能力下降(SCD)与高β-淀粉样蛋白负荷、ApoE基因分型相结合,有助于识别处于临床前AD阶段的高风险个体,为诊断早期EOAD提供参考数据[29]。一个由ApoE4等位基因状态、血浆胶质纤维酸性蛋白(GFAP)、p-tau181、p-tau231、年龄、性别构成的AD诊断模型具有较高的AUC,能作为早期AD的诊断工具[30]。一项小鼠实验显示,使用脂质体递送编码ApoE2质粒(PApoE2)可有效穿透血脑屏障且不良反应小,可成为治疗AD的有效手段[31]。随着基因编辑CRISPR技术的发展,通过CRISPR将ApoE4基因转化为ApoE3或ApoE2样结构或许是一种有吸引力的方法,可以增加保护性ApoE基因,同时降低ApoE4的致病风险[32-33]。一项非人灵长类动物实验显示,在中枢神经系统利用病毒载体递送ApoE保护基因AAV-ApoE2治疗AD能达到效率高风险低的效果[34],然而,在小鼠大脑递送AAV-ApoE4却不能导致tau蛋白的病理性改变[35],再次证明ApoE4并不是tau蛋白病理集聚的单一影响因素。另外,使用多能干细胞iPSC技术使表达不同ApoE亚型的患者来源iPSC细胞分化为各种类型脑细胞,可用于AD疾病建模、药物筛选和发病机制研究[36]。HOU等[37]研究揭示,抑制γ分泌酶的能力为ApoE2>ApoE3>ApoE4,因此可利用ApoE此胞内功能开发在细胞内抑制γ分泌酶清除淀粉样斑块治疗AD的药物。一项大队列研究表明,血压升高与认知能力降低呈正相关,治疗高血压可能是预防和改善痴呆的有效方法[38]。本研究Meta分析结果显示,以ApoE基因分型E4E4和等位基因E4为对照,EOAD的保护因素为E2E2、E2E3、E3E3,且E2E3保护作用大于E3E3,其中在E2E4/E4E4的组合中,OR为0.09(95%CI:0.04~0.22),且P<0.001,显示E2E4相对E4E4的且为保护因素,其保护作用仅次于E2E3。E2E3/E2E4的OR为0.53(95%CI:0.28~0.98),且P=0.04,因E2E4/E4E4的组合中E2E4携带等位基因E4,却能显示出较为明显的保护作用,可能是由于E2E4在EOAD组和对照组中的发病人数差异不大,然而E4E4在EOAD组的发病人数明显大于对照组,而E2E4与其他基因分型的组合差异无统计学意义(P>0.05)。ApoE等位基因保护因素是E2>E3,其中基因分型E4E4相对于E2E2的发病风险为20.20倍,E4E4相对于E2E3、E3E3和E2E4的发病风险分别为24.28倍、13.46倍和10.85倍,等位基因E4相对于E2,E3的发病风险分别为4.90倍和3.58倍。本研究中有两组合研究Egger′S检验P<0.05存在发表偏倚,但是异质性较低,采用固定效应模型合并数据,I2结果显示为中度异质性的研究不存在发表偏倚,故没有对其进行亚组分析,以上原因考虑可能为不同国家、地区、种族、饮食等方面的影响导致发表偏倚和异质性的发生。总体Meta分析结果稳定、可靠。
综上所述,携带ApoE4等位基因的人群较易发生EOAD,以ApoE基因分型E4E4为高风险因素,然而ApoE基因分型E2E2,E2E3,E3E3相对为保护因素,其显著性E2E3大于E3E3。往后,仍需要大量的人群队列加以验证。

