基于双重CRISPR-Cas12a的新型冠状病毒核酸胶体金检测试纸条的研制*
黄 涛,魏道舜,钱纯亘,李永聪,刘仲明,李辉军,汪大明,张 赛△
1.深圳市亚辉龙生物科技股份有限公司,广东深圳 518116;2.华中科技大学生命科学与技术学院,湖北武汉 430074;3.中国人民解放军南部战区总医院医学实验科,广东广州 510010;4.华中科技大学同济医学院附属同济医院检验科,湖北武汉 430030;5.中国科学院苏州生物医学工程技术研究所,江苏苏州 215163
新型冠状病毒(SARS-CoV-2)属于β属的冠状病毒,有包膜,是一种单股正链RNA病毒,基因组全长约30 kb,两端为非编码区,中间为非结构蛋白编码区和结构蛋白编码区。非结构蛋白编码区主要包括开放读码框架(ORF)1a和1b基因,编码16个相对保守的非结构蛋白(NSP),即NSP1-16。结构蛋白编码区主要编码刺突(S)蛋白、包膜(E)蛋白、膜(M)蛋白和核衣壳(N)蛋白[1-2]。
对于SARS-CoV-2的核酸检测,目前有基因测序[3-4]、数字PCR[5]和实时逆转录聚合酶链式反应(RT-qPCR)[6-7]。RT-qPCR作为SARS-CoV-2检测的“金标准”,对病毒核酸的检测具有很好的灵敏度、准确度和特异度。但由于RT-qPCR需要昂贵的仪器,较高要求的实验室环境及专业的操作人员,从而限制了它的临床应用。近些年来,已有多种恒温扩增方法,如重组酶聚合酶等温扩增(RPA)[8]、酶促反应恒温扩增(ERA)[9]及环介导等温扩增(LAMP)[10]等,由于这些操作简单、速度快、成本低从而得到快速的发展。
成簇规律间隔短回文重复序列(CRISPR)和相关核酸内切酶(包括Cas12a、Cas12b、Cas13a、Cas13b和Cas14)可在序列特异性RNA分子(gRNA)的指导下,与其特定靶点结合后表现出侧向切割活性,激活的Cas核酸酶额外地切割单链DNA(ssDNA)[11-14]。基于恒温扩增及CRISPR/Cas的核酸检测技术,有研究者开发了SHERLOCK系统[15]、AIOD-CRISPR[16]和DETECTR[17]系统,用于SARS-CoV-2的即时检测。尽管SHERLOCK和DETECTR可通过侧向层析试纸条进行SARS-CoV-2检测,但从扩增到取得结果大约需要1 h。
为克服上述检测系统的缺点,达到快速检测SARS-CoV-2目的。本研究将RPA与CRISPR-Cas12a检测相结合,通过设计依赖原间隔区邻近基序位点(PAM)序列的正反双重crRNAs来启动高效核酸剪切。标本裂解后,既可实现双靶点基因的恒温扩增与双重CRISPR检测单管反应,又可将双靶点基因的恒温扩增与双重CRISPR检测同管同时反应,最后使用胶体金试纸条进行侧向层析检测,实现对SARS-CoV-2的现场快速检测。现报道如下。
1 材料与方法
1.1仪器与试剂 含SARS-CoV-2的ORF1ab部分序列和N基因全部序列的阳性质粒(深圳市亚辉生物科技股份有限公司),引物、crRNA、单链DNA探针[生工生物工程(上海)股份有限公司],RT-基础型核酸扩增试剂(RAA法,杭州众测生物科技有限公司,货号:S003ZC),SARS-CoV-2假病毒全基因组质控品[菁良基因(深圳)科技有限公司,货号:GW-CRBM001],超快速核酸释放剂[RNA型,安普未来(常州)生物科技有限公司,货号:WLD8202]。
重组酶T4 UvsX(南京巨匠生物科技有限公司,货号:M105),重组酶辅助蛋白T4 UvsY(南京巨匠生物科技有限公司,货号:M106),T4 gene protein 32(南京巨匠生物科技有限公司,货号:M104),链置换DNA聚合酶Bsu(南京巨匠生物科技有限公司,货号:M103),LbCas12a核酸内切酶(NEB,货号:M0653T)。
硝酸纤维素膜(NC膜)、玻璃纤维素膜(默克密理博公司),兔抗6-FAM单克隆抗体(金斯瑞生物科技股份有限公司,货号:V90101),SA链霉亲和素(菲鹏生物股份有限公司,货号:SA8),羊抗兔二抗(南京京达生物技术有限公司,货号:W4011)。
1.2方法
1.2.1引物、crRNA以及ssDNA的设计、合成与筛选 根据SARS-CoV-2 ORF1ab 基因和N基因的序列,设计了用于恒温扩增的引物和启动CRISPR-Cas12a的crRNA,单链DNA探针的5′端标记FAM荧光基团,3′端进行生物素biotin修饰。引物、crRNA、单链DNA探针(表1)均由生工生物工程(上海)股份有限公司合成。采用阳性质粒和杭州众测生物科技有限公司的RT-基础型核酸扩增试剂(RAA法)进行引物筛选,具体策略:采用SYBR Green染料法将正向引物与反向引物相互搭配组合的方式进行,筛选最佳正向和反向引物对。

表1 引物、crRNAs及探针的名称和序列
1.2.2双重CRISPR检测试剂反应体系建立 在引物和病毒裂解液筛选基础上,进行配方及反应体系优化。恒温扩增体系:50 μL反应体积中加入20 μL 2.5×A buffer(50 mmol/L pH 8.0 Tris-Ac,80 mmol/L KAc,14 mmol/L MgOAc)、6 μL B buffer(2 mmol/L DTT,5% PEG 20000,200 μmol/L dNTPs,3 mmol/L ATP,50 mmol/L磷酸肌酸)、9 μL Enzyme Mix-core(100 ng/μL CPK,1 U/μL M-MLV,0.1 U/μL RNase H,50 ng/μL Bsu DNA 聚合酶Ⅰ大片段,300 ng/μL T4 UvsX,60 ng/μL T4 UvsY,500 ng/μL T4 GP32,1 U/μL Rnasin),2 μL 10 μmol/L正向引物、2 μL 10 μmol/L反向引物、11 μL模板和RNase-free water(RNA模板加5 μL,RNase-free water加6 μL;DNA模板加1 μL,RNase-free water加10 μL),23~37 ℃条件下反应5~20 min。CRISPR检测体系为50 μL反应体积中加入2.5 μL 20×CRISPR检测试剂(10 mmol/L pH 7.40的Tris-HCl缓冲液,10 μmol/L LbCas12a核酸内切酶,2 mg/mL BSA),0.5 μL 1 μmol/L crRNA1/2,2.5 μL 10 μmol/L单链DNA探针,5 μL恒温扩增产物,39.5 μL RNase-free water,23~37 ℃条件下反应5~20 min。
恒温扩增与CRISPR检测同时进行的反应体系:50 μL反应体积中加入20 μL 2.5×A buffer、6 μL B buffer、9 μL Enzyme Mix-core、2 μL 10 μmol/L正向引物、2 μL 10 μmol/L反向引物、2.5 μL 20×CRISPR检测试剂、0.5 μL crRNA1/2、2.5 μL单链DNA探针、5.5 μL模板和RNase-free water(RNA模板加5 μL,RNase-free water加0.3 μL;DNA模板加1 μL,RNase-free water加4.3 μL),23~37 ℃条件下反应5~20 min。
1.2.3胶体金检测试纸条制备 用标本垫处理液将标本垫涂布处理均匀,每张玻纤涂布量为30 mL,50 ℃烘干24 h。用偶合物稀释液稀释胶体金标记兔抗6-FAM单克隆抗体偶合物,体积占比为20%,用稀释好的偶合物处理液将偶合物垫涂布处理均匀,每张玻纤涂布量为30 mL,45 ℃干燥24 h。用含0.01 mol/L pH 7.4的PBS、5%海藻糖的包被液稀释羊抗兔二抗和SA链霉亲和素浓度为1.0 mg/mL,分别作为检测线(T线)和质控线(C线)捕获抗体包被在NC膜上,45 ℃烘干48 h。将制备好的标本垫、偶合物垫及NC膜依次黏贴在PVC底板上,用切条机裁切3 mm宽度。
1.2.4双重CRISPR检测系统评估 使用ssDNA-FB(5′-6-FAM-TTATT-3′biotin)探针在反应管中添加不同的成分进行了12个反应,1~9号管为先进行恒温扩增后进行双重CRISPR检测,10~12号管为恒温扩增与双重CRISPR检测同管同时进行。在37 ℃条件下反应15 min,反应结束后采用凝胶电泳进行终点检测,同时用胶体金试纸条进行侧向层析检测。
1.2.5灵敏度分析 将SARS-CoV-2假病毒加入一定体积的RNase-free water进行复溶,并用RNase-free water分别稀释成2 000、1 500、1 000、500 copy/mL的假病毒稀释液。分别取上述稀释液5 μL加入等体积的病毒裂解液混匀后,室温裂解5 min,得到1 000、750、500、250 copy/mL的病毒裂解液,分别取1 μL进行恒温扩增。扩增产物一部分用氯仿按1∶1粗提后进行凝胶电泳检测,一部分搭配ssDNA-FB(5′-6-FAM-TTATT-3′biotin)探针经CRISPR酶切反应后用胶体金试纸条进行侧向层析检测。
1.2.6特异度分析 分别选用筛选获得的基于SARS-CoV-2 ORF1ab和N基因的特异性引物对16种呼吸道病原体进行交叉反应性评价。将病原体原液按1∶1体积比加入病毒裂解液,室温处理5 min。按照上述恒温扩增条件进行反应,37 ℃反应15 min后,用胶体金试纸条进行侧向层析检测,并记录检测结果。
1.2.7不同温度扩增效率分析 以SARS-CoV-2的N基因质粒为模板,在23 ℃和37 ℃条件下进行反应,分别设置反应时间为5、10、15、20 min,反应结束后进行凝胶电泳检测,同时用胶体金试纸条进行侧向层析检测(添加ssDNA-FB探针)。
1.2.8稳定性分析 配制基于胶体金试纸条显色的试剂,按照试剂所包含的组分分成两组,每组8份。一组于-20 ℃及以下条件存放,一组于37 ℃条件存放。处理至第0、1、3、6、7、8天,分别取出试剂以N基因质粒为模板在37 ℃条件下反应15 min,根据检测原理用胶体金试纸条进行侧向层析检测评估稳定性。
1.2.9临床性能评价 用广州万孚生物技术股份有限公司生产的SARS-CoV-2核酸检测试剂盒(荧光PCR法)筛选阳性及阴性标本各30例,每个标本用本研究制备的核酸胶体金检测试纸条测试,使用SPSS 20.0统计软件及Kappa检验进行数据分析,评价所研制的核酸胶体金检测试纸条的临床性能。
2 结 果
2.1引物筛选 以100 ng/μL含SARS-CoV-2开放式阅读框ORF1ab部分序列和N基因全部序列的质粒为标本进行测试。为能筛选到性能最优的基于ORF1ab基因的恒温扩增引物,笔者将F1、F2、F3引物分别与R1、R2、R3配对组合,采用SYBR Green染料法进行引物对扩增性能的评估。结果显示,F1R1引物对起峰时间最短,荧光信号最强,表现为扩增效率最高,见图1A。同样的策略,筛选得到基于N基因的最优引物组合F2R2,见图1B。
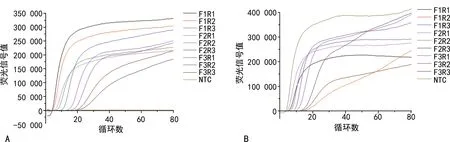
注:A为ORF1ab基因引物扩增曲线图;B为N基因引物扩增曲线图。
2.2双重CRISPR检测系统评估 凝胶电泳检测结果显示,除了未加模板的1和未加恒温扩增酶试剂的11两个反应没有扩增条带以外,其余均有扩增条带,见图2A。其中,仅加了基于ORF1ab基因引物的2、3、4、5和仅加了N基因引物的6、7、8、9为单带,10和12两个反应为模糊的两条带。胶体金试纸条检测结果显示,试纸条2、3、4、6、7、8及10仅T线显色,结果为阳性,试纸条1、5、9、11及12仅C线显色,结果为阴性,见图2B。以上研究结果充分说明,双重CRISPR检测试剂既能高效地实现先恒温扩增再进行双重CRISPR检测,又可实现恒温扩增与双重CRISPR检测同管同时进行。
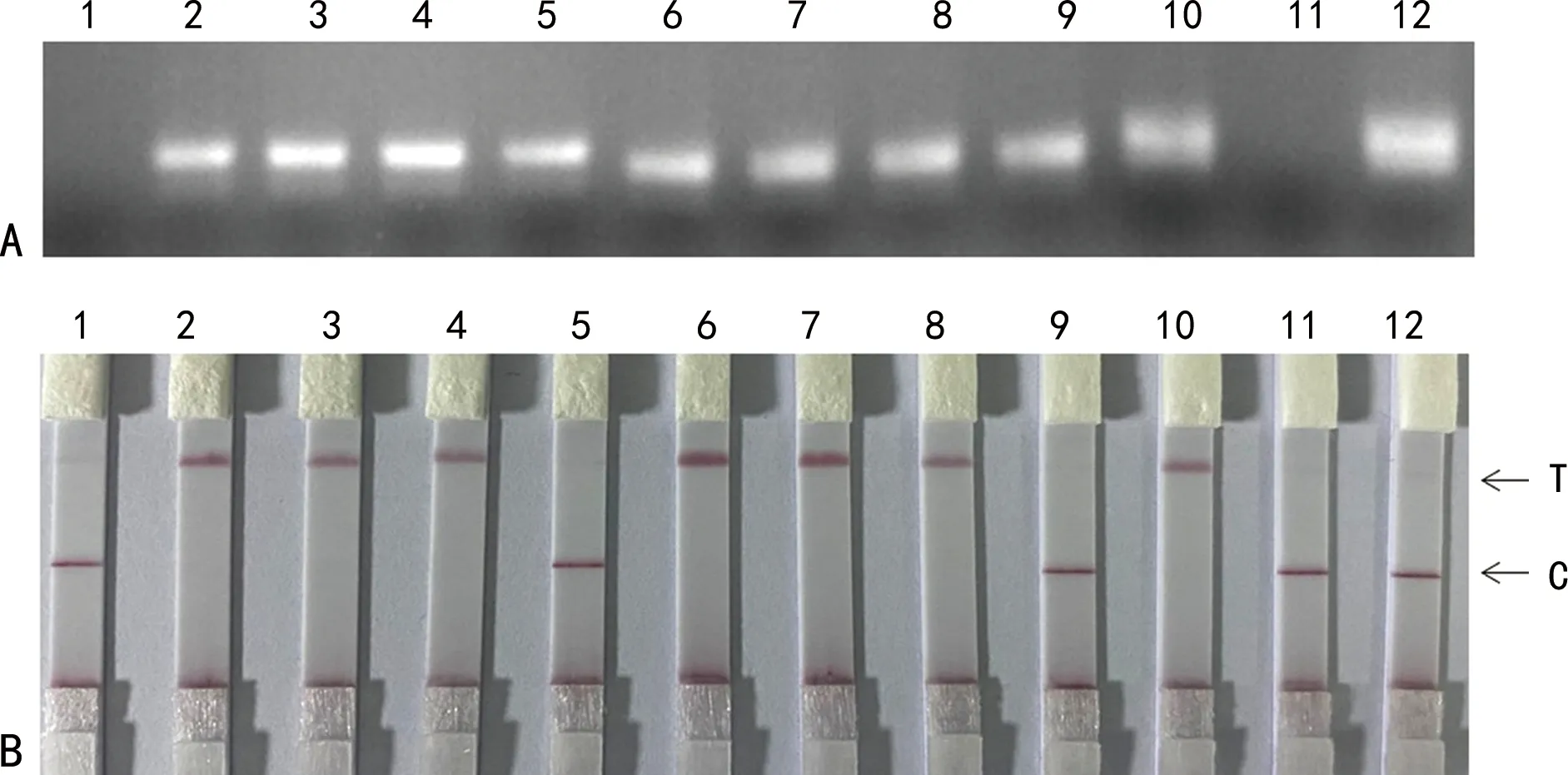
注:A为凝胶电泳条带结果;B为胶体金侧向层析试纸条显色结果;1表示未加模板,2表示加ORF1ab-crRNA1引物,3表示加ORF1ab-crRNA2引物,4表示同时加ORF1ab-crRNA1和ORF1ab-crRNA2引物,5表示未加ORF1ab-crRNA1和ORF1ab-crRNA2引物,6表示加N-crRNA1引物,7表示加N-crRNA2引物,8表示同时加N-crRNA1和N-crRNA2引物,9表示未加N-crRNA1和N-crRNA2引物,10表示所有试剂组分均加,11表示未加RPA恒温扩增酶,12表示未加Cas12a核酸内切酶。
2.3灵敏度分析 凝胶电泳及胶体金试纸条结果显示,除了无模板的对照(CK)没有扩增条带外,1 000 、750、500、250 copy/mL的病毒裂解液均有目标大小的凝胶电泳条带出现(图3A)。同时,胶体金侧向层析试纸条的T线均显色(图3B),为阳性;而在无模板对照中C线显色,为阴性。以上结果表明,双重CRISPR-Cas12a检测试剂对SARS-CoV-2假病毒的检测灵敏度为250 copy/mL。

注:A为凝胶电泳条带结果;B为胶体金侧向层析试纸条显色结果;M为DNA Marker,CK表示未加模板,250、500、750、1 000分别为病毒拷贝数。
2.4特异度分析 16种呼吸道病原体检测结果均为阴性,这说明双重CRISPR检测试剂与本研究中提到的病原菌不会发生交叉反应,表现出很强的特异性。见表2。
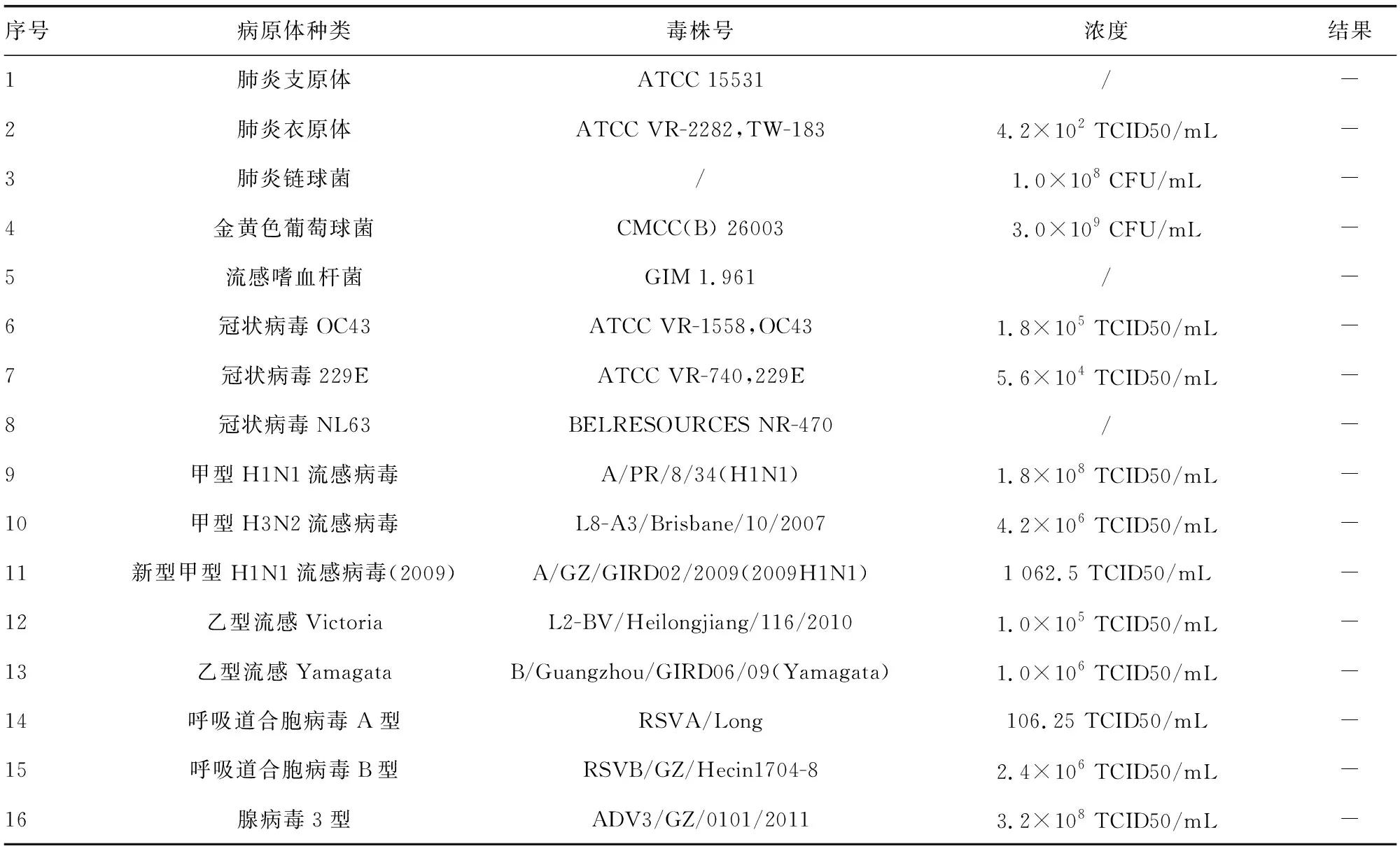
表2 不同呼吸道病原体交叉反应分析
2.5不同温度扩增效率分析 23 ℃条件下扩增反应10 min及以上时,胶体金试纸条T线显色,当反应15 min时可以观察到目的大小的凝胶电泳条带。同样,在37 ℃条件下扩增反应5 min,胶体金试纸条T线显色,当扩增反应10 min及以上时可以观察到目的大小的凝胶电泳条带。扩增5 min的反应,虽凝胶电泳检测不到条带,但胶体金试纸条均为强阳性,这说明扩增得到的靶基因量足够激活酶切体系中的Cas12a,实现对探针的完全切割。加上胶体金试纸条本身反应时间一般在10 min内,以上结果表明,双重CRISPR检测试剂在37 ℃条件下20 min内即可达到检测SARS-CoV-2的目的。
2.6稳定性分析 试纸条于分别在-20 ℃和37 ℃条件下存放8 d,取出试剂以N基因质粒为模板在37 ℃条件下反应15 min反应后,胶体金试纸条仍呈现T线显色C线不显色,保持其良好的检测效果,说明双重CRISPR检测试剂稳定性良好。
2.7临床性能评价 用广州万孚生物技术股份有限公司生产的SARS-CoV-2核酸检测试剂盒(荧光PCR法)筛选阳性及阴性标本各30例,每个标本用本研究制备的核酸胶体金检测试纸条测试,结果见表3,与万孚SARS-CoV-2核酸检测试剂盒检测结果比较,本研究制备的核酸胶体金检测试纸条灵敏度为90.00%(27/30),95%CI:73.47%~97.89%;特异度为100%(30/30),95%CI:88.43%~100.00%,总符合率为95.00%(57/60),95%CI:86.08%~98.96%;Kappa检验一致性较好,Kappa值为0.900 0,P<0.05。

表3 临床性能比对测试结果(n)
3 讨 论
PCR核酸检测是早期发现病原体灵敏度和特异度均高的方法,但由于常规的PCR检测需要昂贵的核酸扩增设备和训练有素的专业人员,而且检测时间几乎都在1.5 h以上,使目前的PCR技术不适合快速诊断POC应用。因此,迫切需要一种简易的、快速且价格低廉的诊断方法。
在本研究中,笔者介绍了一种简单、快速、高灵敏、高特异度、一体化检测SARS-CoV-2的双重CRISPR检测试剂。这种检测试剂基于SARS-CoV-2的ORF1ab和N基因目标序列设计正反双重crRNAs,可以免病毒RNA提取和纯化,直接将病毒标本裂解后加入恒温扩增试剂和CRISPR检测试剂,将所有成分放在同一反应管中进行恒温扩增和CRISPR检测,实现了快捷、一体化的SARS-CoV-2病毒分子诊断,无需专业的操作人员和昂贵的核酸扩增仪器,真正意义上脱离PCR实验室开展分子诊断。更重要的是,检测结果可以直接通过侧向层析试纸条进行肉眼观察,整个检测过程在20 min内就可完成,在23~37 ℃均可进行检测。同时,该检测试剂具有良好的热稳定性,即使于37 ℃条件存放8 d仍具有良好的检测效果。与已经报道的基于CRISPR的核酸检测方法相比[17-18],这种检测试剂无需单独提取病毒RNA和逆转录获得cDNA的步骤,等温扩增和基于CRISPR检测的成分都是在一个反应管中进行,完全避免了需要单独提取病毒RNA,再逆转录,以及靶核酸的单独预扩增所带来的耗时长的缺点。
综上所述,双重CRISPR分析是一种快速、一体化、可恒温扩增的核酸检测方法,具有高特异度、高灵敏度的特点。这种简单而稳健的方法在未来开发下一代POC分子诊断技术,并用在家庭或诊所快速检测传染病方面具有巨大潜力。

