基于高通量测序技术鉴定栽培草莓资源携带的病毒种类
刘思佳, 曾祥国, 肖桂林, 王 涌, 韩永超
(1.湖北省农业科学院经济作物研究所,湖北武汉 430072; 2.华中农业大学园艺林学学院,湖北武汉 430070)
草莓(Fragaria×ananassaDuch.)是蔷薇科草莓属多年生草本植物。草莓果实味道酸甜可口,含有丰富的无机和有机营养物质和花青素,香味浓郁,被誉为“水果皇后”[1]。草莓对栽培环境的适应性较强,有着结果快、成熟早、繁殖快、周期短、经济效益高的特点,在全国各地广泛种植,目前我国已成为世界第一草莓生产和消费大国[2]。由于草莓在生产中以匍匐茎无性繁殖为主,病毒病较为严重,感染一种病毒时植株往往没有明显症状,但是病毒侵染会导致植株的抗病性下降,产量降低,畸形果率增加。病毒病是草莓生产中的主要病害之一,对产业健康发展造成严重影响,草莓病毒病的防治是保障草莓生产,提升产量与品质的关键。
据不完全统计,目前全球已报道的草莓病毒有20余种,关于草莓病毒检测,在我国各地区也都有过不少相关研究[3]。杨波等在新疆地区检测出草莓镶脉病毒(strawberry vein banding virus,简称SVBV)、草莓斑驳病毒(strawberry mottle virus,简称SMoV)和草莓轻型黄边病毒(strawberry mild yellow edge virus,简称SMYEV)并建立了三重PCR体系[4];韩晓玉等在河南地区检测出SVBV、SMoV、SMYEV、草莓白化病毒(strawberry pallidosis-associated virus简称,SPaV)和草莓坏死休克病毒(strawberry necrotic shock virus,简称SNSV),并建立了多重PCR体系,一次检测5种病毒[5];陈道在福建地区检测出SVBV、SMoV、SMYEV、草莓毛形病毒3(strawberry crinivirus 3,SCrV3)、草莓毛形病毒4(strawberry crinivirus 4,简称SCrV4)和SPaV,并获得了SPaV的全基因组序列[6];冉策在北京地区检测出SVBV、SMoV、草莓皱缩病毒(strawberry crinkle virus,简称SCV)、烟草花叶病毒(tobacco mosaic virus,简称TMV)和黄瓜花叶病毒(cucumber mosaic virus,简称CMV)并建立了SCV的RT-LAMP病毒检测体系,提高了检测效率和灵敏度[7];刘雅等在上海地区检测出SVBV、SMoV、SMYEV[8];黄倩茹等在陕西地区检测出SVBV、SMoV、SMYEV、菠菜潜隐病毒(spinach latent virus,简称SpLV)和番茄线虫传多面体病毒(lycopersicon esculentum nepovirus,简称LENV),首次报道在草莓上检测到SpLV和LENV[9-10];王佳等在辽宁地区检测出SVBV、SMoV、SMYEV和SNSV[10-11];朱海生等在四川地区检测出SMoV,并且对7个省份的红颜、白雪公主、隋珠、光点和圣诞红5个草莓品种调查发现,感染病毒的品种均为红颜,而其他品种并未检测出病毒[12]。
我国草莓产区内常见病毒有3种,分别为草莓斑驳病毒SMoV、SVBV、SMYEV[12]。SPaV最早于20世纪50年代在美国和澳大利亚被报道,2017年Ding等在福建首次发现SPaV[13],次年Shi等在河南发现SPaV[14]。目前关于草莓病毒病的相关报道中,病毒检测时较少说明感染病毒的草莓品种。采用高通量测序技术对草莓苗进行检测,并利用RT-PCR技术进行验证,为草莓病毒病的防治以及选育抗病毒品种提供依据。
1 材料与方法
本研究于2021年3月至2022年5月在湖北省农业科学院经济作物研究所完成。
1.1 材料
用于本研究的草莓品种材料为历年来从各地收集的栽培草莓品种,共86份,保存于湖北省农科院经济作物研究所草莓种质资源圃(避雨网室)。
1.2 试验方法
1.2.1 混合样品中病毒的高通量检测 对86份草莓品种材料分别采样,每份样品采集100 mg新鲜叶片,采用RNA提取试剂盒(HiPure Plant RNA Mini Kit,Magen生物)提取草莓叶片总RNA,每管加入 30 μL RNA free水溶解。样品检测合格后,将提取的86份草莓RNA进行混样处理,此样品命名为PZM01。剩余样品RNA置于-80 ℃保存备用。同时采集脱毒苗叶片并提取总RNA,命名为TDM01,重复上述提取步骤,并将2个样品的Small RNA建库,测序分析委托北京百迈客生物科技有限公司完成[15-19]。总RNA的RIN值≥8.0,28S/18S≥1.5。
1.2.2 草莓样品的RT-PCR检测 首先采用 RT-PCR 对高通量测序结果进行验证,然后再分别对每份供试草莓品种样品的详细带毒情况进行检测。针对每种Small RNA测序检测到的病毒均采用2对特异性引物进行检测,根据Small RNA测序拼接结果中的相应病毒基因片段序列,应用引物在线设计网站(https://www.genscript.com/)进行引物设计,引物设计目的片段大小为400~800 bp。另从已发表文献中分别选取3种病毒的特异性检测引物各1对(表1)。采用反转录试剂盒(RevertAid First Strand cDNA Synthesis Kit,Thermo科技有限公司),以混样总RNA为模板,用随机引物反转录合成cDNA,然后采用所设计的特异性引物分别进行PCR扩增反应。PCR反应体系:cDNA 1 μL,2×TaqMaster Mix 13 μL,10 μmol/L引物各1 μL,加ddH2O至终体积25 μL。反应程序:94 ℃变性4 min;94 ℃变性30 s,退火35 s(退火温度因引物而异),72 ℃延伸60 s,35个循环;72 ℃延伸反应10 min;反应结束后采用1%琼脂糖凝胶电泳对扩增产物进行检测。取PCR产物交至武汉奥科鼎盛生物科技有限公司进行序列测定。

表1 引物序列
采用反转录试剂盒(RevertAid First Strand cDNA Synthesis Kit,Thermo科技有限公司),分别以86份待测草莓品种样品的总RNA为模板,用随机引物反转录合成cDNA,然后采用所设计的特异性引物(表1)分别进行PCR扩增反应。检测每份样品中的病毒感染情况。PCR体系及反应程序同“1.2.2”节。
1.2.3 病毒序列的系统进化分析 将测序所得序列在BLAST (https:∥www.ncbi.nlm.nih.gov/) 进行序列比对,从NCBI中下载相关病毒序列,利用MEGA6.0中的Clustal W进行序列比对,以邻位法(neighbor joining,NJ)进行系统进化分析,构建系统进化树(表2)。

表2 用于3种病毒系统发生树的GenBank登录号和来源
2 结果与分析
2.1 混合样品中病毒的高通量检测
研究表明,测序共获得29 556 977个原始测序量,经过滤共得到26 581 703个高质量序列。此次样品测序数据可作为后续转录本拼接的参考序列。测序结果显示:从草莓资源混合样品中共检测出3种病毒,分别为SMoV、SVBV和SPaV。脱毒苗中并未检测出病毒。
2.2 草莓品种样品的RT-PCR检测
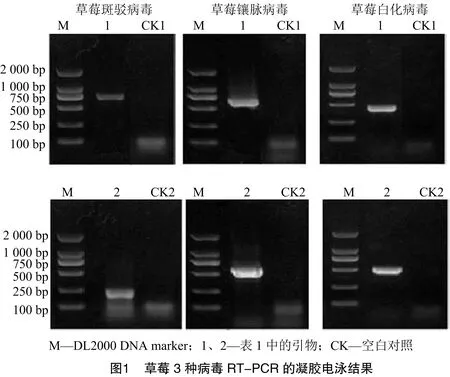
应用“1.2”节设计的每种病毒2对特异引物,以草莓混样cDNA为模板,进行RT-PCR扩增。采用1%琼脂糖凝胶电泳对扩增产物进行检测,得到目的片段,大小与预期相符(图1)。PCR产物测序结果通过DNAMAN与目标序列比对,一致率符合要求。所有高通量测序分析出的病毒均能得到2对特异性引物的验证。
应用本研究设计的引物,对86份草莓样品分别进行RT-PCR 检测,结果表明,在86份草莓样品中,有28份样品检测到病毒,单一病毒侵染样品18份,复合侵染样品10份。其中,11份样品带有SMoV病毒,23份样品带有SVBV病毒,5份样品带有SPaV病毒(表3)。

表3 草莓病毒的RT-PCR检测结果
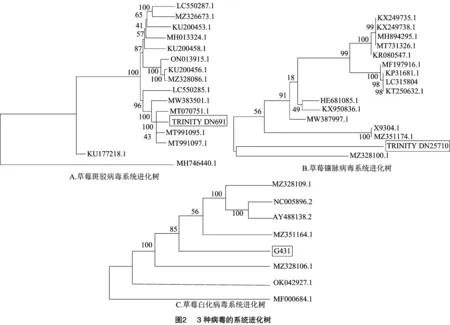
2.3 病毒序列的系统进化树分析
本次测序得到的草莓斑驳病毒的部分片段(TRINITY DN691,6 745 bp),与我国分离物(GenBank NO.MT991095.1、GenBank NO.MT991097.1和GenBank NO.MT070751.1)亲缘关系最近。本次测序得到的草莓镶脉病毒的部分片段(TRINITY DN25710,6 571 bp)与加拿大分离物(GenBank NO. MZ328100.1)亲缘关系最近,与其他分离物亲缘关系相对较远,单独形成一个小支。G431是本次测序得到的草莓白化病毒的部分片段(1 559 bp),单独形成一个小支,但其与美国分离物(GenBank NO. AY488138.2)聚为一个大支。
3 讨论与结论
我国草莓产业发展迅速,草莓栽培面积与产量位居世界第一[23-24]。湖北省是我国草莓重要产区之一,产业规模居全国第5,年产值超48亿元,产区分布于武汉、荆州、襄阳等市县城郊。湖北省作为农业大省,草莓产业是农村种植结构调整的主要选择之一[25]。本研究利用高通量测序和RT-PCR方法,对86份栽培草莓品种进行了较为全面的检测与分析,检测出危害3种草莓的病毒,分别为SMoV、SVBV、SPaV。运用高通量测序技术可以快速确定感病植株所带病毒的种类,根据高通量测序结果所测得的病毒序列设计引物,大大提高了病毒检测的效率。另一方面是高通量测序方法可检测到未在本地发现的病毒,可较全面地检测与鉴定草莓病毒种类。
本研究是首次在湖北地区发现SPaV,此前已在我国福建、河南相继被报道,并已获得SPaV的全基因组序列[26]。系统进化分析结果显示,本研究中检测出的SPaV与我国福建的SPaV亲缘关系较远,而与美国SPaV相对较近,说明SPaV病毒间的变异较大,本研究检出的SPaV与国内其他已报道的来源可能不同。草莓镶脉病毒与草莓斑驳病毒是我国常见的草莓病毒,本次检测出的SVBV与加拿大分离物(GenBank NO. MZ328100.1)亲缘关系最近,而与我国的分离物亲缘关系较远,说明本研究检出的SVBV可能来源于加拿大。SMoV与北京、辽宁和山东地区的亲缘关系较近[27],可能是由国内相关地区传播而来。
前人多应用指示植物鉴定、血清学及 RT-PCR等检测鉴定方法,这些方法局限于只能检测已知病毒,无法发现未知病毒,而高通量测序分析可在样本没有病毒信息的情况下检测出样品中含有的病毒,并可检测到未知病毒,但是检测成本相对较高,也会由于样品中不同病毒含量的差异,导致未能检测出含量低的病毒[28-30]。
利用高通量测序及RT-PCR方法鉴定出本次湖北省草莓资源中的病毒包括3种,分别为草莓镶脉病毒、草莓斑驳病毒以及草莓白化病毒。其中带有草莓镶脉病毒最多,共有23株,其次为草莓斑驳病毒,共10株,复合侵染样品共10份。