植物响应低温的生长发育及分子机制研究进展
吴宇欣, 蔡昌杨, 唐诗蓓, 谢裕红, 王晓艳, 朱 强
(1.福建农林大学林学院,福建福州 350000; 2.福建省将乐县林业局,福建将乐 353300;3. 福建省三明市林业科技推广中心,福建三明 353000)
植物在生长过程中,经常会受到多种非生物胁迫的影响,例如冷、热、干旱、重金属和盐胁迫等;这些非生物胁迫会限制植物的地理分布范围并降低其生产力[1]。低温胁迫对植物影响巨大,会破坏植物的质膜结构,降低植物光合作用能力,过量累积活性氧(ROS),使植物的生长发育出现迟缓甚至停滞等现象[2-4]。
在漫长的演变进化过程中,植物形成了一系列复杂高效的网络调控机制,来应对低温带来的威胁。随着分子生物学技术的不断发展,植物应对寒冷胁迫的机制已逐渐明晰[5]。在生理生化水平上,植物生成了可溶性糖、脯氨酸、多胺类化合物等一系列渗透调节物质,来稳定细胞膜结构和清除活性氧[6-7]。另外,大量蛋白激酶和转录因子在冷应激信号通路中发挥着作用[8-9]。CBF/DREB1(C-Repeat Binding Factor/Dehydration-Responsive Element-Binding Protein 1)是其中最关键的调节因子[10]。在冷胁迫下,CBF基因受上游的ICE1(Inducer of CBF Expression 1)诱导而大量表达,催化冷调节(COR)基因表达来调节冷应激[11]。与CBF(C-Repeat Binding Factor)依赖型信号途径相比,非CBF依赖型信号途径也发挥着重要作用。例如,sfr6(sensitivetofreezing6)基因在不诱导CBF基因的情况下,直接调控下游COR基因的表达[12]。同时,冷胁迫相关基因在转录、翻译和翻译后修饰方面也发挥着关键作用[13]。本文对近年来植物响应低温胁迫调控机制的相关研究进行综述,并概述目前利用基因工程手段提高经济作物抗寒性的研究进展,以期为更深入地研究植物低温胁迫响应机制提供理论基础,并为培育抗寒能力优秀的新品种奠定一定基础。
1 植物对低温胁迫的生理生化响应
1.1 冷驯化现象
低温胁迫包括冷害(0~20 ℃)和冻害(<0 ℃),对植物的正常生长发育具有不良影响[14]。冷害是热带及亚热带地区植物遭遇的主要胁迫方式,严重影响水稻、玉米、大豆等农作物的生产;而冻害则主要影响温带地区植物,对小麦、油菜等作物产生不利影响[15]。为了应对低温胁迫带来的不良影响,一些物种在不良环境中逐渐提高自身的耐冻能力,这种现象被称为冷驯化[15]。植物在冷驯化过程中,会重新调节光合作用过程和碳水化合物代谢途径,对转录和蛋白质进行重新调控,修复细胞损伤或死亡造成的失衡[16]。同时,植物体内生成一些关键的渗透调节物质,例如可溶性糖、脯氨酸、可溶性蛋白、多胺类化合物等,用来抵抗脱水现象并减少冷应激对细胞的损害[17-21]。过氧化物酶(POD)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、抗坏血酸过氧化物酶(APX)、谷胱甘肽过氧化物酶(GPX)等一些抗氧化物酶也在植物体内大量累积,以减轻活性氧(ROS)引起的过氧化损伤[19,22]。此外,植物也通过调节一些激素代谢途径,例如增加赤霉素、细胞分裂素、生长素、茉莉酸等一些激素的水平,来增强植物对非生物胁迫的耐受性[23-24]。
1.2 低温对植物的生理影响
植物在受到低温胁迫后,其体内的各项生理生化指标和细胞器形态会发生很大改变[25]。在低温胁迫下,植物许多细胞的生理生化功能会随着细胞膜及脂质的变化而变化,如细胞内离子的泄露、氨基酸的流失、各种细胞成分的结构变化,最终会导致植物坏死或死亡[26]。
首先,遭受低温影响时,植物的表型会发生改变。当植物受到低温胁迫时,气孔开始闭合,致使CO2滞留在气孔腔中,无法与外界进行交换,从而影响光合作用的进行;同时,参与蔗糖和淀粉生物合成的某些关键酶受到损伤,例如核酮糖-1,5-二磷酸羧化酶(RuBisCO)发生失活,直接抑制线性电子传输并限制光合产物的数量[27]。此外,低温直接影响叶绿体的结构、功能和发育。当植物暴露在低温下时,参与卡尔文循环(Calvin Cycle)的2种关键酶景天庚酮糖-1,7-二磷酸酶(SBPase)、果糖-1,6-二磷酸酶(FBPase)的活性明显降低[3]。这些结果说明,低温通过影响植物的呼吸作用和化合反应中关键酶的合成,使植物的光合作用受到限制,最终导致植物生长发育缓慢,植株矮化,叶片萎蔫,根系生长受损,作物结实率低,产量下降。
其次,受低温胁迫影响期间,植物细胞中可溶性糖的水平会有所增加。可溶性糖在植物体内起渗透保护剂的作用,当其在细胞中积累时,渗透浓度增加,致使低温引起的细胞收缩效应减轻,从而起到保护细胞膜免受脱水和冷冻损害的作用[28]。在渗透调节方面,脯氨酸也发挥了重要作用。脯氨酸是一种在植物中广泛存在的氨基酸,具有独特的细胞功能,不仅参与植物的发育与代谢,还在防御和胁迫耐受性方面发挥重要作用[29]。植物处于低温环境中会产生大量的脯氨酸,可以清除产生的过量氢离子(H+)以维持有氧呼吸的平衡,并稳定多聚核糖体来提高蛋白质的亲和性,进而提高植物抵御不良环境的能力[30]。总之,这些渗透调节物质通过维持细胞内渗透水平的平衡,来抵抗低温胁迫带来的不良影响。
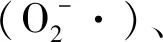
最后,低温胁迫会导致植物细胞膜的损坏。低温环境中,植物组织中开始形成冰晶[34]。首先是细胞外空间开始结冰导致渗透压下降,进而使细胞脱水,最终导致细胞质膜结构异变和电解质泄漏增加[35]。随着低温的持续刺激,细胞最终破裂,细胞质流出体外,细胞质膜损伤,最终导致植物死亡。
2 植物低温胁迫响应的分子机制研究
在长期的生长发育过程中,植物进化出一系列复杂的网络调控机制来应对低温胁迫,主要包括CBF依赖型信号途径和非CBF依赖型信号途径。
2.1 CBF依赖型机制
目前,已有大量研究探索了植物对寒冷的调节机制。其中,CBF途径是植物应对低温胁迫最关键的调控途径[36]。而ICE1(Inducer of CBF Expression 1)-CBF(C-Repeat Binding Factor)-COR(Cold Regulated)信号级联通路,是当中最重要的低温信号通路[37]。在低温胁迫条件下,转录因子ICE1与CBF基因的启动子区域结合,激活CBFs的表达,被激活后的CBFs进一步激活下游COR基因的表达,以此增强植物的抗寒性[38]。
2.1.1 ICE1-CBF-COR调控途径 调节低温胁迫信号最典型的转录因子是C重复结合因子/脱水响应元件结合蛋白(C-Repeat Binding Factors/Dehydration Responsive Element Binding Protein,CBF/DREB),它属于在植物生长发育及非生物胁迫反应方面发挥作用的AP2/ERF超蛋白家族ERF家族中的一个亚家族,仅包含1个AP2结构域[39]。其成员CBF1、CBF2、CBF3(DREB1B、DREB1C、DREB1A)已被证实参与低温胁迫反应过程,当植物处于低温条件下能够在短时间内被诱导[40]。研究证明,3种CBF蛋白有着非常高(86%)的序列相似性,虽然都是受冷响应的诱导,但这3种CBF蛋白还存在着功能冗余[41]。CBF1、CBF3蛋白在功能上更相似,而CBF2蛋白在表达模式上相较于其他2个CBF有所不同。在发育早期,CBF1、CBF3会在植物的根、下胚轴、子叶中特异性表达;而CBF2则是在下胚轴、子叶中表达,在根中无法表达[42]。有研究证明,在CBF2突变体中,CBF1、CBF3基因的表达量增加,表现出对冷冻的耐受性增加,这表明CBF2是CBF1、CBF3表达的负调节因子[43]。
CBF基因通过其AP2/ERF DNA结合域,与下游靶基因启动子中存在的CRT/DRE顺式元件(A/GCCGAC)结合,并激活下游COR基因的转录以增加耐寒性[44]。冷调节(COR)基因在受到调节后,会生成一些抗冻多肽、转录因子、蛋白激酶、与胚胎发生和脂质代谢相关的蛋白质以及与激素反应和细胞壁修饰有关的蛋白质等,这些产物可以帮助植物在低温胁迫下稳定细胞膜的结构,从而增强其耐寒性[45]。
在冷响应级联通路的上游,存在bHLH转录因子家族的成员ICE1(Inducer of CBF Expression 1),它是一种MYC型碱性螺旋-环-螺旋转录因子,在C端含有保守的bHLH结合结构域,用以与下游的CBF3/DREB1A启动子中的典型MYC顺式元件(CANNTG)结合,正向诱导CBF3/DREB1A调节子的表达,而CBF1、CBF2基本上不受影响[46]。而ICE1的同源物ICE2与ICE1在序列上有高度一致性,编码相同的bHLH结构域序列。ICE1、ICE2均为气孔形成的主要调节因子,并且在调节冷反应过程中发挥重要作用[47]。目前研究表明,ICE1、ICE2存在着功能冗余,在诱导CBF基因方面具有不同的方式。ICE1、ICE2通过诱导CBF2来分别调节CBF3、CBF1的表达,降低植物的冷冻耐受性[48]。
2.1.2CBF转录调控的正调控作用 低温胁迫响应过程涉及一系列转录途径,一些组成型表达的转录因子能够在对寒冷的反应中被激活表达。试验证明,这些转录因子会正向诱导下游CBF基因的转录。例如,ICE1是CBFs的正调节因子,它能够与下游基因CBF3启动子中的MYC识别位点结合,来调控CBF3表达。ice1突变体中CBF3的表达能力降低,与野生型相比,该突变体耐寒性大大降低,不能进行冷驯化[46]。过表达ICE1则大大提高了CBF1、CBF2、CBF3、COR基因的表达,增强了植物的抗冻性[49]。参与信号传导的钙调蛋白结合转录激活因子(CAMTA)的转录因子家族也是CBF的正调控因子,会对温度快速下降做出反应[13]。其具有一个特异性DNA结合活性的CG-1结构域,能够正向调节CBF2启动子中的CM2元件,强烈诱导CBF1、CBF2的表达[50]。油菜素唑耐受因子1(Brassina-Zole-Resistant1,BZR1)是油菜类固醇信号通路中的关键转录因子,与靶基因启动子中的BRRE(CGTGT/CG)和E-box(CACGTG和CACTTG)基序结合,促进CBFs、WRKY6、WRKY54以及脱落酸(ABA)受体PYL6等编码基因的表达,正向调控植物的耐寒性[51]。同时,BZR1的蛋白质水平和磷酸化状态依赖油菜素内脂(BR)信号传导中上游的GSK3样激酶BIN2(BR-Insensitive 2)的影响,在没有BRs的情况下,具有活性的BIN2磷酸化BZR1并促进其降解,增加植物的冷冻敏感性[52]。
2.1.3CBF转录调控的负调控作用 除了正向调控以外,信号通路中还存在多个降低植物抗冻性的CBFs负调节因子。MYB转录因子家族成员MYB15被证实能够与ICE1发生作用,并与CBF启动子元件结合。在冷胁迫下,MYB15表达上调,过表达MYB15显示CBF基因转录水平降低,而在MYB15突变体中显示CBF3、CBF1、CBF2水平增加,表明MYB15参与了CBF基因的冷调节过程,降低了植物的低温胁迫耐受性[53]。C2H2锌指蛋白基因ZAT12(ZincFingerTranscriptionFactor12)通过抑制15个冷响应基因和激活9个冷响应基因的表达,来调节冷驯化。ZAT12还下调CBFs基因的表达,表明它在植物适应低温胁迫中起负调控作用[54]。乙烯信号通路中的转录因子EIN3(Ethylene-Insensitive3)会对耐寒性产生负面影响。EIN3蛋白与CBF3启动子中特定的结合基序结合,阻止其转录,同时细胞分裂素信号通路中的A型调节因子ARR5、ARR7、ARR15被证实是EIN3的下游靶基因。在过表达EIN3的转基因植物中,ARR5、ARR7、ARR15的转录和蛋白稳定性受到明显抑制,说明EIN3通过联合乙烯和细胞分裂素信号传导途径,在冷应激反应中发挥拮抗作用[55]。
2.2 非CBF依赖型机制
CBF及其靶基因对于冷胁迫信号至关重要,但仍然发现有一些基因是不依赖CBF途径的,它们功能的增加或缺失不会影响CBF基因功能的表达,但会使植物的抗冻能力升高或下降。例如,HY5(ElongatedHypocotyl5)是一种参与光信号传导的bZIP类转录因子,当受到低温胁迫影响时,E3泛素连接酶COP1(Constitutively Photomorphogenic 1)促进HY5的稳定表达,通过非CBF依赖型途径正向调节下游COR基因的表达[56]。SFR6(SensitivetoFreezing6)基因被证实通过CRT/DRE启动子序列基序调节下游的COR基因;在冷冻敏感突变体sfr6中,COR基因包括KIN1/2、LTI78、COR15A等的表达水平显著降低[12];而在sfr6突变体中,CBF1、CBF2、CBF3的冷诱导表达则不受影响[57]。HOS9(HighExpressionofOsmoticallyResponsiveGene9)作为一种组成表达的基因,通过冷诱导表达,会使RD29A和其他一些COR基因的转录水平明显高于野生型;而在突变体hos9-1中,CBF转录因子基因的表达没有受到影响,却仍表现出冷冻应激的敏感性[58]。
2.3 转录后调控
低温胁迫在植物中诱导广泛的转录后和翻译后修饰(PTM),对生成mRNA的质量和数量造成影响,使基因功能发生改变,最终影响植物的低温胁迫耐受性。转录后调控在冷驯化过程中起着至关重要的作用。例如,STA1(Stabilized1)作为mRNA前体的剪接因子,参与mRNA的剪切以去除内含子,使基因得以正常表达。而sta1-1突变体在冷诱导COR15A基因的剪接中存在缺陷,使得COR15A基因无法正常表达,降低了植物的耐寒性,这说明STA1的表达对植物的耐寒性起着关键作用[59]。核孔蛋白NUP160(Nucleoporin 160)在控制RNA核胞质转运中发挥重要作用。拟南芥nup160突变体中CBF3的表达受到抑制,并且破坏细胞核的mRNA输送过程,说明NUP160在植物生长、开花时间调节和低温胁迫耐受性中起重要作用[60]。渗透反应因子LOS4(Low expression of osmotically responsive gene 4)编码DEAD-box RNA 解旋酶,该解旋酶参与RNA的代谢过程,LOS4突变体会负向调控CBFs表达,降低RD29A和其他COR基因的表达,从而负调节植物的抗寒性,说明LOS4是CBF基因的正调节因子,并且在基因调控和植物耐寒性方面发挥关键作用[61]。
2.4 翻译后调控
在翻译后修饰(PTM)过程中,几个基因与ICE、CBF、COR基因相互作用,以改变其活性、构象、定位和稳定性。磷酸化、泛素化和SUMO偶联是植物调节低温胁迫反应途径的主要PTM[62]。植物受到冷胁迫时,ICE1受到翻译后修饰,进而影响CBF或其他下游基因的表达。
2.4.1 磷酸化修饰 磷酸化在植物冷适应中起重要作用,是一种可逆的蛋白质修饰,对激酶和磷酸酶具有高度依赖性[11]。最常见的磷酸酶OST1(Open Stomata 1)/SnRK2.6/SRK2E是 ABA 信号传导中的丝氨酸/苏氨酸 (Ser/Thr)蛋白激酶,可以磷酸化ICE1基因,帮助其增加转录稳定性。同时,OST1蛋白还通过干扰HOS1蛋白与ICE1蛋白的结合,来抑制HOS1介导的ICE1降解,双重作用下增强CBF基因的活性,来缓解冷应激效应[63]。除OST1外,丝裂原活化蛋白激酶(Mitogen-Activated Protein Kinase,MAPK)级联也通过磷酸化作用参与植物低温胁迫反应。MAPK是一组能被细胞因子、神经递质、激素、细胞应激及细胞黏附等细胞外刺激激活的丝氨酸-苏氨酸蛋白激酶。其级联过程由MAPK激酶激酶(MAP Kinase Kinase Kinase,MAPKKK)、MAPK激酶(MAP Kinase Kinase,MAPKK)和MAPK组成[64]。在植物感知外界信号刺激后,首先MAPKKKs磷酸化并激活MAPKKs,激活的MAPKKs随后磷酸化MAPKs,最后活化的MAPKs磷酸化特定的下游底物,如转录因子、激酶或其他酶等,共同调控植物的生长和发育、生物和非生物胁迫反应以及植物激素信号转导等过程[65]。响应寒冷的级联包括MEKK1、MKK2、MPK4和(或)MPK6激酶[66]。受到冷胁迫后MEKK1被上调,MEKK1激活下游的MKK2,MKK2的直接下游靶标MPK4被MKK2特异性磷酸化和激活,同时MPK3、MPK6也因冷处理而被激活[67]。活化的MPK3/MPK6级联通路通过在Ser94、Thr366、Ser403位点处磷酸化而促进ICE1的降解,从而减少CBF基因的转录来实现负调控,而MEKK1-MKK2-MPK4级联则是正向调节冷反应,并会对MPK3、MPK6激酶活性造成抑制[68]。
2.4.2 泛素化和SUMO化修饰 泛素化是指泛素分子在一系列特异性酶作用下,将细胞内的蛋白质进行分类,选中特定的靶蛋白,对其进行特异性修饰的过程[69]。泛素化修饰涉及泛素激活酶E1、泛素结合酶E2、泛素连接酶E3所连接的一系列酶促反应。其中,E3-泛素连接酶通过与靶分子相互作用并为泛素化反应提供支架而起最重要的作用[70]。HOS1(High Expression of Osmotically Responsive Gene 1)是一种功能性无名指蛋白,具有泛素E3连接酶活性,包含一个变异型RING指结构域,靶向ICE1进行泛素化介导的蛋白质降解,负调控CBF的表达,最终降低植物的耐寒性[71]。
另外一种蛋白翻译后的修饰方式为SUMO化修饰。SUMO分子通过在E1活化酶、E2结合酶、E3连接酶级联与靶蛋白偶联,调控靶蛋白的结构与功能[72]。而SUMO修饰蛋白SENPs与SUMO分子共同调节受体蛋白的SUMO化状态,特异性地对底物蛋白进行去SUMO化修饰,进而改变细胞功能[73]。目前,SUMO化修饰在控制细胞周期、维持基因组完整性、控制亚细胞运输和调控转录机制等方面发挥着重要作用[74]。SIZ1(SUMO ligase)是一种SUMO E3连接酶,介导与ICE1的偶联,在低温下增强ICE1的稳定性,有助于诱导CBF3/DREB1A的表达,正向调节植物的耐寒性[75]。
基于以上对植物响应低温胁迫信号相关研究进行的综述,归纳出植物响应低温胁迫信号转导途径的分子机制模式图(图1)。

3 利用基因工程改良植物抗冷性的相关研究进展
受温室效应的影响,极端天气频频发生。在农业生产过程中,农林类作物常常遭受低温侵袭,生理发育过程遭到破坏,作物生长不良,最终造成结实率低、产量下降甚至植株死亡。随着全球人口的不断增加,人们对各种作物产品特别是粮食的需求越来越大[78]。利用基因工程手段改良植物的抗逆性,并培育抗寒能力优越的品种,收获更多的作物产量,对农业发展及社会经济增长具有重要意义。
研究表明,在水稻中过表达bZIP73、bZIP71,二者形成异二聚体,可以抑制ABA生物合成,促进从花药到花粉的可溶性糖转运,从而提高水稻在生育期的抗寒性,最终提高结实率和籽粒产量[79]。过表达DREB1A的转基因水稻,可以增加脯氨酸和各种糖类等渗透保护剂的含量,提高水稻对干旱、高盐、低温胁迫的耐受性[80]。水稻中表达R2R3-MYB转录因子家族中的OsMYB2则增强植物对盐、低温、脱水胁迫的耐受性,并提高种子萌发率,积累更多的可溶性糖和游离脯氨酸,以促进渗透调节,提高水稻抗寒性[81]。过表达NAC转录因子家族成员SNAC2基因,则可以帮助水稻增强细胞膜的稳定性,提高对渗透胁迫的耐受性,并生成一系列过氧化物酶、鸟氨酸氨基转移酶、赖氨酸酮戊二酸还原酶、重金属相关蛋白、钠/氢交换剂、热休克蛋白、GDSL样脂肪酶等产物,最终使植株出现对寒冷、盐、脱水胁迫耐受性显著提高的表型[82]。研究表明,核小GTP酶RAN2在植物体内主要起介导细胞核中GTP和细胞质中GDP交换的作用,因此在水稻中过表达RAN2基因,可以促进植物细胞核内微管蛋白的正常输出,从而维持稳定的细胞分裂,最终提高水稻的抗寒性[83]。
研究表明,在玉米中过表达ZmbZIP4,与野生型相比,转基因植物的侧根数量明显增加,植物的主根变得更长,其根系得到改善,并且生成了许多应激反应基因和脱落酸合成相关基因来增加植物抵抗非生物胁迫的能力[84]。过表达ZmMYB31基因则提高了玉米体内相关冷应激基因的表达,并且降低了在冷胁迫中造成的离子外渗、ROS含量、低温光抑制现象,从而在寒冷和过氧化物胁迫中发挥正向调控作用[85]。ZmICE1基因能够抑制Glu/Asn生物合成基因天冬酰胺合成酶的表达,来减少ROS的产生,并可以直接调控DREB1的表达,且ZmICE1启动子与正调节因子ZmMYB39结合,均可显著增加玉米的抗寒性;过表达ZmICE1对玉米产量相关性状没有明显的负面影响,表明过表达ZmICE1基因既可培育耐寒玉米新品种,又不会对玉米产量造成影响[86]。
有关转基因小麦和大麦的研究进展表明,从小麦的HD-ZipⅠ基因中克隆出HDZI-3、HDZI-4启动子,成功优化转基因小麦和大麦中TaCBF5L、TaDREB3基因在非生物胁迫下的表达,可以提高转基因植物的抗寒性,并减少转基因对植物发育和籽粒产量的负面影响[87]。克隆出水稻的WRKY71基因启动子和小麦的Cor39基因启动子优化TaDREB3的表达,构建大麦转基因株系;与野生型相比,过表达TaDREB3明显提高了大麦的抗冻性,并提高了冷响应基因的表达量,同时没有对植物特性和籽粒产量产生负面影响[88]。从小麦中分离出DREB/CBF基因TaRAP2.1L,作为一种胁迫响应型转录抑制因子,生成的TaRAP2.1L突变体植株可以激活DREB/CBF下游基因的表达,从而增强小麦抗冻和抗干旱能力,同时没有对小麦的生长和生产造成负面影响[89]。
在番茄中过表达冷调节基因LeCOR413PM2(Cold-Regulated413-PlasmaMembrane2),可减轻植物细胞膜的损伤,降低植物体内ROS的积累和PSⅡ的光抑制现象,而且可以维持体内抗氧化酶的高活性和渗透调节物质的含量,从而提高转基因番茄植株的耐寒性[90]。HY5-MYB15-CBFs转录级联反应已被研究证实在番茄的冷反应中起重要作用,当在番茄中过表达HY5或MYB15基因时,均能激活CBF1、CBF2、CBF3的表达,从而增强番茄作物的耐寒性[91]。在番茄中过表达油菜类固醇受体SlBRI1(BrassinosteroidInsensitive1),则可以降低MDA、ROS的积累,提高SOD、POD、CAT的活性。并且在过表达SlBRI1的转基因植株中,ICE1、CBFs相关基因表达量明显增高,说明SlBRI1通过影响ICE1-CBF-COR途径的转录水平,并正向影响ROS清除系统、光系统的光抑制以及植物激素的生物合成和信号传导,来增加番茄对寒冷压力的耐受性[92]。而在番茄中过表达SlDREB3,可以帮助番茄在冷应激下减轻ROS积累和因冷冻引起的细胞损伤,与此同时,还可通过激活SlLEA基因的表达,提高转基因品系对低温胁迫的耐受性[93]。
4 总结与展望
低温胁迫作为一种主要的非生物胁迫,对植物影响巨大,是影响全球农林作物生长及生产的主要因素之一;对相关农作物进行耐低温能力研究,对于粮食生产及社会的可持续发展具有重要意义。到目前为止,植物的耐寒机制研究已经取得重大突破,其中ICE1-CBF-COR信号级联通路在植物抗寒方面起着至关重要的作用。本综述总结了植物在耐寒性方面所发挥的多重调控作用,包括CBF依赖型信号途径和非CBF依赖型信号途径,并着重介绍了关键转录因子CBF在植物感知低温信号过程中发挥的功能及其依赖于CBF信号通路对于植物平衡生长、发育和对低温胁迫响应方面的所发挥的作用。目前,基因工程技术已广泛应用于改良植物性状,将外源基因通过转化插入植物的基因组中,定向改变植物的功能性状,同时克服了传统育种的周期长、效率低等弊端[94]。本文归纳了多个农业作物物种(水稻、小麦、番茄等)利用基因工程技术在抗寒性方面已经取得的成就,旨在为今后改良植物抗性研究提供一定基础。
由于低温胁迫影响植物从体外到细胞的各个方面,形成了错综复杂的信号网络,需要从细胞、蛋白、代谢等水平对其进行研究,因此仍需要进一步研究揭示冷驯化过程中植物通过感知环境变化来调整自身发育的机制。随着温室效应的逐年增强,极端环境出现的频率越来越高,因此对植物进行更多的抗寒性研究,提高植物抗寒冷的能力,进而培育出抗冻能力优越的植物新品种和种质资源,仍具有非常重要的意义。

