数字化导板引导CGF联合Bio-Oss骨粉充填颌骨囊肿的临床研究
张 浩,张新风,祁雨晨,胥加斌,司亚萌
颌骨囊肿是口腔颌面部最常见的疾病之一,常引起颌骨骨质的破坏,并导致局部疼痛、肿胀以及牙齿松动,当累及下牙槽神经时可伴发下唇麻木等症状[1]。颌骨囊肿最常用的治疗方案是囊肿摘除术,当术后遗留的骨缺损较大时,不但容易感染,而且骨再生时间较长,可能影响颌骨的形态及功能。如何精准确定颌骨囊肿手术的开窗去骨范围,在尽可能保留正常骨组织的情况下,彻底清除病灶,并加快骨缺损修复速度,提高成骨质量,已成为当前临床急需解决的问题。
临床上常用骨组织或骨替代材料,尤其是Bio-Oss骨粉充填囊肿摘除术后骨缺损区,以加快和提高囊肿术后骨缺损的修复速度和成骨质量,但其骨诱导性差等特点使其使用也受到一定的制约[2]。CGF作为第三代血小板浓缩制品,含有大量生长因子及纤维蛋白原,可以促进软组织、骨组织及血管组织修复再生[3-5]。本研究通过术前制作数字化导板精准定位囊肿去骨范围以显露并去除病变组织,将CGF联合Bio-Oss骨粉填充于骨缺损区,通过记录短期术后炎性反应、疼痛等症状,并测定长期新生骨骨密度变化,客观评价该治疗方法在囊肿摘除及术后加快骨缺损修复中作用,现报告如下。
1 资料与方法
1.1 一般资料
选取2021年9月至2022年9月在徐州医科大学附属口腔医院口腔颌面外科行颌骨囊肿摘除术的64例患者为研究对象,纳入标准:①年龄18~30岁,最大直径2.0~3.0 cm的颌骨囊肿;②根管治疗囊肿波及的病灶牙,拔除无法保留患牙;③既往未对囊肿部位进行过手术治疗;④身体状况良好,口腔健康;⑤定期接受随访。排除标准:①妊娠或哺乳期;②糖尿病、甲状腺疾病、骨代谢疾病等综合性全身性疾病;③服用钙剂、双膦酸盐、糖皮质激素或其他可干扰骨代谢的药物的患者;④牙周病、牙髓病和其他口腔疾病无法控制的患者。其中4例患者因自身原因退出研究或未定期随访被剔除,最终纳入60例患者,随机分为实验组(20例)、对照组1(20例)和对照组2(20例)。
3组患者临床资料相比,差异无统计学意义(P>0.05)(表 1)。该研究经徐州医科大学附属口腔医院伦理委员会批准(伦理审查号:2021-016),所有研究对象均签署知情同意书。

表1 3组患者基本临床资料
1.2 手术方法
1.2.1 制备术前导板 所有患者均接受CBCT(PlanmecaProMax®3D Plus)检查,扫描参数120 kVp,5 mA,14.7 s,层距0.2 cm,层厚0.2 cm。实验组和对照组1患者用藻酸盐印模材料制作患者牙列印模,并用硬石膏浇注获得患者的牙列石膏模型。激光扫描仪以STL格式扫描石膏模型并导出保存。将术前拍摄CBCT影像以DICOM格式数据导入Mimics Research 21.0软件,根据图像数据的不同阈值,将囊肿与周围的组织分离,建立颌骨囊肿骨质破坏区三维重建模型。在3-matic软件中将三维重建模型与颌骨石膏模型的三维数据进行配准融合,测量病变范围的三维数据和体积,颊舌侧牙槽骨厚度,与邻牙的距离,设置颌骨牙列模型的透明度,建立可视化的颌骨囊肿三维模型。导板设计为牙支持式。导板定位孔的大小以可完全去除病变组织的最小开窗去骨范围为设计原则,同时外侧边缘可以指引避让邻牙、下颌神经管等重要解剖结构。最后将模型数据导入三维打印机,精准制作手术导板,患者术前试戴确认合适后进行低温消毒灭菌(图1)。

A:术前数字化导板设计;B:制作完成的数字化导板;C:术中安放数字化导板;D:根据数字化导板磨除颌骨囊肿表面骨质
1.2.2 制备CGF CGF在全身麻醉诱导前15 min制备。根据颌骨囊肿大小,取自体外周静脉血并置于试管(无抗凝剂)中。将试管立即按照以下程序置于离心机中:加速30 s,2 700 r/min离心2 min,2 400 r/min离心4 min,2 700 r/min离心4 min,3 000 r/min离心3 min,减速36 s至停止。离心13 min后,血液分为3层,试管中的中间层为CGF凝胶。将CGF凝胶用眼科剪剪切成约1 mm的小块,与Bio-Oss骨粉拌匀备用。
1.2.3 手术及术后处理 所有患者均在全麻下由同一名医生行颌骨囊肿摘除术,实验组和对照组1患者按术前规划手术入路切开牙龈,用骨膜剥离子牵引开黏膜骨膜瓣,确保导板到位,按照导板上开窗口的范围,使用涡轮机去除该处骨皮质,显露囊肿边界,并沿囊壁外侧尽可能完整剥离残留囊壁组织。对照组2不使用导板进行常规手术。实验组将剪碎的CGF与Bio-Oss骨粉充分混合,充填于骨腔。对照组1和非导板组仅以Bio-Oss骨粉充填骨腔。3组均以海奥膜覆盖骨腔,覆盖范围至缺损骨边界外3 mm,严密对位缝合软组织瓣。使用漱口液保持口腔卫生。
1.3 观察指标
1.3.1 实验室检测 取患者术前1 d、术后24 h和术后72 h空腹状态下静脉血4 mL,以3 000 r/min转速离心10 min后,提取血浆,用酶联免疫吸附实验法检测C-反应蛋白(CRP)水平。并采用血球分析仪检测外周血白细胞计数(WBC)水平。
1.3.2 手术时间及术后疼痛评估 记录从牙龈切开翻瓣至对位缝合组织瓣结束需要的时间。应用视觉模拟评分法(VAS)评估患者术后1、3、5 d的疼痛程度,分数为0~10分,分数越高则说明患者疼痛较明显。
1.3.3 囊腔灰度值变化 将每名患者术前、术后即刻、3、6个月的CBCT数据以DICOM格式导入Mimics软件,3D重建计算骨腔灰度值,评价骨缺损区的成骨修复效果[6]。所有数据均由同一测量者测量3次并取其平均值。
1.4 统计学分析
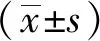
2 结 果
2.1 3组患者血浆CRP、全血WBC比较
3组患者术后24 h、72 h血液CRP、WBC水平均明显高于术前,实验组术后炎症反应显著低于其他两组,对照组1炎症反应(CRP)也显著低于对照组2,且有统计学差异(P<0.05)(表2、3)。

表2 3组血浆CRP在治疗期间的变化
2.2 3组患者手术时间及术后疼痛
实验组和对照组1患者手术时间明显短于对照组2,差异具有统计学意义(P<0.05),实验组和对照组1之间无明显差异。3组患者术后第1天疼痛明显,且实验组和对照组1疼痛程度明显低于对照组2,差异具有统计学意义(P<0.05),患者术后第5天疼痛明显减轻,3组无差异(表4)。

表4 3组患者手术时间和术后疼痛比较
2.3 3组患者术前及术后3、6个月的骨密度比较
术后3个月、6个月,实验组骨密度均明显高于其他两组,且有统计学差异(P<0.05),对照组1和对照组2之间无显著差异(表5)。术后3个月实验组较其他两组骨缺损区边缘与周围正常骨质间的界限更为模糊,6个月则形成更多的骨小梁结构,并且骨密度更加均匀(图2)。

A:实验组术前;B:实验组术后3个月;C:实验组术后6个月;D:对照组1术前;E:对照组1术后3个月;F:对照组1术后6个月;G:对照组2术前;H:对照组2术后3个月;I:对照组2术后6个月。三组病例均为根尖囊肿,箭头所示为病变区域

表5 3组术后骨缺损填充区域CT值
3 讨 论
颌骨囊肿按组织来源可以分为牙源性和非牙源性囊肿,根尖囊肿约占所有牙源性囊肿的60%而鼻腭囊肿约占非牙源性囊肿的80%。在临床中牙源性囊肿较为常见[7],本研究与其结论相符。
囊肿摘除术常需磨除大量骨组织,虽然可以使囊腔充分暴露,但会导致骨组织过度丧失,不利于术后成骨,并造成局部颌骨的塌陷畸形,可能影响患者的生理及心理健康[8]。在囊肿摘除的实际操作中,无法仅依靠CBCT影像将术前设计的手术去骨开窗位置、方向等精准地转移到患者口内。因此,实际开窗去骨位置与预想位置发生偏差不可避免,严重者甚至会造成重要解剖结构的损伤。数字化导板是将患者术前CBCT数据导入设计软件中,通过设计、模拟手术过程,精准定位囊肿位置,精确设计出开窗去骨大小及方向,并根据上述设计信息三维打印的技术[9-10],符合现代外科微创、精准的要求。本研究发现,实验组和对照组1通过导板可快速定位囊肿,较行常规手术的对照组2手术时间显著缩短。
颌骨囊肿摘除术后,由于囊壁周围含有充足的血液供应和骨化所需的细胞因子,促进骨腔的血管化。随着新生血管的形成,胶原基质在血管周围沉积,成骨细胞分泌和矿化功能活跃,使新骨不断形成[11]。有研究表明颌骨囊肿术后成骨效率与组织来源无关,与囊肿大小和术后时间密切相关[12]。但这种自发成骨不是无限制的,Stoor等[13]通过研究发现当囊肿直径>2 cm时,囊腔内大量血凝块形成,其中央多缺乏血供,容易发生液化,增加感染的风险,不利于囊腔成骨。在没有任何骨填充材料的情况下,研究表明自发性骨愈合指数在术后6个月为12.34%,而术后12个月则为43.46%至81.30%[14]。这些结果表明自发性骨愈合无法完全成骨。作为替代方案,骨移植材料越来越受到关注。理想的骨再生支架材料应具有骨传导性、骨诱导性、骨生成性和适当的机械强度[15]。目前,亲水性强、生物相容性高、可塑性好的Bio-Oss骨粉,越来越广泛地应用于填充囊肿摘除术后的骨腔,以诱导新骨形成。但由于其缺乏生长因子成分,所以单独使用Bio-Oss骨粉成骨效果欠佳。
CGF是将贮存在血小板α颗粒中的生长因子通过差速离心释放出来,这些生长因子在组织修复再生中扮演重要角色。一些学者研究发现,CGF通过PI3K/AKT信号通路,能显著促进成骨细胞增殖,加快矿化结节的沉积[3,16]。另有研究表明CGF也可以促进干细胞的分化成骨[17]。此外有研究发现CGF可通过YAP通路上调干细胞中血管内皮生长因子的表达促进骨缺损区新血管形成[18]。为了充分发挥CGF的优势,本实验将CGF与Bio-Oss骨粉结合,更好地促进术后骨组织再生。
骨组织再生会经历三个连续且重叠的阶段:早期炎症阶段、修复阶段及后期重建阶段,如果早期炎症反应过强,会抑制干细胞的迁移和成骨分化,也会干扰新生血管的形成,最终影响骨组织修复。有越来越多的证据表明CGF可以抑制脂多糖诱导的炎症反应,具有抗炎特性[19-22],可以促进骨组织由炎症阶段向修复阶段过渡。本研究中,术后实验组CRP、WBC浓度及术后疼痛程度显著低于其他两组,且对照组1的早期炎症反应及疼痛程度也显著低于对照组2,表明CGF能够抑制早期过强的炎性反应,缩短炎症持续时间,减轻术后疼痛肿胀反应,也印证了上述观点。此外术中通过使用数字化导板,缩短手术时间、减轻对周围组织的损伤,也是术后炎性反应和疼痛程度降低的原因之一。本研究还发现,实验组患者术后3、6个月骨缺损填充区域灰度值均明显高于其他两组,对照组1和对照组2之间无显著差异。提示CGF联合Bio-Oss骨粉在颌骨囊肿术后骨缺损区中的骨愈合修复效果较为理想,分析原因可能是将CGF与Bio-Oss骨粉混合置于颌骨缺损处,CGF释放的生长因子可以抑制炎症反应、促进成骨细胞早期增殖,并以Bio-Oss骨粉作为支架,加快成骨进程,提高了成骨质量。两者相互协同,为骨组织再生修复提供有利的条件,对颌骨外形的恢复有一定的帮助。
综上所述,在数字化导板引导下进行快速定位并行颌骨囊肿摘除术,将CGF与Bio-Oss骨粉混合填充骨缺损区,在缩短手术时间、减轻术后炎症反应及疼痛不适、促进骨愈合、提高成骨速度及成骨质量等方面有良好的效果,值得在临床推广应用。

