三叉神经运动核在束缚应激致小鼠咬肌肌电变化中的调控作用
刘 杨,李 强,雷 容,陈永进,赵雅娟
口颌肌功能紊乱是颞下颌关节紊乱病(temporomandibular disorders,TMD)临床分类之一,通常表现为慢性症状且反复发作,严重影响患者的正常生活[1-2]。研究显示,TMD患者的焦虑或抑郁水平显著高于正常人群;较高心理压力或伴有焦虑等症状的人群更易出现口颌肌的紧张与疲劳,引发或加重肌肉与颞下颌关节的疼痛[3-6]。因此,心理应激导致口颌肌的紧张度升高与肌疲劳被认为是TMD的重要诱发因素。
肌电活动变化是评价口颌肌功能状态、评估TMD发展与治疗效果的重要检测指标[7-8]。研究发现,TMD患者咬肌在下颌静止状态的肌电水平要明显高于正常人群[9]。咬肌运动的中枢调控区域位于三叉神经运动核(trigeminal motor nucleus,Vmo)[10]。Vmo位于中枢神经系统的脑干,并与脑内其他核团存在诸多神经纤维联系[11]。谷氨酸是中枢神经系统中最主要的兴奋性神经递质,Ⅰ型、Ⅱ型囊泡膜谷氨酸转运体(vesicular glutamate transporter 1/2,VGLUT1/2)是谷氨酸能神经终末的标志物[12]。研究证实,VGLUT1与VGLUT2阳性的神经终末在Vmo中广泛分布,来自中枢的谷氨酸能投射可影响Vmo神经元兴奋性,从而在咀嚼运动中起到重要调控作用[13]。然而,在心理应激状态下咬肌肌电的相关变化及机制还未见研究报道。因此,本研究拟采用经典束缚应激方式建立小鼠慢性束缚应激动物模型,探讨心理应激诱发口颌肌功能紊乱过程中的中枢神经调控机制。
1 材料与方法
1.1 实验动物及饲养环境
雄性SPF级C57BL/6小鼠32只(空军军医大学实验动物中心提供),体质量18~22 g,8周龄。饲养温度(22±1)℃,湿度(60±5)%,12 h光/暗循环,随意进食饮水。所有动物实验经过空军军医大学口腔医学院伦理委员会批准(批准号:2020伦审字081号)。
1.2 试剂和仪器
自制束缚器;旷场实验系统(RD 1412-OF)、高架十字迷宫系统(RD1208-EP)(上海移数公司,中国);定制肌电采集电极(苏州科斗脑机科技有限公司,中国);MP46型2导生理记录仪(BIOPAC,美国);振动切片机(VT100S)、冰冻切片机(CM1800)(Leica,德国);膜片钳放大器(Axopatch 200B,美国);pClampfit 10.0 数据处理系统(Axon,美国);FV1000激光共聚焦显微镜、红外显微镜(Olympus,日本);山羊抗胆碱乙酰转移酶(Millipore,美国);兔抗VGLUT1、兔抗VGLUT2(Synaptic systems,德国);驴抗兔IgG (A594、A488),驴抗鼠IgG(A647)(Thermo Fisher Scientific,美国);Picrotoxin(MCE,美国)。
1.3 小鼠慢性束缚应激模型建立
将小鼠随机分为对照组和应激组,每组16只。对应激组动物采用连续14 d的束缚应激,每天束缚时间为4 h。参照文献[14],束缚器用50 mL离心管制成,管壁上带有数个通风孔。每日早上8点开始,将每只应激组小鼠置于束缚器中,束缚过程中,小鼠可以从俯卧位向仰卧位任意旋转,但不能从头部向尾部旋转。束缚过程中禁食禁水。对照组小鼠正常饲养。
1.4 行为学测试
束缚应激结束后次日,采用旷场实验与高架十字迷宫实验来验证小鼠的焦虑水平[15-16],每组8只。
1.4.1 旷场实验(open field test,OF) 旷场为一个长50 cm、宽50 cm、高45 cm无盖、有四壁的暗箱。旷场上方中央装有昏暗荧光灯并架置摄像头,将小鼠放置在旷场中,通过自动分析系统记录小鼠15 min的活动。采用中央区活动时间及活动路程作为评估焦虑水平的参数。
1.4.2 高架十字迷宫实验(elevated plus maze text, EPM) 由两个相对的张开臂(30 cm × 5 cm)、两个相对的闭合臂(30 cm × 5 cm × 25 cm)和中央活动区域(5 cm × 5 cm)组成,距离地面50 cm。测试时,将小鼠放置在中央区域,通过上方摄像头记录其5 min的活动。通过自动分析系统,将进入张开臂次数百分比和滞留时间百分比作为评估焦虑水平的参数。
1.5 咬肌肌电水平检测
采用定制电极采集两组小鼠咬肌肌电活动水平,每组5只小鼠。定制电极制作方法:绝缘软导线(长2.5 cm,直径0.5 mm)一端焊接一根2 mm长的不锈钢金属微针(直径0.15 mm),另一端焊接于2×3的圆孔排母接口,排母上焊接一根银丝做地线。
实验开始前,将电极埋置于小鼠左侧咬肌。参照文献[17]方法,小鼠腹腔注射戊巴比妥钠麻醉(35 mg/kg),剃除小鼠左侧面颊、颈部及颅顶毛发,用碘伏消毒后,于左侧下颌及颅顶各做一切口,暴露左侧咬肌及颅顶。将定制电极微针插入左侧咬肌肌腹深部,并缝合固定微针,缝合面颊皮肤。将绝缘导线经耳后及颅顶皮下走行,于颅顶切口处穿出,另一端排母接口暴露在切口外,采用牙科自凝塑料将其固定于颅顶骨上,再次用碘伏对术区消毒。小鼠术后恢复一周后开始进行实验。
束缚应激开始前,分别采集两组小鼠的咬肌肌电活动水平。14 d束缚应激结束后,再次采集两组小鼠的咬肌肌电活动水平。采集方法:采用连接线将小鼠颅顶排母接口与MP46型2导生理记录仪相连,置于容器内放置30 min,待其对连接线适应后,使用AcqKnowledge软件采集小鼠清醒状态下咬肌肌电信号,每只小鼠采集30 min,并对数据进行处理,得到每只小鼠咬肌的咬肌累积肌电(integral electromyography,iEMG)及振幅均方根(root mean square,RMS)。
1.6 Vmo神经元电生理检测
束缚应激结束后,采用全细胞膜片钳技术检测两组小鼠Vmo神经元的电生理特性,每组3只小鼠。两组小鼠戊巴比妥钠腹腔注射深度麻醉后(60 mg/kg)脱颈处死,立即取出大脑并置于95% O2、5% CO2混合气饱和的冰浴人工脑脊液(artificial cerebrospinal fluid,ACSF)中。根据小鼠脑立体定位图谱[18],将脑组织修整至Vmo附近(Bregma尾侧4.84~5.34 mm)。振动切片(片厚300 μm),将脑片转移至室温下95% O2、5% CO2混合气饱和的ACSF中孵育1 h。后将切片移至膜片钳记录槽,在红外显微镜下选择Vmo部位神经元进行全细胞膜片钳记录。
在电流钳模式下,向细胞输入20~100 pA、时程为400 ms 的正电流,诱发神经元产生连续放电,用pClamp 10.0 实验程序采集数据并处理,记录两组Vmo神经元动作电位的放电次数。在电压钳模式下,向灌流液中加入GABAA受体阻断剂Picrotoxin,用pClamp 10.0 实验程序采集细胞的自发性兴奋性突触后电流(spontaneous excitatory postsynaptic current,sEPSC)。采用Mini Analysis 软件对数据进行处理,得到每个细胞sEPSC的频率与幅度。
1.7 免疫组织荧光染色
采用乙酰胆碱转移酶(choline acetyl transferase,ChAT)标记Vmo中运动神经元,采用VGLUT1、VGLUT2来显示Vmo神经元受到的兴奋性神经投射。免疫荧光染色方法检测VGLUT1、VGLUT2的表达水平,每组5只小鼠。
戊巴比妥钠腹腔注射深度麻醉后(60 mg/kg),小鼠经心脏灌流100 mL 0.01 mol/L磷酸盐缓冲液(PBS,pH 7.4),200 mL 4%多聚甲醛进行灌注固定,取出脑组织进行后固定及蔗糖脱水。根据小鼠脑立体定位图谱[18],修整脑组织块至Vmo(Bregma尾侧4.84~5.34 mm)部位,冰冻切片(厚30 μm),0.01 mol/L PBS漂洗,10%驴血清室温孵育 30 min,加入一抗山羊抗ChAT(1∶500)、兔抗VGLUT1(1∶500)、兔抗VGLUT2(1∶500)孵育过夜,0.01 mol/L PBS漂洗,加入二抗驴抗兔IgG(1∶500)、驴抗鼠IgG(1∶500),避光孵育4 h,0.01 mol/L PBS漂洗,裱片,室温晾干,荧光封片。激光共聚焦显微镜下观察并进行拍照,采用Image-Pro Plus 图像分析系统计算各组VGLUT1、VGLUT2的免疫荧光平均强度。
1.8 统计学分析
实验结果均采用平均值±标准差表示,采用SPSS 19.0统计软件进行分析,所有数据符合正态分布。行为学结果、电生理中sEPSC的频率与幅度结果、免疫荧光染色结果采用独立样本t检验进行分析;咬肌肌电结果、电生理中动作电位放电次数结果采用Two-way ANOVA检验,并采用Bonferroni’s事后检验进行多重比较。P<0.05为差异有统计学意义。
2 结 果
2.1 行为学结果
旷场实验结果显示(图1A~C),应激组小鼠的中央活动时间(P=0.000 4)、中央活动路程(P=0.000 4)低于对照组,差异有统计学意义。高架十字迷宫结果显示(图1D~F),应激组小鼠的进入张开臂次数百分比(P=0.000 2)、滞留张开臂时间百分比(P=0.001 3)均显著低于对照组 。
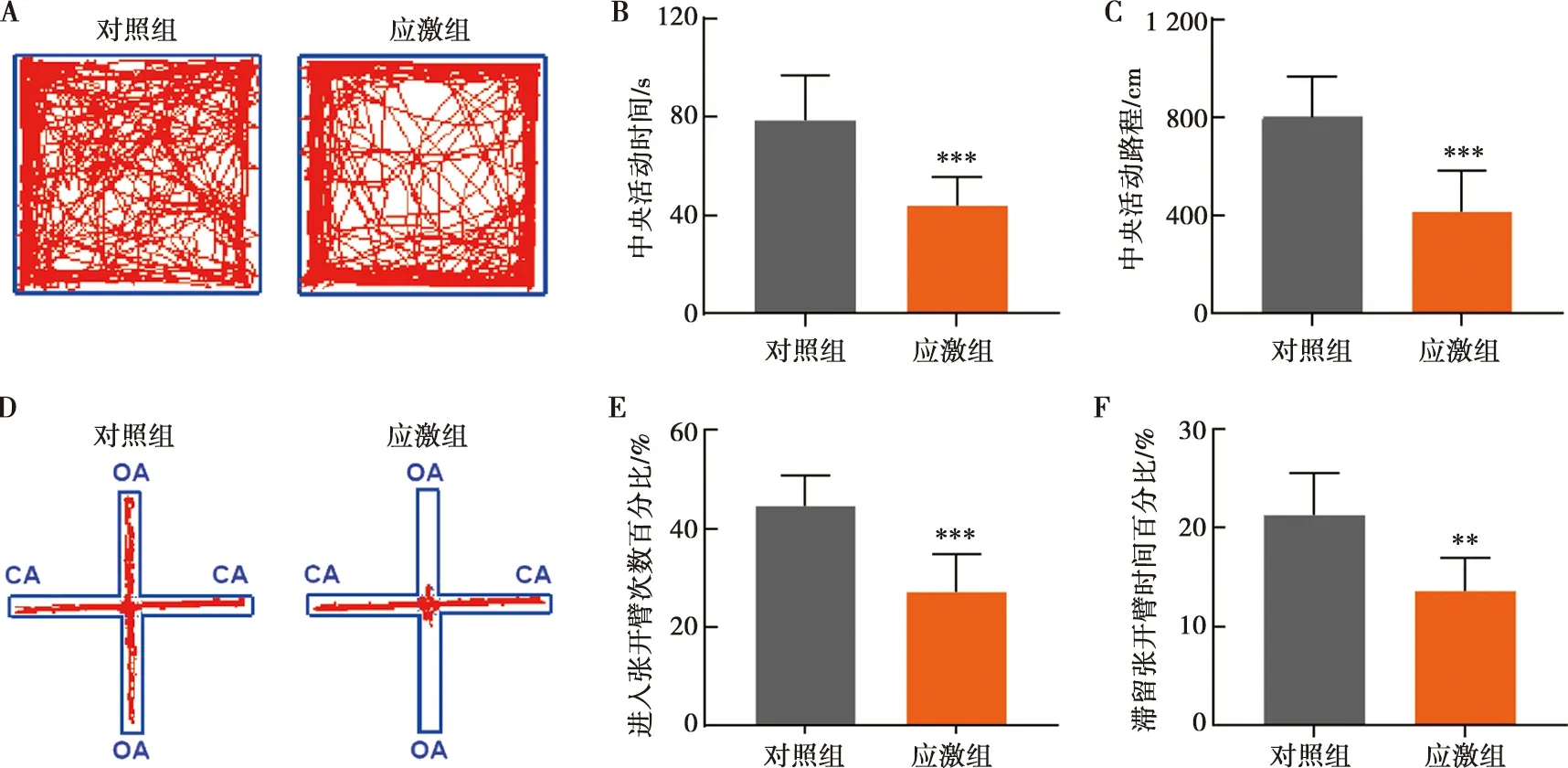
A:各组旷场活动轨迹图;B:旷场中央活动时间; C:旷场中央活动路程;D:各组高架十字迷宫活动轨迹图;E:高架十字迷宫张开臂进入次数百分比;F:高架十字迷宫张开臂滞留时间百分比;OA:张开臂;CA:闭合臂;与对照组相比,**:P<0.01;***:P<0.001
2.2 咬肌肌电水平检测
两组小鼠咬肌肌电结果如图2所示。应激开始前,两组小鼠咬肌iEMG(P=0.877 9)与RMS(P>0.999 9)结果差异无统计学意义;应激结束后,应激组小鼠咬肌iEMG(P=0.000 4)与RMS(P=0.000 1)结果均显著高于对照组。
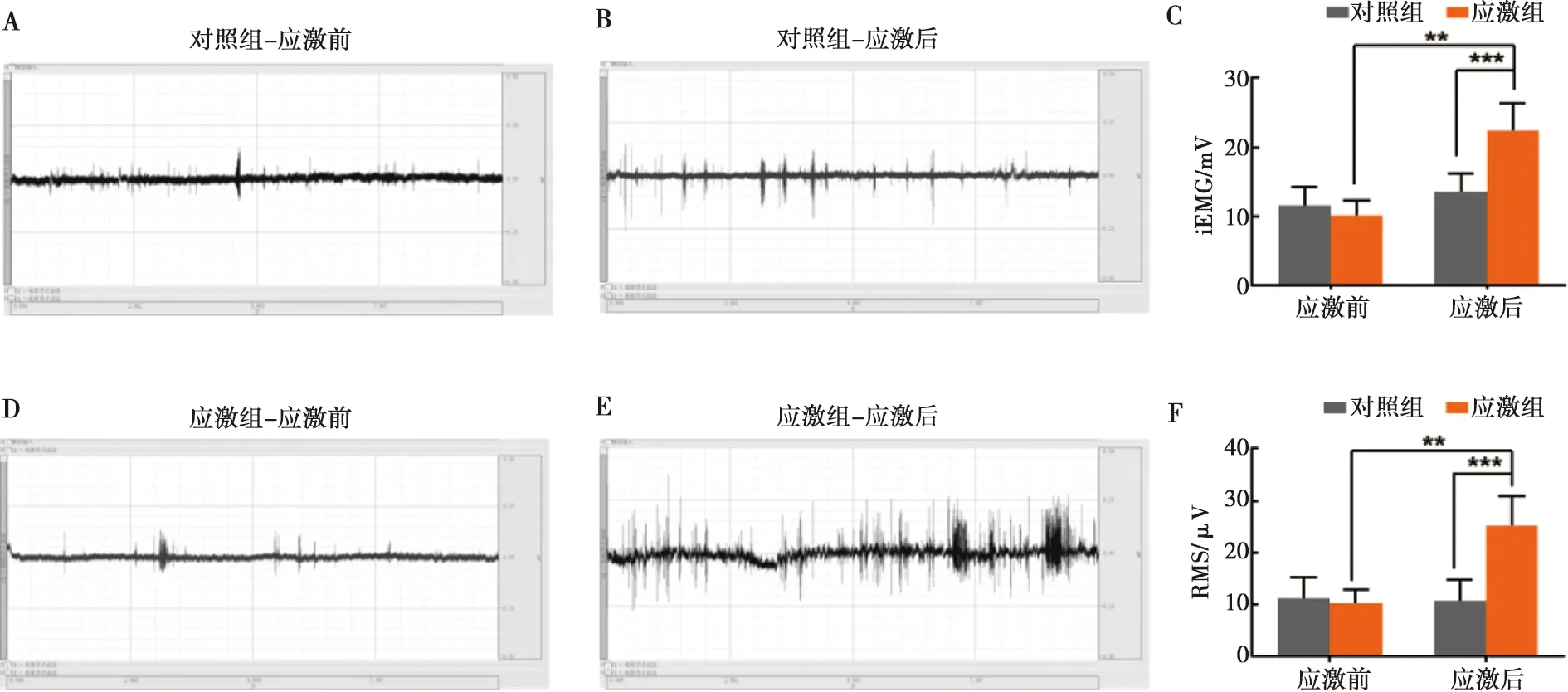
A:应激前对照组肌电图;B:应激后对照组肌电图;C:应激前后咬肌iEMG比较;D:应激前应激组肌电图;E:应激后应激组肌电图;F:应激前后咬肌RMS比较;**:P<0.01;***:P<0.001
对照组在应激前后,小鼠咬肌iEMG(P=0.798 9)与RMS结果(P>0.999 9)无明显差异;应激组小鼠在应激结束后,其咬肌iEMG(P=0.001 1)与RMS(P=0.001 9)结果显著高于应激前。
2.3 Vmo神经元电生理检测结果
两组小鼠Vmo神经元的动作电位发放曲线如图3所示。在电流钳模式下,当输入60、80、100 pA的电流时,应激组小鼠Vmo神经元的放电频率显著高于对照组(P=0.004 0、P=0.006 0、P=0.001 7)。

A:对照组神经元放电次数曲线;B:应激组神经元放电次数曲线;C:两组神经元放电次数比较;**:与对照组相比,P<0.01
两组小鼠Vmo神经元的sEPSC记录结果如图4所示。在电压钳模式下,应激组小鼠Vmo神经元的sEPSC频率(P=0.003 0)与幅度(P=0.000 2)显著高于对照组。

A:对照组神经元sEPSCs曲线;B:应激组sEPSCs曲线;C:两组神经元放电频率比较;D:两组神经元放电幅度比较;与对照组相比,**:P<0.01;***:P<0.001
2.4 Vmo中VGLUT1、VGLUT2表达水平
两组Vmo部位免疫荧光结果显示,蓝色荧光标记神经元为ChAT阳性,表明其为Vmo运动神经元。VGLUT1与VGLUT2阳性终末(红色荧光标记)分布在Vmo神经元胞体周围。VGLUT1阳性终末主要分布在Vmo核团背外侧区;VGLUT2阳性终末在Vmo核团整个范围内均有分布。VGLUT1与VGLUT2免疫荧光强度结果显示,应激组Vmo部位的VGLUT1(P=0.001 0)与VGLUT2 (P=0.001 3)荧光强度显著高于对照组(图5)。

A:对照组VGLUT1染色;B:应激组VGLUT1染色;C:两组VGLUT1免疫荧光强度比较; D:对照组VGLUT2染色; E:应激组VGLUT2染色;F:两组VGLUT2免疫荧光强度比较;红色荧光:VGLUT1;绿色荧光:VGLUT2;蓝色荧光:ChAT;**:与对照组相比,P<0.01
3 讨 论
目前,大多数研究认为心理社会因素如焦虑、抑郁等负性情绪状态与TMD的发生发展存在密切联系[3-4],甚至有学者认为TMD是一种心身疾病[19]。因此,深入研究心理因素在诱发或加重TMD过程中的具体作用机制,可为临床上TMD的病情评估、针对性治疗等提供重要的指导依据。
束缚应激被广泛用于焦虑或抑郁等负面情绪相关研究中[15,20],本研究采用了经典的束缚应激动物模型来诱发小鼠的情绪行为改变。研究发现,每天4 h、连续14 d的慢性束缚应激能够造成小鼠在旷场中央活动时间与距离明显减少;高架十字迷宫中进入开放臂的次数与滞留时间也明显低于对照组,本实验动物模型构建成功,与以往的研究结果相一致[20-21]。
在口颌肌中,咬肌位置表浅易触及、肌纤维方向较为明确、对外界的刺激反应敏感度较强,其紧张度的变化与口颌肌疲劳疼痛、副功能运动等临床症状密切相关[7,22]。临床研究证实,心理应激状态下正常人的咬肌活动水平会明显增加[5-6];而咬肌的肌紧张度增高与TMD的症状表现存在密切联系[9]。本课题组前期研究证实,慢性应激可导致咬肌组织中乙酰胆碱酯酶、肌酸激酶、乳酸脱氢酶等反映肌肉活动水平的酶类增加;同时自由基增多造成肌组织损伤和肌细胞的超微结构损伤[16,23]。因此应激引起咬肌紧张度升高,副功能运动增加,导致肌疲劳、代谢产物堆积,继而出现疼痛、痉挛等症状[24]。但心理应激与咬肌肌电活动是否存在直接因果关系目前尚不可知,本实验对此进行了研究。
目前临床上常用的肌电检测方法主要有两种:一种为表面肌电,即把电极贴附在皮肤上导出较为浅表的肌肉活动电位;另一种为针电极测量,即把电极针刺入待测肌肉并导出局部电位。但在应用于动物实验过程中,表面肌电因动物的配合问题难以开展, 因此,本课题组根据小鼠口颌部解剖特点,并参照相关文献[17],定制了植入式针式电极,将其植入小鼠的咬肌内,并在颅骨部位进行固定,较好地解决了长时间采集清醒状态下咬肌肌电活动的问题。本研究结果显示,慢性束缚应激可直接引起咬肌肌电水平的显著升高,咬肌的肌紧张度增高,提示心理应激导致的咬肌紧张度升高很可能是心理应激与TMD的发生发展相关的内在关键机制。
三叉神经运动支来源于脑干Vmo中的运动神经元,支配口颌肌的运动[10]。与其他躯干、四肢等肌肉的运动支配不同,咬肌等口颌肌运动的直接支配神经元位于中枢神经系统(脑部),而非外周神经系统(脊髓)。中枢神经系统中存在的复杂神经纤维联系,导致了Vmo神经元的兴奋性更易受到脑内其他低级或高级神经核团的影响[11]。因此,为了证实束缚应激造成的咬肌肌电水平升高是否与中枢Vmo神经元的变化有关,本实验采用全细胞膜片钳技术记录了Vmo神经元的激发放电情况,发现在给予60、80、100 pA的电流时,应激组小鼠Vmo神经元的放电频率显著高于对照组,证实应激造成Vmo神经元的兴奋性显著升高。同时,本实验记录了穿过Vmo神经元整个细胞膜的兴奋性突触后电流,发现应激组Vmo神经元的sEPSC频率与幅度显著高于对照组,表明应激可导致Vmo神经元受到的兴奋性神经传递显著增加。以上结果提示,束缚应激可导致Vmo神经元兴奋性升高,同时Vmo神经元受到来自中枢的兴奋性投射增加,这可能是应激后咬肌肌电水平升高的中枢调控机制之一。
谷氨酸是中枢神经内最主要的兴奋性神经递质,在神经元内合成后,需经谷氨酸转运体转运至轴突末端,以囊泡的形式分泌至突触间隙,引起下一级神经元的兴奋。VGLUT1与VGLUT2是两种主要的谷氨酸转运体,是谷氨酸能神经终末的标记蛋白[12]。以往的研究证实,在Vmo核团内,VGLUT1与VGLUT2均有表达[13]。因此,本研究选择观察两组小鼠Vmo内VGLUT1与VGLUT2的表达情况,发现应激组Vmo部位的VGLUT1与VGLUT2荧光强度均显著高于对照组,进一步证实受到束缚应激后,Vmo神经元收到来自其他核团的谷氨酸能投射显著增加。据文献报道,在较低位中枢脑干,Vmo接受来自三叉上核、小细胞网状结构、三叉神经中脑核等神经投射,直接或间接调控了Vmo神经元的兴奋性[16,25-26];而位于较高级神经中枢的情绪相关核团,如中央杏仁核、外侧下丘脑等区域,不仅与心理应激反应密切相关,并且被证实发出直接或间接的神经投射,与Vmo、三叉神经中脑核以及小细胞网状结构等部位存在神经纤维联系[27-28]。因此,本研究观察到束缚应激导致的Vmo神经元兴奋性升高,可能是由于应激直接造成的情绪相关核团的变化,通过脑内的神经联系,最终导致向Vmo神经元的兴奋性投射增多而导致的。
综上所述,慢性束缚应激能够造成小鼠的焦虑样情绪改变,且咬肌的肌电活动水平升高;而在受到应激后,支配咬肌运动的Vmo神经元兴奋性升高,且接受来自脑内其他核团的兴奋性投射增加,这可能就是束缚应激导致咬肌肌电活动水平升高的中枢机制之一。本研究结果提示心理因素可能通过提高支配咬肌活动的Vmo神经元兴奋性,导致咬肌紧张度升高,进而诱发或加重TMD,为深入探讨心理因素与TMD的内在联系提供了实验基础。

