磁共振IVIM-DWI联合CT对肝细胞癌病理分级的评估价值*
杨 洁 赵 森 李秋实
河南大学第一附属医院医学影像科 (河南 开封 475001)
肝细胞癌(HCC)是一种主要的原发性肝癌类型[1],属于我国第4常见肿瘤,发病率及致死率在近些年有所增加[2],已成为危害中国人民健康的最常见肿瘤之一。不同病理分级HCC患者治疗方式有差异[3],因此对肝细胞癌的病理进行准确分级有助于临床方案的选择。磁共振体素内不相干运动扩散加权成像序列(IVIM-DWI)在肝脏、肾脏等全身多个部位检查有应用[4-7]。研究显示IVIM-DWI在肝脏疾病诊断方面具有巨大优势[6]。随着医疗影像学的发展,CT在各脏器疾病中发挥重要功能,随着人工智能大数据时代的到来,对HCC病理分级的研究也在不断深入,本研究小组将通过磁共振IVIM-DWI联合CT影像组学寻找影像与HCC病理分级中的相关性,为临床HCC病理分级诊断提供新的影像诊断依据和应对措施,并进一步阐明与磁共振IVIM-DWI联合CT的影像组学与HCC病理分级的相关作用,对HCC的预防和诊治有着重要的意义。
1 资料与方法
1.1 一般资料选取2020年1月至2022年1月期间本院收治的HCC患者89例。
纳入标准:临床资料与临床影像学资料完整;患者术前无任何相关治疗史;所有病例均经手术病理证实,且有明确的病理分型;无磁共振扫描禁忌症;对钆造影剂及碘造影剂无过敏史;患者知情同意。排除标准:病理分化程度缺失;病灶直径小边界不清晰影响感兴趣区的勾画;图像存在明显囊变坏死区;合并其他脏器肿瘤;孕妇、哺乳期妇女。
1.2 IVIM-DWI采用GE Discovery MRI750磁共振成像仪8通道相控阵体部线圈(TORSO线圈),扫描膈顶至肝下2cm。扫描前患者呼吸频率维持在18~20次。患者取仰卧位,进行平扫、DWI及IVIM扫描,计算患者ADC值、D值、D*值和f值。由2名经验丰富的影像科医师检测图像质量。
1.3 CT的影像组学采用GE Discovery 750 HDCT,参数设置:管电压120Kv,管电流400-500mAs,层距1mm,层厚5mm,矩阵为512×512。患者取仰卧位,肘正中静脉注射碘海醇(350mgI/mL),(剂量为1.5mL/kg、流速为3.5-4.0mL/s),进行动脉期、门脉期及延迟期扫描,图像处理与数据分析均在GE ADW4.6工作站进行。采用手动分割方法,由两名腹部CT诊断经验的医师放置感兴趣区。将各期原始图像及生成的相对应VOI文件分别导入A.K.软件中提取影像组学特征,包括病灶直径,形状、边界、肝硬化、包膜、胆管扩张、环状动脉期高强化等。
1.4 病理分级HCC的分级方法采用Edmondson-Steiner病理分级法,具体参考文献[8]。设置Ⅰ级、Ⅱ级为高分化组,Ⅲ级、Ⅳ级为低分化组。
1.5 统计学分析采用SPSS 26.0软件对不同数据类型进行相关处理分析,符合正态分布的定量数据使用独立样本t检验,用()表示;定性资料进行χ2检验以分析组间差异,绘制受试者工作特征曲线(ROC)评估预测效能,计算曲线下面积(AUC),采用Kappa一致性检测测定磁共振IVIM-DWI、CT以及联合检测与术后病理切片的一致性。P<0.05为有统计学差异。
2 结果
2.1 HCC肿瘤病理分级89例HCC患者中,高分化组53例,低分化组36例。
2.2 不同分化程度HCC患者IVIM-DWI参数比较与高分化组相比,低分化组ADC、D、D*值降低(P<0.05),f值差异无统计学意义(P>0.05),见表1。
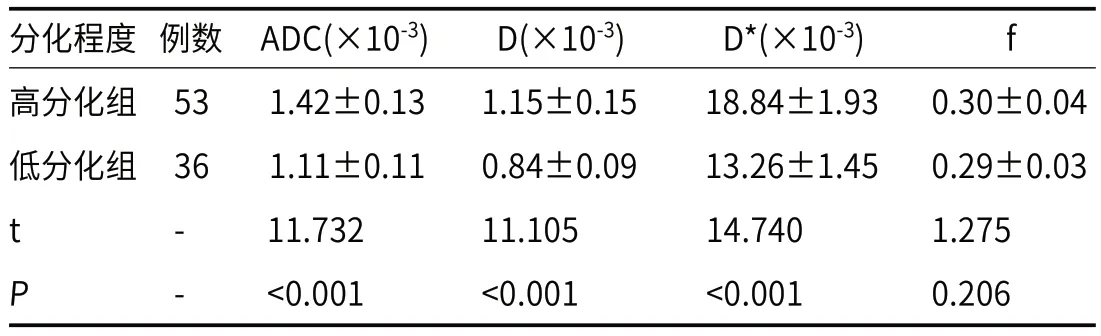
表1 高分化与低分化HCC患者ADC、D、D*、f值比较
2.3 IVIM-DWI参数对HCC患者病理分级的诊断效能ADC、D、D*以及三者联合对HCC患者低分化的诊断曲线下面积分别为0.863、0.782、0.840、0.927,见图1、表2。
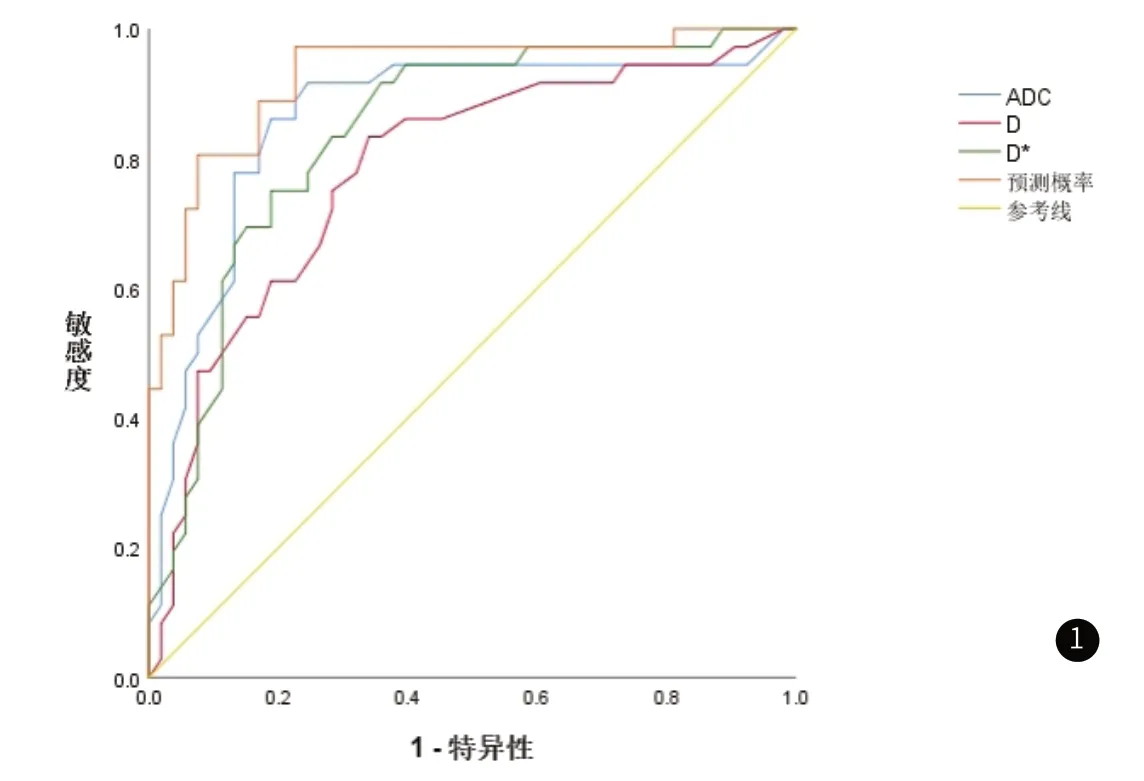
图1 ADC、D、D*以及三者联合对HCC患者病理分级的诊断ROC图
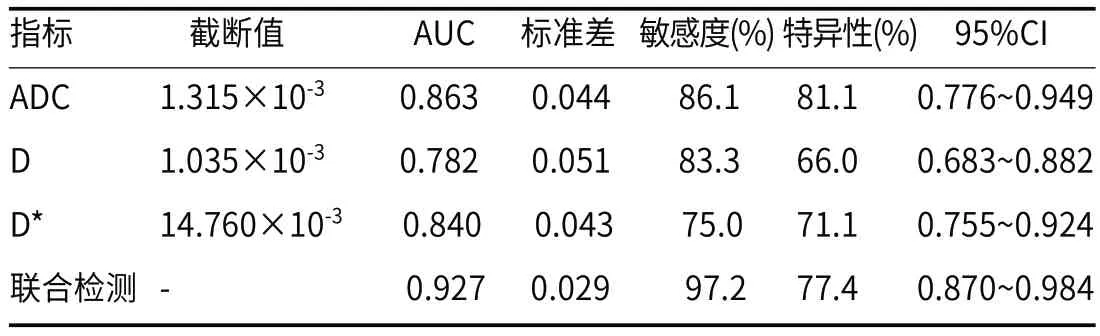
表2 ADC、D、D*以及三者联合对HCC患者病理分级的诊断效能
2.4 不同分化程度HCC患者CT参数比较与高分化组相比,低分化组病灶直径变大,不规则型、均匀、边界不光滑、肝硬化占比升高(P<0.05),两组包膜、胆管扩张、非环状动脉期高强化比较差异无统计学意义(P>0.05),见表3。
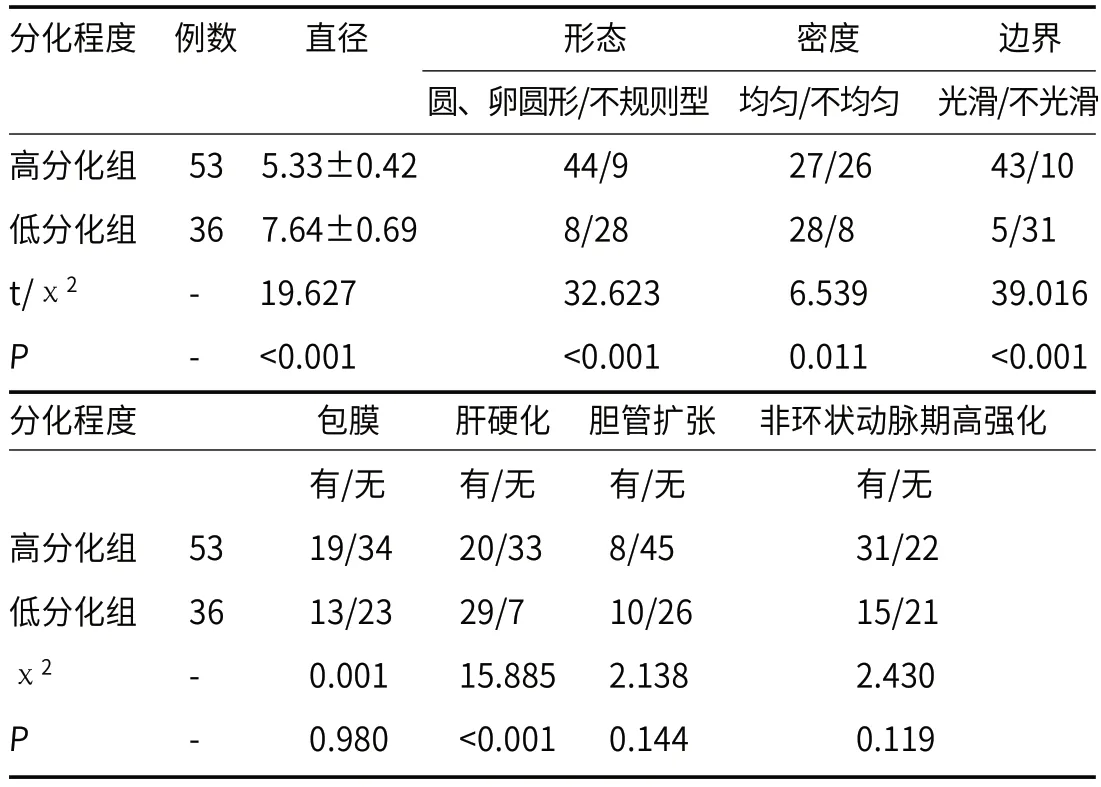
表3 不同分化程度HCC患者CT参数比较
2.5 磁共振IVIM-DWI联合CT对HCC病理分级的价值分析磁共振IVIM-DWI检测出高分化42例,低分化47例,与术后病理切片诊断结果一致性较高(P<0.05);CT检测出高分化58例,低分化31例,与术后病理切片诊断结果一致性较高(P<0.05),磁共振IVIMDWI与CT联合检测检测出高分化55例,低分化34例,与术后病理切片诊断结果一致性较高(P<0.05)(表4);各方式对低分化的诊断效能见表5。
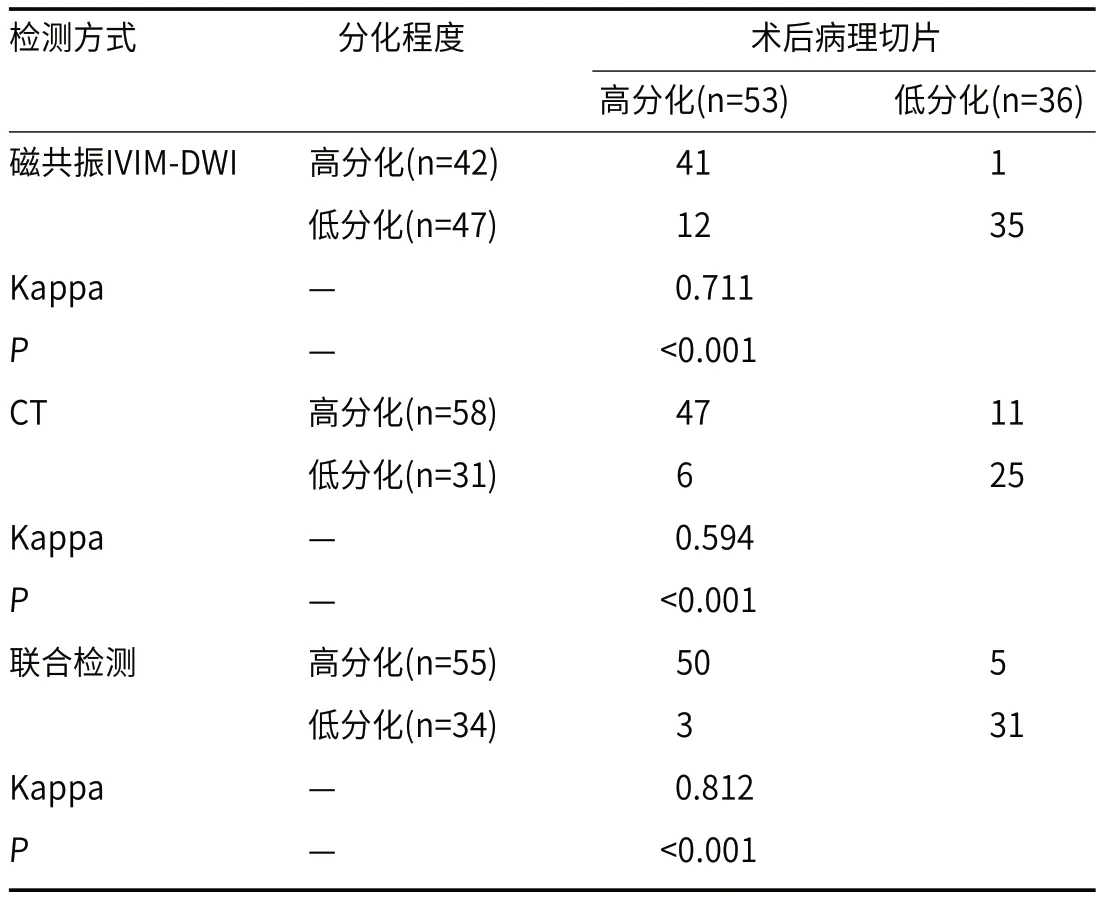
表4 磁共振IVIM-DWI、CT以及联合检测对病理分级的诊断与术后病理切片的一致性检测
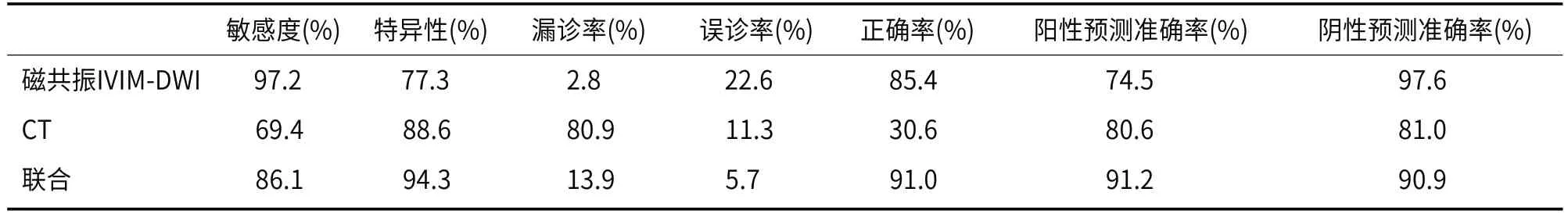
表5 磁共振IVIM-DWI、CT以及联合检测对病理分级的的价值分析
3 讨论
HCC是常见的肝恶性肿瘤类型,约占90%,是全球癌症相关死亡的第三大原因。遗传、乙肝、丙肝病毒感染、吸烟等是肝癌的主要危险因素。肝癌预后差,严重影响患者生存质量与生命健康。肿瘤的病理准确分级是判断肿瘤对周围组织的侵袭性、疾病的转归以及预后生存率的最可靠因素,不同的病理分级对应不同的治疗方案,术前肿瘤的准确病理分级可为治疗提供可靠依据。病理准确分级金标准为穿刺活检以及术后切除肿瘤判定,但创伤性检查限制了方法的使用,且可能会增加通过穿刺通道转移等风险。通过影像学手段进行术前病理区分有较高的应用前景。
DWI模型下的ADC容易受到水分子及微循环灌注的影响,无法有效反映机体水分子运动过程,IVIM-DWI可将弥散效应、灌注效应分开,呈现病灶部分水分子弥散情况[9],在乳腺癌[10]、肾癌[11]、咽喉癌[12]中具有一定应用。IVIM-DWI在肝脏中也可见研究[13],对区分肝脏恶性占位与良性占位有帮助。苏瑾等[14]研究显示,肝脏低b值IVIM-DWI各参数有助于进一步评价HCC;Park等[15]研究显示,IVIM-DWI可预测HCC患者经导管动脉化疗栓塞后碘油摄取情况;Zhou等[16]研究显示,IVIM-DWI对HCC患者分化程度具有区别作用,D值诊断价值更高。本研究中将Ⅰ级、Ⅱ级作为高分化组,Ⅲ级、Ⅳ级作为低分化组,检查不同分化程度HCC患者间IVIM-DWI指标差异,发现分化程度差患者ADC、D、D*值水平低,而f值差异无统计学意义,与李少朋等[17]研究结果类似,低分化病变排列紊乱、形态异常癌细胞占比高,细胞小、密度大,浆核比例高,水分子含量少,水分子运动受限,ADC与D图以蓝绿色信号为主,ADC与D值水平低,而高分化患者相比较水分子含量丰富,水分子运动较低分化者高,因此ADC与D值水平高于低分化者。ADC、D值均对分化程度的区分具有一定作用,ADC值低于1.315×10-3、D值低于1.035×10-3,D*值低于14.760×10-3,HCC患者处于低分化的可能性较高,需采取对应方案治疗。
CT扫描具有速度快、动态扫描、定位病灶、判断血供等特点,平扫可见肝实质内等低密度影,边界清晰,一些肿瘤周围可见低密度脂肪组织。病灶中若出血,则表现为不均匀高密度影,边界不清。动脉期,病灶均匀强化;门脉期,密度下降,与正常组织等密度;延迟期,与正常肝组织密度相比呈低密度。曾玉萍等[18]研究显示,CT对HCC合并胆管癌栓与肝内胆管细胞癌具有辨别作用;曾凤霞等[19]研究显示,基于CT影像组学特征构建的影像组学模型对不同分化程度HCC具有鉴别效能。本研究中,与高分化组相比,低分化组病灶直径变大,不规则型、均匀、边界不光滑、无包膜、肝硬化、无非环状动脉期高强化占比升高,提示不同分化程度HCC患者间CT表现有差异,CT检测结果与临床病理测定一致性较高。CT联合IVIM-DWI测定对低分化HCC的诊断特异性升高,提示联合检测可能有助于HCC的病理分级。
综上所述,IVIM-DWI与CT联合检测对HCC的病理分级具有一定评估价值。

