同侧多原发性肺结节中次病灶影像学特征和病理相关性经验总结*
冷雪春 韩 东 张瑞瑞 李朋玲 胡忠吾,*
1.南京医科大学附属淮安一院胸外科
2.南京医科大学附属淮安一院影像科
3.南京医科大学附属淮安一院病理科
4.南京医科大学附属淮安一院呼吸科 (江苏 淮安 223300)
肺癌是国内外常见恶性肿瘤之一。随着CT的运用,越来越多肺结节被体检出,同时存在两个或以上数目(直径≤3cm)的多原发肺结节被体检出,多原发性肺癌(Multiple Primary Lung Cancer,MPLC)患者诊断亦增加,其预后效果较转移瘤效果好[1]。MPLC病理大部分为腺癌及其亚型居多,包括不典型腺瘤增生(Atypical adenomatous,AAH)、原位腺癌(adenocarcinoma in situ,AIS)、微浸润腺癌(microinvasive lung adenocarcinoma,MIA)和腺癌(invasive adenocarcinoma,IAC)[2]。在治疗主病灶的同时,伴随的次病灶结节定性仍然困难,准确判断其性质有利于减少外科医师漏诊,误诊,提高患者获益。临床上主病灶结节容易通过临床表现、影像学恶性征、PETCT、病理活检等鉴别病理性质。伴随次病灶因为直径较小,仍要通过CT的空间及密度分辨观察结节内部及周围的细节征象,提高鉴别诊断能力[3]。目前对次病灶结节影像学特征研究较少。为此,我们回顾性研究本院多原发性肺结节切除术后患者临床资料,对照病理研究次病灶结节的影像学特征,鉴别出高危结节,现总结如下。
1 资料与方法
1.1 研究对象收集2018年1月至2022年5月于南京医科大学附属淮安市第一医院肺外科手术切除多发性结节患者。结合美国医师协会(american college of chest physicians,ACCP)[4]关于MPLC诊断要点如下。
纳入本研究标准:术前完成胸部高分辨率CT检测;主导病灶不大于3cm,无淋巴结转移,临床及影像治疗完整。排除标准:双侧孤立性肺癌;转移瘤;影像资料不完整。共收集胸腔镜下手术切除多原发性结节患者共101例,共切除241枚病灶。其中男性25例,女性76例,年龄20-80岁,平均年龄(56.8±11.8)岁。
1.2 CT检查方法所有入组患者接受Siemens Somatom Defnition双源64排128层螺旋CT机胸部CT扫描,采用CARE Dose4D扫描条件:管电压80~140kV,管电流60~100mA,层厚为5mm,层间距5mm。所有受检者仰卧于检查床上,指导呼吸配合检查,扫描范围包括整个肺野,病灶的原始采集资料按1mm标准算法重建后传到Siemens双源CT专用后处理软件SyngoVia工作站进行多平面重组、容积再现、最大密度投影等方法重组以利于观察病灶的特点。
1.3 手术方法无法通过解剖标记定位的肺小结节,术前行CT下hookwire+美兰染色或美兰染色定位。胸腔镜下手术治疗,患者健侧卧位,双腔气管插管,单肺通气,根据病灶大小、位置、形态、年龄、肺功能选择合适的手术方案,例如靠近边缘优势位置高危结节根据大小行楔形切除,位置较深行肺段切除,肿瘤直径大、靠近肺门等行肺叶切除,集中同叶宜行肺叶切除。通过三种手术方式的组合,尽可能切除主病灶外的高危次病灶、切除病灶足够范围及保留肺功能,术中行快速冰冻病理检测。
1.4 CT影像学特点及病理评价标准回顾切除病灶的的影像学特点,结合人工智能(artificial intelligence,AI)分析结果,由胸外科副主任医师及以上2名医师观察肺结节的的大小,位置,密度,边界,毛刺,分叶,空泡征,血管聚集,胸膜凹陷,磨玻璃类型等情况。病理结果均按照国际肺癌研究协会分类标准[5],病理为浸润性腺癌患者行系统纵膈淋巴结清扫术。
1.5 统计学方法所有数据采用SPSS 26.0统计学软件处理数据,计数治疗采用构成比表示,采用卡方检验,计量资料采用t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 手术结果101例患者皆行胸腔镜手术,共切除肺结节241枚,次病灶140枚,2个病灶71例(70.3%),3个病灶24例(23.7%),4个病灶4例(4%),5个病灶1例(1%),6个病灶1例(1%)。手术方式上行肺楔形+楔形切除41例(40.6%),肺段+肺段切除2例(1.9%),肺叶切除14例(13.9%),肺段+楔形切除13例(12.9%),肺叶+楔形切除31例(30.7%)。
2.2 病理结果病理诊断:主病灶101枚其中AAH1例,AIS12例,MIA32例,IA56例。140枚次病灶病理良性结节36例(25.7%),AAH24例(17.1%),AIS25例(17.9%),MIA12例(8.6%),IA43例(30.7%)。
2.3 次病灶影像学特征同临床病理关系形态上,磨玻璃为97枚(69.3%),亚实性磨玻璃16枚(11.4%),实性结节27枚(19.3%)。不同病理性质的结节大小、分叶征出现比例差异无统计学意义(P>0.05),纯磨玻璃及亚实性结节、边界清晰、毛刺、空泡多倾向于恶性结节(P<0.05),血管聚集、CT密度值、AI对高危结节预测两组间无统计学意义(P>0.05)。见表1。

表1 次病灶影像学表现同临床病理关系
2.4 影像学特征与病理对照患者1,女,57岁,右上中下肺结节,行上中下三叶楔形切除,病理依次为MIA,AIS,AAH,淋巴结采样阴性,三枚结节CT影像分别为图1-3;患者2,男,67岁,行左下肺楔形切除+左上肺楔形切除,次病灶结节CT影像见图4,病理提示AAH;患者3,女,48岁,右上肺后段结节,右上肺次病灶2枚,见图5,前段结节病理为MIA,尖段为AAH。
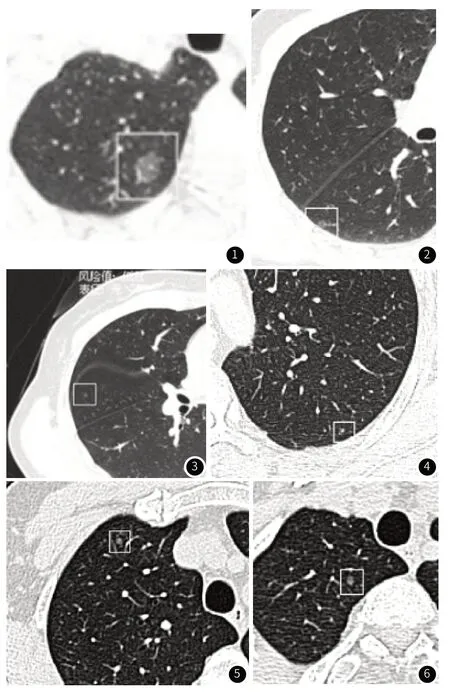
图1 患者1,主导病灶,MIA;图2 患者1,次病灶1,AIS;图3 患者1,次病灶2,AAH;图4 患者2,次病灶2,AAH;图5 患者3,次病灶1,MIA;图6 患者3,次病灶2,AAH;
3 讨论
肺癌是我国常见病,随着胸部高分辨率CT普及、AI广泛使用,越来越多的多发性肺结节被检出,同时多原发性肺癌诊断率亦逐步提高,分为主病灶与次病灶[6]。多原发性肺癌症状仍然以主病灶的症状为主,可掩盖次病灶的症状,容易造成恶性或癌前病变漏诊,贻误患者治疗,毕竟早期肺癌的尽早及时治疗可以提高患者的生存率,AIS和MIA患者的五年生存率接近100%[7-8]。此外对良性结节误诊,导致患者过度治疗,肺功能受损。临床上,对次病灶性质较难确诊,其病灶小实质少,穿刺困难,取样少容易引起假阴性[9],而PETCT检查主要对实性成分大于8mm结节有意义,对于次病灶性质判定仍有局限性[10-11]。吴雪杰[12]在文献中指出外周血循环DNA、外泌体、LOH等基因组无创检测可鉴别多发性肺结节性质。但无创血液检测肿瘤指标对多原发性肺癌中次病灶的定性作用有限,对于主病灶或孤立性肿瘤鉴别意义大。
肺结节诊治中国专家共识[13]在对多发性肺结节诊疗中推荐对每个结节进行分别管理。通过影像学特征分析,如大小,密度,内部结节,以及AI的辅助诊断,对多发性肺结节进行良恶性鉴别。随着对肺结节良恶性鉴别学习曲线的积累,有助于提高多发现结节良恶性鉴别的诊断率。本研究中次病灶结节磨玻璃结节共113例(80.7%),癌和癌前病变比例80%,明显高于实性结节癌变率(52%)。高危结节形态上与肺边界清晰,部分存在毛刺。空泡征是肺结节中一个重要恶性症,在非良性结节中比例高(67.3%)。次病灶通常直径较小、影像学多为磨玻璃及亚实性为主原因,肺癌的典型影像表现毛刺、胸膜凹陷出现比例低,统计学上无意义。在本研究中两组中血管聚集并无异意义。对于次病灶结节磨玻璃和亚实性、空泡、肺结节周边清晰仍然是高危影像因素(P<0.05)。AI诊断肺结节敏感度高,有效节省临床医师诊断时间,在本研究中对次病灶高危结节性质的预测无统计学无意义,可能是因为未将主病灶引入数据分析,人工智能需要和临床医师的双重检测才能提高对良恶性病兆的鉴别能力[14]。但是在现实世界中,部分肺结节表现并不典型,如图4左上肺后段结节,其为实性小结节,病理为AAH。
在实际临床手术中,微小结节定位切除比较困难,甚至肺组织切下后亦很难定位。需要结合术前定位包括CT引导下hookwire定位针定位及术中术者按解剖标记点定位。在主病灶切除的同时,对次病灶规范手术治疗,才能使患者获益。相关研究指出多原发性肺癌的预后以主导病灶为主[15]。手术切除范围应根据结节具体位置而定,需优先考虑主病灶的切除[16],残留结节、残留结节是否增长、有无新发GGNs均与预后无关[17]。研究证明,对于多原发性肺癌治疗,吸烟和淋巴结转移是主要预后因素,而对残余结节的处理,目前还未形成统一治疗,目前可采用三维立体定向放疗(SBRT)、经皮或支气管消融术[18-19]。本研究中主要针对同侧多发结节处理,经过回顾分析发现,仍然有5例患者高危结节残留,主要是因为肺结节太多,需要切除肺组织多,肺功能损失大,仍然需要后续随访诊疗。
在多发结节患者的诊断治疗中,应根据高分辨CT影像学把握肺癌高危特征,每个结节单独评估,在主病灶手术切除同时,定性高危次病灶肺结节,同时重视患者的年龄、肺功能、位置、大小、病理选择合理的手术方式。遵循目前多原发性肺癌外科治疗共识:同侧多发性高危结节,尽量切除,尽可能保留肺功能,残余结节密切随访,术后综合治疗[20]。
本研究为回顾性研究,影像学特征人工辨认,可能会出现统计学偏倚。综上所叙,多原发肺结节次病灶的结节影像学特点反应病理特点,CT影像学磨玻璃、空泡、边界清晰、毛刺倾向于恶性肺 小结节,而实性、边界光滑多倾向于良性结节,同时外科医师对小结节良恶性鉴别学习曲线亦很重要。

