过表达FOXO1 的BMSCs 对哮喘模型小鼠肺嗜酸性粒细胞浸润和气道重构的抑制作用及其机制
何小双, 徐丽娜, 崔 梅, 辛雯艳
(1.石河子大学医学院第一附属医院呼吸与危重症医学科,新疆 石河子 832008;2.新疆维吾尔自治区人民医院病理科,新疆 乌鲁木齐 830001)
哮喘作为一种常见的慢性疾病,是一种以气道炎症、气道高反应性和气道重构为特征的复杂炎症性疾病,接触常见气源性过敏原的儿童可能导致哮喘,并发展持续至成年[1]。目前,哮喘影响着全球超过3 亿人[2],近年来哮喘的患病率还在急剧增加,现已成为严重威胁人类健康的慢性疾病,亟须更有效的治疗方法。
骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs) 是来源于骨髓的一类非造血干细胞,在组织再生和免疫调节中发挥重要作用。BMSCs 移植已在移植物抗宿主病、糖尿病、血液疾病、多发性硬化症、克罗恩病和溃疡性结肠炎等疾病治疗中显现出良好应用前景[3-5]。研究[6-7]显示:BMSCs 移植可有效改善哮喘患者气道炎症程度,逆转气道重构,从而缓解哮喘症状。基因编辑改造诱导某些分子或旁分泌因子的表达可以增强BMSCs 治疗多种疾病的效果。叉头转录因子1(forkhead box transcription factor 1, FOXO1) 是FOXO 家族成员之一,其能够调节各种细胞反应,包括氧化应激反应、免疫稳态、细胞增殖、细胞死亡和新陈代谢,FOXO1 还通过调节转录和信号转导途径,在炎症反应中发挥直接作用[8]。研究[9-10]显示:FOXO1 通过调节巨噬细胞向M2 型极化,从而有效缓解过敏性哮喘患者的炎症反应。此外,FOXO1 激活能够调控BMSCs 向炎症抑制方向发展。目前FOXO1 介导的BMSCs 在哮喘疾病中的作用尚不清楚。本研究采用卵清蛋白(ovalbumin,OVA)和雾化激发的方法制备小鼠哮喘模型,将经过FOXO1 基因编辑的BMSCs 作用于哮喘小鼠,观察小鼠肺部病理形态表现和嗜酸性粒细胞浸润情况及FOXO1 对气道重构的影响。
1 材料与方法
1.1 实验动物、主要试剂和仪器45 只清洁级BALB/c 雌性小鼠,6~8 周龄,体质量为20~22 g,由新疆维吾尔自治区疾病预防控制中心提供,动物生产许可证号:SCXK(新)2021-0001。小鼠饲养于标准动物饲养笼内,温度为22 ℃~25 ℃,相对湿度为40%~60%,通风良好,光照/黑暗各12 h 交替,期间正常饮水摄食,所有小鼠适应性饲养1 周。卵清蛋白(ovalbumin,OVA)、氢氧化铝、胎牛血清、1%青霉素-链霉素、DMEM培养液和嘌呤霉素(美国Sigma 公司),成脂分化诱导培养基和成骨分化诱导培养基(广州赛业科技有限公司),油红O 染色和茜素红染色(北京索莱宝科技公司),TRIzol 试剂盒、逆转录和荧光定量检测试剂盒(日本TaKaRa 公司),BCA 蛋白浓度测定试剂盒(武汉博士德生物工程有限公司),放射免疫沉淀法(radioimmunoprecipitation assay,RIPA) 裂解液、聚偏二氟乙烯[poly(vinylidene fluoride), PVDF] 膜、 增 强 型 化 学 发 光 试 剂(enhanced chemiluminescence, ECL) 试 剂 液 和4', 6- 二 脒 基-2- 苯 基 吲 哚(4',6-diamidino-2-phenylindole,DAPI)染料(上海碧云天生物研究所),HE 染色液(沈阳万类生物科技有限公司),荧光防淬灭封片剂(上海歌凡生物科技有限公司)。携带FOXO1 基因的重组慢病毒及其阴性对照重组慢病毒由生工生物工程(上海) 股份有限公司构建,并完成包装和滴度测定等步骤。FITC 标记的CD29、CD34、CD44、CD45、CD71、人 类 白 细胞Ⅱ类抗原(human leukocyte class Ⅱ antigen-DR,HLA-DR)、 基 质 金 属 蛋 白 酶 9 (matrix metalloprotein-9,MMP-9 )、基质金属蛋白酶12(matrix metalloprotein-12,MMP-12 )、基质金属蛋 白 酶 抑 制 剂 1 (tissue inhibitor of metalloproteinase-1,TIMP-1)、GAPDH、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)、辣根过氧化物酶标记的山羊抗兔IgG 和异硫氰酸荧光素标记的山羊抗兔IgG(英国Abcam公司)。实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR) 仪(美 国Applied Biosystems 公司),光学显微镜(德国Leica 公司),DYY-6B 型稳压流转移电泳仪(北京市六一仪器厂)。
1.2 BMSCs 的分离和鉴定本研究中动物实验获得石河子大学医学院第一附属医院伦理委员会批准审核。在无菌环境下分离5 只小鼠的股骨和胫骨,磷酸盐缓冲液(phosphate buffer saline,PBS) 清洗干净,剪去骨骺端,暴露骨髓腔,采用含10%胎牛血清和1%青霉素-链霉素双抗的DMEM 培养液反复冲洗骨髓腔,收集冲洗液,以1 000 r·min-1离心5 min,弃去上清,加入新鲜培养液重悬细胞,以3×105cm-2的密度接种于培养瓶中,并置于37 ℃、5% CO2培养箱中培养,每2 d 换液1 次。当细胞基本长满瓶底壁时,采用0.25%胰蛋白酶消化,常规传代培养。收集培养的第5 代BMSCs,光学显微镜下观察细胞形态表现,通过成脂分化诱导培养基诱导14 d 后进行油红O 染色,成骨分化诱导培养基诱导21 d 后进行茜素红染色,分别测定细胞的成脂和成骨分化能力。PBS 缓冲液清洗细胞后重悬,取适量细胞悬液移入干净流式管中,加入FITC 标记的CD29、CD34、CD44、CD45、CD71和HLA-DR,孵育完成后,采用流式细胞术鉴定细胞表型。1.3 FOXO1 基因编辑BMSCs的构建取对数生长期的BMSCs,按照每孔1×105个细胞的密度接种于6 孔细胞培养板中,置于37 ℃、5% CO2培养箱中过夜培养。次日,按照病毒感染比值为50∶1,分别加入携带FOXO1 基因的重组慢病毒及其阴性对照重组慢病毒感染BMSCs,作为FOXO1-BMSCs 组和NC-BMSCs 组,另取正常培养的BMSCs 作为对照组。慢病毒感染时每24 h更换1 次培养基,转染48 h 后采用荧光显微镜观察BMSCs 中绿色荧光表达情况;采用1 mg·L-1嘌呤霉素筛选稳定表达的细胞株,并计算感染率。感染率=荧光细胞数/总细胞数×100%。
1.4 RT-qPCR 法检测BMSCs 中FOXO1 mRNA表达水平在BMSCs 中加入TRIzol 试剂裂解后提取总RNA,检测RNA 浓度和纯度,配制逆转录反应体系,将RNA 合成cDNA,置于-20 ℃保存。RT-qPCR 法检测细胞中FOXO1 mRNA 表达水平,以β-actin 作为内参。设计合成引物序列,FOXO1上游引物5'-GGGTTAGTGAGCAGGTTACAC-3',FOXO1下游引物5'-TCCAATGGCACAGTCCTTATC-3'; β-actin 上 游 引 物5'-CATCCACGAAACTACCTTCAACTCC-3',β -actin 下 游 引 物5'-GAGCCGCCGATCCACACG-3'。 以cDNA 样本为底物,根据荧光定量试剂盒说明书配制RTqPCR 上样体系,每组设置6 个重复孔,将体系瞬时离心后,在Bio-CFX96 仪上进行检测。扩增结束后,根据扩增曲线得到Ct 值,采用2-△△Ct法计算BMSCs 中FOXO1 mRNA 表 达 水 平。
1.5 Western blotting 法检测BMSCs 中FOXO1、MMP-9、MMP-12 和TIMP-1 蛋白表达水平将肺组织剪碎并研磨匀浆,在细胞或组织中添加RIPA裂解液,提取总蛋白,BCA 法测定蛋白浓度。制备10% SDS-PAGE 凝胶,将蛋白样品和适量上样缓冲液混匀,100 ℃水浴中煮沸5 min,取等量的蛋白上样,通过电泳分离,电转至PVDF 膜,浸入5%脱脂奶粉中室温封闭1 h,TBST 洗膜,加入一抗FOXO1、MMP-9、MMP-12 和TIMP-1,4 ℃孵育过夜。次日,加入对应二抗,室温孵育1 h。TBST 溶液再次洗膜,滴加ECL 避光反应30 min,紫外凝胶图像采集系统拍摄蛋白图像,采用Image-Pro Plus 软件分析蛋白条带灰度值, 以内参GAPDH 为基准,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/GAPDH 条带灰度值。
1.6 实验动物分组和模型构建将40 只小鼠随机分为4 组,分别为对照组、模型组、NC-BMSCs 组和FOXO1-BMSCs 组,每组10 只。对照组小鼠于第1、7 和14 天腹腔注射200 μ L 生理盐水,其余3 组小鼠采用OVA 与雾化激发的方法制备哮喘动物模型,参考文献[11]方法,于第0、7 和14 天腹腔注射200 μL 含2% OVA 与2%氢氧化铝的致敏剂。于第28、29 和30 天,将小鼠置于密闭容器内,雾化吸入1% OVA 进行激发,每日1 次,每次30 min。在第27 天雾化激发前,对照组和模型组小鼠尾静脉注射1 mL 生理盐水,NC-BMSCs 组小鼠尾静脉注射1 mL NC-BMSCs 悬液(每毫升1×107个细胞),FOXO1-BMSCs 组小鼠尾静脉注射1 mL FOXO1-BMSCs 悬液(每毫升1×107个细胞)。第35 天进行支气管肺泡灌洗,制备支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF),然后剥离肺组织,以 4%多聚甲醛固定。
1.7 各组小鼠BALF 中细胞分类计数将收集的小鼠BALF 以2 000 r·min-1低温离心15 min,弃上清,将细胞沉淀重悬于PBS 缓冲液中,采用血细胞计数板,将细胞液滴加至载玻片上并用玻璃盖玻片覆盖,固定干燥,进行瑞氏染色后,在光学显微镜下进行细胞计数,随机选择6 个不同视野,分类计数嗜酸性粒细胞、巨噬细胞、淋巴细胞和中性粒细胞数。
1.8 HE 染色检测各组小鼠肺组织病理形态表现取固定好的小鼠肺组织,常规石蜡包埋,切片机上制成5 μm 厚度的切片,进行HE 染色。切片进行脱蜡脱水后,苏木精染色5 min,流水冲洗,伊红染色3 min,流水再次冲洗,梯度乙醇脱水,二甲苯透明,中性树胶封片,晾干,在光学显微镜下观察小鼠肺组织病理形态表现。
1.9 免疫荧光双染实验检测各组小鼠肺组织中细胞染色情况将制备的小鼠肺组织切片进行脱蜡脱水和抗原修复后,甩干切片,滴加破膜工作液覆盖组织,室温孵育30 min,将玻片置于10%山羊血清中室温封闭20 min,弃掉封闭液,根据组织块大小滴加适量的一抗α-SMA (1∶100) 和PCNA(1∶100),置于4 ℃孵育过夜。次日,PBS 缓冲液洗涤后,将适量异硫氰酸荧光素标记的二抗(1∶500)滴加至组织切片上,室温避光孵育1 h。加入DAPI 室温避光染色 10 min,采用防淬灭封片剂封片,晾干,在激光共聚焦显微镜下观察细胞染色情况。
1.10 各组小鼠气道形态参数测量取制备的各组小鼠肺组织切片,光学显微镜下获取肺内支气管横断面,采用Image-Pro Plus 软件分别测量支气管管腔内周长(Pi)、管壁面积(W)、支气管平滑肌面积(S) 和支气管平滑肌细胞核数目(N)。计算S/Pi、W/Pi 和N/Pi,评估气道厚度。
1.11 统计学分析采用SPSS 23.0 统计软件进行统计学分析。GraphPad Prism 8.30 绘制统计图。BMSCs 中FOXO1 mRNA 表 达 水 平, FOXO1、MMP-9、MMP-12 和TIMP-1 蛋白表达水平,各组小鼠嗜酸性粒细胞、巨噬细胞、淋巴细胞和中性粒细胞数,S/Pi、W/Pi 和N/Pi 均符合正态分布,以±s表示,多组样本均数间样本均数比较采用单因素方差分析,组间样本均数两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 BMSCs 形态表现鉴定结果通过倒置显微镜观察到细胞呈纺锤形,形态均匀;经油红O 染色后观察到明显红色脂滴形成,茜素红染色后可见明显的橘红色沉淀,见图1;流式细胞术检测结果显示:CD29、CD44 和CD71 呈高表达,而CD34、CD45 和HLA-DR 呈低表达,见图2。

图1 BMSCs 形态表现(Bar=250 μm)Fig.1 Morphology of BMSCs(Bar=250 μm)

图2 流式细胞术鉴定 BMSCs 表型Fig.2 Phenotypes of BMSCs identificated by flow cytometry
2.2 FOXO1 基因编辑BMSCs 鉴定结果在倒置荧光显微镜下观察到对照组BMSCs 中无明显的绿色 荧 光, NC-BMSCs 组 和 FOXO1-BMSCs 组BMSCs 中可见大量绿色荧光,感染率分别为95.50% 和97.86%,见图3;与对照组(1.00±0.05, 0.35±0.03) 和NC-BMSCs 组 (1.02±0.08, 0.32±0.03) 比 较, FOXO1-BMSCs 组(2.97±0.24, 1.24±0.12) BMSCs 中 FOXO1 mRNA 和蛋白表达水平升高(P<0.05)。见图4。

图3 荧光显微镜观察各组BMSCs 中绿色荧光表达情况 (×100)Fig.3 Expressions of green fluorescence in BMSCs in various groups observed by fluorescence microscope (×100)

图4 各组BMSCs 中FOXO1 mRNA 表达水平和FOXO1 蛋白表达情况Fig.4 Expression levels of FOXO1 mRNA and expressions of FOXO1 protein in BMSCs in various groups
2.3 各组小鼠BALF 中细胞分类计数结果模型组小鼠BALF 中嗜酸性粒细胞、巨噬细胞、淋巴细胞和中性粒细胞数均高于对照组(P<0.05);与模型组比较,NC-BMSCs 组和FOXO1-BMSCs 组小鼠BALF 中嗜酸性粒细胞、巨噬细胞、淋巴细胞和中性粒细胞数减少(P<0.05);与BMSCs 组比较,FOXO1-BMSCs 组BALF 中嗜酸性粒细胞、巨噬细胞、淋巴细胞和中性粒细胞数减少(P<0.05)。见表1。
表1 各组小鼠BALF 中细胞分类计数Tab.1 Counts of cell classification in BALF of mice in various groups (n=10,±s,×104 mL-1)
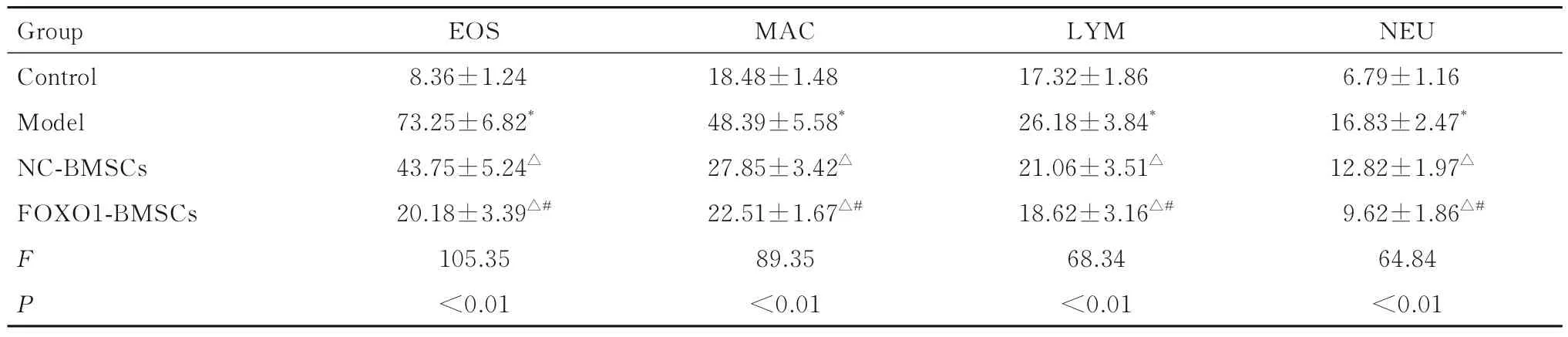
表1 各组小鼠BALF 中细胞分类计数Tab.1 Counts of cell classification in BALF of mice in various groups (n=10,±s,×104 mL-1)
Note:EOS, eosinophils; MAC, macrophage; LYM, lymphocyte; NEU,neutrophils.*P<0.05 compared with control group; △P<0.05 compared with model group; #P<0.05 compared with NC-BMSCs group.
NEU 6.79±1.16 16.83±2.47*12.82±1.97△9.62±1.86△#64.84<0.01 Group Control Model NC-BMSCs FOXO1-BMSCs FP EOS 8.36±1.24 73.25±6.82*43.75±5.24△20.18±3.39△#105.35<0.01 MAC 18.48±1.48 48.39±5.58*27.85±3.42△22.51±1.67△#89.35<0.01 LYM 17.32±1.86 26.18±3.84*21.06±3.51△18.62±3.16△#68.34<0.01
2.4 各组小鼠肺组织病理形态表现嗜酸性粒细胞胞浆呈鲜红色,与对照组比较,模型组小鼠气道管腔变窄,基底膜变厚,气道和肺泡均有大量嗜酸性粒细胞浸润;与模型组比较,NC-BMSCs 组和FOXO1-BMSCs 组小鼠气道和肺泡内炎性细胞浸润受到抑制,组织损伤减轻,嗜酸性粒细胞明显减少;与NC-BMSCs 组比较,FOXO1-BMSCs 组小鼠气道和肺泡周围区域未见明显炎性细胞浸润。见图5。

图5 各组小鼠肺组织病理形态表现(HE,×200)Fig.5 Pathomorphology of lung tissue of mice in various groups (HE, ×200)
2.5 各组小鼠肺内支气管参数与对照组比较,模 型 组 小 鼠S/Pi、 W/Pi 和N/Pi 均 升 高(P<0.05);与模型组比较,NC-BMSCs 组和FOXO1-BMSCs 组 小 鼠S/Pi、 W/Pi 和N/Pi 降 低(P<0.05);与NC-BMSCs 比 较,FOXO1-BMSCs 组小鼠S/Pi、W/Pi和N/Pi降低(P<0.05)。见表2。
表2 各组小鼠S/Pi、W/Pi 和N/PiTab.2 S/Pi, W/Pi ,and N/Pi of mice in various groups(n=10,±s)

表2 各组小鼠S/Pi、W/Pi 和N/PiTab.2 S/Pi, W/Pi ,and N/Pi of mice in various groups(n=10,±s)
*P<0.05 compared with control group; △P<0.05 compared with model group; #P<0.05 compared with NC-BMSCs group.
N/Pi(μm-1)Group S/Pi(μm2/μm)W/Pi(μm2/μm)0.02±0.01 0.05±0.02*0.03±0.01△0.02±0.01△#53.28<0.01 Control Model NC-BMSCs FOXO1-BMSCs FP 6.36±0.95 12.65±1.35*8.27±0.85△7.02±1.04△#72.31<0.01 2.94±0.56 6.82±1.25*4.32±1.17△3.15±0.63△#69.21<0.01
2.6 各组小鼠肺组织中α-SMA 和PCNA 表达情况免疫荧光双染实验检测结果显示:与对照组比较,模型组小鼠肺组织中红色和绿色荧光表达增加,说明α-SMA 和PCNA 表达升高;与模型组比较,NC-BMSCs 组和FOXO1-BMSCs 组小鼠肺组织中红色和绿色荧光表达均减弱,说明α-SMA 和PCNA 表达降低,FOXO1-BMSCs 组小鼠肺组织中红色和绿色荧光减弱更为明显,说明α-SMA 和PCNA 表达更低。见图6。

图6 各组小鼠肺组织中α-SMA 和PCNA 表达情况(免疫荧光双染,×100)Fig.6 Expressions of α-SMA and PCNA in lung tissue of mice in various groups (Immunofluorescence double staining,×100)
2.7 各组小鼠气道重塑相关蛋白表达水平与对照组比较,模型组小鼠肺组织中MMP-9、MMP-12和TIMP-1 蛋白表达水平升高(P<0.05);与模型组比较,NC-BMSCs 组和FOXO1-BMSCs 组小鼠肺组织中MMP-9、MMP-12 及TIMP-1 蛋白表达水平 降 低 (P<0.05); 与 NC-BMSCs 组 比 较,FOXO1-BMSCs组小鼠肺组织中MMP-9、MMP-12和TIMP-1 蛋白表达水平降低(P<0.05)。见表3。
表3 各组小鼠肺组织中MMP-9、MMP-12 和TIMP-1 蛋白表达水平Tab.3 Expression levels of MMP-9,MMP-12,and TIMP-1 proteins in lung tissue of mice in various groups (n=10,±s)
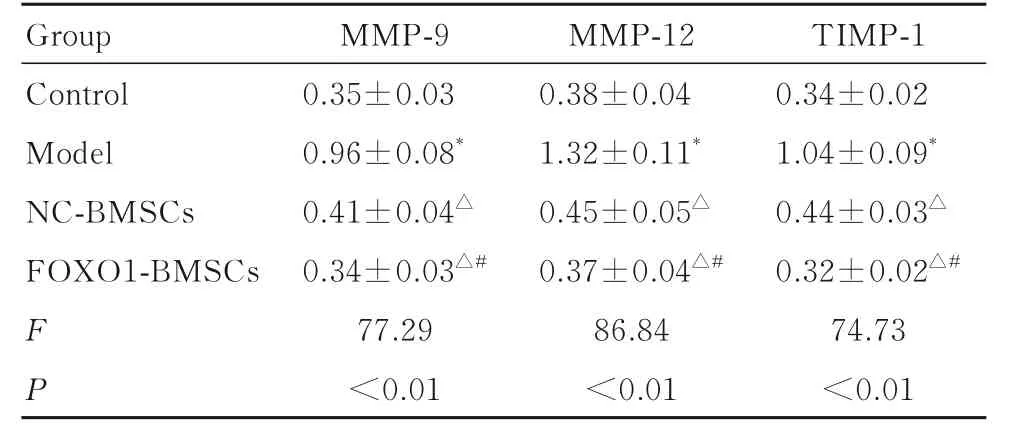
表3 各组小鼠肺组织中MMP-9、MMP-12 和TIMP-1 蛋白表达水平Tab.3 Expression levels of MMP-9,MMP-12,and TIMP-1 proteins in lung tissue of mice in various groups (n=10,±s)
*P<0.05 compared with control group; △P<0.05 compared with model group; #P<0.05 compared with NC-BMSCs group.
TIMP-1 Group MMP-9MMP-12 0.34±0.02 1.04±0.09*0.44±0.03△0.32±0.02△#74.73<0.01 Control Model NC-BMSCs FOXO1-BMSCs FP 0.35±0.03 0.96±0.08*0.41±0.04△0.34±0.03△#77.29<0.01 0.38±0.04 1.32±0.11*0.45±0.05△0.37±0.04△#86.84<0.01
3 讨 论
哮喘是一种在儿童和成人中高发的慢性非传染性疾病,主要临床表现为气促伴或不伴咳嗽及反复发作的喘息。BMSCs 作为种子细胞具有多项优势,主要包括获取方便、对供体损伤和与生物支架的黏附性能好,并可通过诱导分化形成骨、软骨、脂肪、肌肉和纤维等组织,具有很强的扩展能力;此外,该细胞不表达主要组织相容性复合体Ⅱ类,因此,其可以逃避免疫监视,无须事先进行免疫修饰即 可 使 用[6,12]。目 前,关 于BMSCs 移 植 对 哮 喘 及其并发症的治疗作用引起了研究者的广泛关注,BMSCs 表达的多种细胞因子和趋化因子受体致使其迁移到发炎的组织中,组织中促炎细胞因子水平升高会导致BMSCs 分泌抗炎因子的增加,从而改善包括哮喘在内的炎症性疾病。FOXO1 在生理和病理过程中能够响应多种刺激来维持组织稳态。有研究[13]显示:FOXO1 是主要上游炎症信号的介质,通过信号转导、转录调控和与其他转录因子以组合的方式来调节炎症反应,在抗炎及促炎特性方面具有双重功能,而其具体功能取决于调节的下游靶标分子[13]。由此可见,FOXO1 的调控能力及其作用可能为炎性疾病的预防和治疗提供重要途径。HUANG 等[14]研 究 显 示:FOXO1 在 糖 尿 病 肾 病小鼠模型中对肾脏组织起到保护作用,提高FOXO1 表达可防止糖尿病诱导的肾小管间质纤维化和细胞凋亡;HUANG 等[15]研究显示:FOXO1过表达保护人牙周膜干细胞免受氧化损伤,并具有抗炎作用,能够增加炎症环境中成骨标志物Runx2和SP7 的表达。此外,FOXO1 能够促进BMSCs 分泌抗炎因子,从而起到免疫抑制作用[10],提示过表达FOXO1 的BMSCs 有望进一步缓解哮喘疾病。本研究结果显示:与BMSCs 单独作用的哮喘小鼠比较,使用过表达FOXO1 的BMSCs 作用的哮喘小鼠肺组织损伤减轻,气道与肺泡内炎性细胞浸润均受到抑制,提示FOXO1 可以增加BMSCs 对哮喘小鼠肺组织病理损伤的改善效果。
气道炎症是哮喘的重要病理特征,会引起气道结构组织学发生变化,从而导致肺功能下降。哮喘气道炎症涉及多种细胞因子、黏附分子和炎症介质参与,如嗜酸性粒细胞、淋巴细胞、巨噬细胞和中性粒细胞等[16]。其中,嗜酸性粒细胞被认为是哮喘发展过程中的一种重要效应细胞,气道周围大量嗜酸性粒细胞浸润是哮喘发生的标志[17]。此外,嗜酸性粒细胞也改变感觉神经结构和反射性支气管收缩的调节作用,从而使支气管收缩恶化[18],提示嗜酸性粒细胞和气道神经之间的相互作用导致气道高反应性和支气管过度收缩,这突显了抑制嗜酸性粒细胞释放在缓解哮喘中的重要性。本研究结果显示:与BMSCs 单独作用的哮喘小鼠比较,过表达FOXO1 的BMSCs 作用的哮喘小鼠BALF 中嗜酸性粒细胞、巨噬细胞、淋巴细胞和中性粒细胞数均减少,并可见气道及肺泡内嗜酸性粒细胞数明显减少,说明过表达FOXO1 的BMSCs 可以进一步缓解气道炎症,从而缓解哮喘疾病。
气道重构是呼吸道炎性反应反复损伤和修复的结果,是造成哮喘不可逆性气道阻塞及肺功能损害从而导致难治性哮喘的主要病理基础[19]。目前,寻找有效控制气道重构的方法并阐明其分子机制是治疗哮喘的关键。气道中的上皮细胞随着疾病进展发生间质转化,成纤维细胞被激活并分化为肌成纤维细胞,该细胞产生大量细胞外基质蛋白,包括α-SMA、MMP-9、MMP-12和TIMP-1。α-SMA作为肌动蛋白异构体,其表达升高与炎症和组织纤维化均有关[20]。MMPs 作为细胞外蛋白质水解酶,TIMP-1 能够与其特异性结合,两者影响气道结构的完整性。而当MMPs 水平升高时,TIMP-1 抑制蛋白酶分解的速度未能与其达到动态平衡状态,从而导致基质被破坏,这与哮喘中肺部炎症和气道重构密切相关[21]。本研究结果显示:与BMSCs 单独作用的哮喘小鼠比较,过表达FOXO1 的BMSCs作用的哮喘小鼠气道厚度指标小鼠S/Pi、W/Pi 和N/Pi 均降低,此外,肺组织中α-SMA、MMP-9、MMP-12 和TIMP-1 蛋白表达水平也降低,说明过表达FOXO1 的BMSCs 有助于缓解气道重构,从而缓解哮喘疾病。
综上所述,过表达FOXO1 能够提高BMSCs对哮喘小鼠的治疗作用,抑制气道和肺泡内嗜酸性粒细胞浸润与气道重构,从而对肺组织起到保护作用,这为哮喘的治疗提供了新思路。但关于FOXO1 发挥功能的具体反应机制还需后续进行深入探讨。

