基于超高分辨率和超长深度光学相干层析成像技术的悬尾鼠航天相关神经眼综合征研究*
陈思思 张 玺 郑 谷 汪庆映 丁学雯 陈宇雷 舒咬根
1(国科温州研究院 温州生物材料与工程研究所 温州 325001)
2(温州医科大学附属眼视光学院 温州 325027)
3(国家药监局疫苗及生物制品质量监测与评价重点实验室 温州 325001)
4(瓯江实验室(再生调控与眼脑健康浙江省实验室) 温州 325024)
0 引言
美国国家航空航天局(NASA)研究发现,执行短期和长期任务的航天员分别有29%和60%出现了远视和近视敏锐度下降的症状,其中在太空驻留6个月以上的航天员还患上了不可逆转的视觉障碍[1-3]。其症状表现为视盘水肿、脉络膜增厚、棉絮斑和远视移位等,统称为航天相关神经眼综合征(Spaceflight Associated Neuro-ocular Syndrome,SANS)[3-5]。视觉障碍影响人类85%的信息获取,因此是航天员面临的最大健康风险,也是未来移民外星计划的最大挑战。目前普遍认可的SANS发病机制是长期失重导致颅内高压的假说[6-10],但是关于SANS与失重之间的分子机制尚未被揭示。由于在中国空间站直接进行动物实验的条件还不成熟,且成本太高,因此建立地面可行的SANS研究模型对于进一步探索疾病的发病机制和寻找有效的临床治疗方案是目前比较经济可行的替代措施[11]。
2016—2021年中国先后开展了地面悬尾鼠的实验研究[12-17],悬尾时间从几天到12周不等。实验结果表明,鼠悬尾时间越长,视力损失越明显。初期仅观察到血流速度降低,无视网膜厚度改变;8周后眼底可见视网膜外核层厚度变薄,脉络膜血管增多;12周后则可见视网膜轴突超微结构改变和细胞凋亡等。上述地面悬尾鼠模型可以模拟出失重鼠眼部轻微损伤,但尚未模拟出SANS的临床或亚临床症状,这可能与悬尾时间短、成像技术差及视盘部位测量缺失有关,因此有研究提出应重视视盘部位变化的监测[18]。
近期快速发展起来的光学相干断层扫描技术(Optical Coherence Tomography,OCT)因其超高的分辨率和无创的检查手段而优于传统病理学切片,可以弥补上述技术缺失。OCT使用低相干光源对组织进行断层扫描,形成光学切片,通过量化从组织反射至探测器的光波强度,可以测量组织不同层次的深度信息,因而在眼神经疾病中有较高的辅助诊断价值[19]。本研究选用自行构建的OCT,对悬尾鼠进行在体眼球特征参数测量,前期工作[20,21]证明此方法具有较高的重复性和便捷性。
NASA也使用OCT对航天员进行眼部检查,对比飞行前后的眼部数据发现,视神经增厚常伴随视盘水肿的症状,并且早于后者[2],即视盘水肿的亚临床期为视神经层增厚。为此,本文利用构建的OCT系统对较长期悬尾鼠的眼部特征参数进行观测,为建立经济可行的SANS动物模型提供在体眼部特征参数测量及评估的新方法。
1 材料与方法
1.1 动物
1.1.1 分组
实验采用SPF级雄性Sprague Dawley大鼠18只,体重为220~240 g。所有动物均在标准实验室条件(温度:18~23 ℃;湿度:40%~65%)下饲养,并在环境光照强度为15 lx的条件下进行12 h的明暗调节。将18只大鼠随机分为基础对照组、对照一个月组和悬尾一个月组,每组各6只。所有大鼠均在相同环境条件下适应性饲养一周后再开始分组实验(计时开始),第0天测量所有大鼠的体重及眼部特征参数,并记作两组大鼠共同的基线数值。一周内进行两次随访,分别于第0, 3, 8, 10, 13, 18, 24, 27天测量大鼠体重。在实验第27天使用戊巴比妥钠和甲苯噻嗪麻醉大鼠,再用托吡卡胺散瞳后测量大鼠眼部和眼底亚层参数。本研究遵照视觉与眼科研究协会(ARVO)“关于在研究中使用动物的声明”进行实验。所有程序均经温州医科大学实验室机构动物护理和使用委员会及国科温州研究院机构动物护理和使用委员会批准(伦理批件号:wydw2022-0191,WIUCAS 22040701)。
1.1.2 微重力大鼠模型
采用悬尾法模拟大鼠失重,构建SANS模型[22](见图1),悬尾组的大鼠被单笼饲养,对照组与实验组的则采用相同实验条件饲养。所有大鼠适应性饲养一周后,首先将实验组大鼠尾巴用75%医用酒精棉片消毒,将两条长约20 cm、宽约1 cm的医用胶带沿大鼠尾巴纵向固定,两条胶带的中间空余部分不与皮肤接触。将尾巴用医用纱布包裹以保护皮肤并加固。胶带近端距离大鼠尾巴根部约2 cm,中间紧贴大鼠尾巴,远端超出部分悬挂固定于特制的鼠笼顶部,保持鼠尾部悬吊,后肢悬空,前肢部分接触地面,但尚不足以减轻头部及上肢所需承受的全身重量。悬尾期间保持大鼠处于头低位,身体纵轴与水平线呈-30°夹角。大鼠前肢可在水平面360°自由移动。实验期间保持饲料和水源充足,所有大鼠可自由饮水和进食。

图1 大鼠悬尾模型实验Fig.1 Diagram of rat tail suspension
1.2 仪器
1.2.1 视网膜眼底照相
采用Phoenix Micron IV小动物视网膜显微成像系统对大鼠进行在体视网膜形态检查。首先将大鼠麻醉以保持相对固视状态,然后在大鼠双眼中滴复方托吡卡胺滴眼液以散瞳,增大拍摄范围,再涂甲基纤维素眼用凝胶于大鼠角膜表面,使凝胶作为透明屈光介质位于角膜和镜头之间。接下来将大鼠平放于动物台上,调整系统仪器位置,使眼底视盘中心、角膜顶点、显示器注视点位于同一水平。若在观察过程中出现视野不全或离焦,及时微调试验台各组件的位置。如图2(a)所示,调整镜头焦距至大鼠眼底清晰可见时即可拍摄眼底图像。眼底内科临床医生根据保存的所有眼底图像判断视盘水肿症状是否存在。
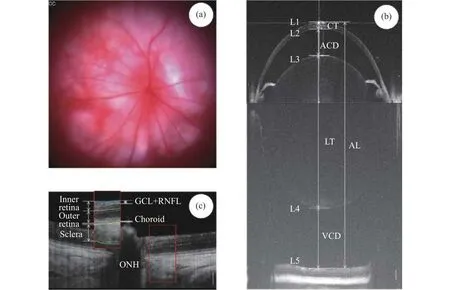
图2 大鼠眼成像及分析。(a)大鼠眼底彩照,OD表示右眼,(b)大鼠超长深度OCT全眼成像,(c)大鼠超高分辨率OCT眼底成像及分层界限和层次定义。白色竖线为200 µm标尺Fig.2 Schematic representation of rat ocular imaging and analysis.(a) Rat fundus color photograph (OD represents the right eye), (b) rat ultra-long depth OCT imaging of the entire eye, (c) rat high-resolution OCT fundus imaging with layer boundaries and definitions, with the white vertical line representing a 200 µm scale
1.2.2 超长深度光学相干断层扫描
采用超长深度光学相干断层扫描(Ultra-Long Optical Coherence Tomography, ULOCT。中心波长840 nm,带宽45 nm,轴向分辨率10 µm,成像深度7.20 mm)测量大鼠眼部相关特征参数。OCT扫描的样品臂和探头部分安装了二维扫描振镜,即“十字扫描对准”,可与探头在鼠眼上同时进行移动,确保OCT探头对准鼠眼而无偏斜。扫描前需确认OCT图像在水平方向和垂直方向同时存在角膜顶点镜面反光,且虹膜尽量处于水平。OCT使用固定参考镜,通过部分干涉原理显示相对于参考镜的光反射表面的位置。光谱仪测量的干涉信号由高速相机通过数据采集卡采集,再经傅里叶变换得到剖面深度信息。大鼠的眼轴比小鼠的长,测量小鼠眼轴的OCT装置由于硬件限制无法对大鼠眼轴完整成像,因此将参考臂长设置在晶状体的中间位置附近,大鼠眼部的一半会以镜像形式成像,使得大鼠眼部的前段和后段在同一窗口内以重叠的形式显示,这种方法被证明是有效的[23]。每次扫描形成的二维图像为2048×2048 pixel,经过Matlab 2010 a自编软件处理,分别探测到角膜上下边界L1和L2、晶状体上下边界L3和L4、视网膜色素层边界L5,其中角膜厚度CT定义为L2-L1、前房深度ACD定义为L3-L2,晶状体厚度LT定义为L4-L3,玻璃体腔深度VCD定义为L5-L4,眼轴长度AL定义为L5-L1,如图2(b)所示。
1.2.3 视网膜超高分辨率光学相干断层扫描
采用视网膜超高分辨率光学相干断层扫描(Ultra-High Resolution Optical Coherence Tomography,UHROCT。中心波长850 nm,带宽100 nm,轴向分辨率3.1 µm,成像深度1.98 mm)测量大鼠眼底亚层结构参数。为便于实时进行眼底亚层定位,OCT样品臂同时加装一共轴摄像机,将视盘部位调整至图像中间后再采集数据。为便于观测视网膜亚层结构,在OCT上装配60 D(D为屈光度单位)的目镜,将大鼠视神经细胞层和神经纤维层定义为神经节层;将视网膜外核层内界至神经节层外界之间的视网膜组织定义为视网膜内层,将外核层内界至脉络膜内界之间的视网膜组织定义为视网膜外层。每次扫描形成的视盘部位(ONH)眼底二维图像像素为2048×2048 pixel,数据经过Matlab 2010 a自编软件处理后分别得到神经节层、视网膜内层、视网膜外层、脉络膜和巩膜等的厚度,如图2(c)所示。
1.3 统计学处理
采用SPSS 22.0软件进行统计分析。大鼠体重参数使用重复测量方差分析。眼部特征参数呈正态分布的计量资料以x±s表示。各组数据符合正态分布且方差齐,采用单因素方差分析(One-way ANOVA),以p<0.05 为差异显著,p<0.01 为差异极显著。
2 结果
2.1 体重变化数据
关于悬尾实验组(suspended)与非悬尾对照组(control)的大鼠体重变化,实验前第0天两组大鼠体重变化无统计学差异(p>0.05),第3, 8, 10, 13天悬尾实验组和非悬尾对照组大鼠体重存在统计学差异(第3天p<0.05,其余p<0.01),前者的体重比后者轻,但在第18, 24, 27天所测两组体重无统计学差异(p>0.05)(详见图3)。数据显示第18天后,二者的体重无统计差异。悬尾期间大鼠的体重增长率是反映其应激程度的总体指标,因此体重的长期稳定增长表明本实验引起的应激较小。

图3 大鼠体重随悬尾天数的变化统计(统计数量n=6。数据显示第18天后二者的体重无统计差异)Fig.3 Statistical rat body weight over the duration of tail suspension(The data indicated that there were no statistically significant differences in body weight between the two groups after the 18th day, the number of statistical samples for each group n is equal to 6)
2.2 大鼠视网膜眼底彩照未出现视盘水肿症状
经眼底内科临床医生评估,所有大鼠双眼眼底彩照都为正常眼底,均未出现明显的视盘水肿症状及其他异常。如图2(a)所示,眼底彩照中大鼠视网膜呈橘红色,圆形视乳头呈淡红色,二者边界清,无异常隆起,视网膜血管从视盘中央通过。视网膜血管走形正常,无明显迂曲扩张,未见出血点及渗出病灶。
2.3 大鼠ULOCT眼部特征参数显示悬尾后眼轴明显缩短
图4给出大鼠眼部特征参数及眼底亚层结构参数统计分析结果,从图4(a)可以看出,与第0天测得的大鼠眼部baseline特征参数比较,非悬尾对照组一个月后对应的特征参数变化情况为:角膜厚度(CT)增加,前房深度(ACD)增加,晶状体厚度(LT)增大,玻璃体腔深度(VCD)增加,眼轴长度(AL)增加,除VCD外,其余均有明显统计学差异(p<0.01);悬尾一月后实验组对应的特征参数变化情况为:角膜厚度(CT)减小,前房深度(ACD)增加,晶状体厚度(LT)增加,玻璃体腔深度(VCD)减小,眼轴长度(AL)增加,除CT外,其余均有明显统计学差异(p<0.05 )。重要的是悬尾一个月后实验组与非悬尾组特征参数的比较,研究发现大鼠角膜明显变薄(p<0.01),眼轴缩短(p<0.05),其他参数则无明显统计学差异(p>0.05)。

图4 大鼠眼部特征参数(a)及眼底亚层结构参数统计分析(b)。数据表明悬尾一个月后,眼轴明显缩短且视网膜外层厚度显著下降Fig.4 Statistical graph of rat ocular feature parameters (a) and sublayer parameters of the fundus (b).The data indicated that after suspension of one month there was a significant decrease in axial length and outer retina thickness
2.4 UHROCT眼底亚层特征参数显示视网膜外层厚度显著下降
分别在实验第0天和一个月后测量大鼠眼底亚层特征参数,包括视神经层(RNFL-GCL)、视网膜内层(Inner Retina)、视网膜外层(Outer Retina)、脉络膜(Choroid)、巩膜(Sclera)。根据图4(b)的统计分析结果,悬尾一月后实验组与非悬尾对照组相比,视网膜外层厚度显著下降,差异有统计学意义(p<0.05)。非悬尾对照组与第0天基线值相比,视网膜内层厚度变薄,有显著统计学差异(p<0.01)。其余无统计学差异(p>0.05)。其中在视神经层中,尽管统计学上未有显著性差异,但实验发现悬尾鼠组在一个月后的视神经层厚度为29.91±8.63 µm,对照组一个月后为26.29±10.53 µm,基础组为27.12±8.44 µm,表明悬尾组的视神经层厚度有轻微增厚趋势。
3 讨论
根据长期失重动物实验的模拟要求[22,24],通过体重监测可以保障微重力大鼠模型实验的成功。图1数据显示,短期悬尾处理对大鼠生长发育存在影响,但长期(18天后)悬尾处理对体重无明显影响。研究结果表明本文采用的长期悬尾对大鼠的生长发育应激影响较小。
基于自行构建的OCT 系统对悬尾鼠眼部特征参数(角膜厚度、前房深度、晶状体厚度、玻璃体腔深度、眼轴长度以及眼底亚层)进行在体成像及定量分析,同时对悬尾鼠眼底彩照也做了定性分析。通过随访观察各眼部特征参数,成功建立了地面模拟失重的动物模型,发现SANS亚临床前期的眼部症状,例如眼轴明显缩短[2]。因此,通过长期悬尾处理以及适当的监测即可成功建立SANS动物模型,为后期研究SANS的发病机制和治疗手段提供依据。
本研究使用的是无创在体检测手段,在未处死实验动物的前提下即可检测到SANS症状,避免经常解剖实验组离体鼠眼导致的非自身对照偏差,并为后续在体动物实验保留了宝贵的模式动物。
国际空间站自建立以来已经开展多次空间小鼠实验。2013—2020年间,美国加利福尼亚州的Mao和Roque-Torres团队[25-29](Loma Linda University)对空间小鼠眼部变化进行了离体研究。实验在小鼠麻醉后摘取了眼球,通过TUNEL免疫细胞化学分析,与地面对照组比对后发现,航天飞行诱导了小鼠视网膜细胞(尤其是视神经节细胞)的显著凋亡[25,28]。通过蛋白测定,发现参与血管渗透屏障的水通道蛋白AQP4的表达量显著增加[26]。最近,其采用Micro-CT 对离体鼠眼进行结构测定,发现空间组小鼠眼睛发生了结构变化,尤其是视网膜、色素层和脉络膜层的厚度明显降低[30]。但是这些发现离SANS症状的直接证据较远。 2016—2021年 Zhao 等[13]、Dai等[14]和Gong等[15,16]开展了地面悬尾鼠的实验研究,将实验鼠分别悬尾1天、4天、7天、14天、30天和12周不等,在各时间节点检测实验鼠眼部特征参数。研究结果表明:使用彩色多普勒超声诊断仪检测眼轴和视网膜中央动脉血流速度发现:悬尾第一天血流速度加快,但7天内血流速度下降,悬尾14天后血流速度部分回升,但眼底彩照未见视盘水肿、出血、视网膜出血、渗出等症状;使用商用OCT 测量距离视盘水平颞侧2个视盘直径处的视网膜、脉络膜厚度发现,悬尾1天、4天、7天、14天、30天、4周视网膜厚度均无显著变化,8周内核层变薄,伊红染色表现为退行性病变;悬尾14天、8周脉络膜厚度仍无显著变化;使用OCT、荧光造影检测视乳头直径、视网膜厚度、视网膜大血管直径,发现视网膜大血管管径在悬尾30天内增加,解除悬尾处理后管径恢复,视乳头直径无明显变化;使用闪光眼电图和视觉诱发电位检测视觉功能发现,悬尾8周视觉功能较正常水平下降,表现为眼电图的OPs波反应幅值降低,悬尾12周视觉功能显著下降,表现为神经节细胞数量减少,视神经损伤,轴突密度降低。但是这些研究均未检测到典型的SANS症状,例如远视移位对应的眼轴缩短、视盘水肿和脉络膜充血增厚等。
由于大鼠眼轴较小鼠更长,因此自行构建了改进的OCT进行测量,研究发现视神经厚度改变前发生了明显的眼轴缩短症状,与SANS的远视移位症状吻合。定量分析结果发现,悬尾1月后发现眼轴缩短约100 µm,角膜厚度变薄13 µm。据此可以推测SANS的发生发展过程:首发症状为眼轴缩短,导致远视移位,同时伴有视网膜外层改变和角膜厚度变薄等症状;其次为视神经层水肿导致的厚度改变,并进展为视盘部位水肿;最终引发SANS的其他如棉絮斑、球后极部扁平和脉络膜皱褶增厚等远期症状。
此外,基础组与对照组的统计数据表明:除视网膜内层变薄以外,所有参数均无统计学差异。该结果与其他团队长期观察正常对照组大鼠的眼底亚层结构变化趋势一致[31]。眼部形态参数中,除玻璃体腔深度之外,其他参数均有显著增大,表明鼠眼球形态可在一个月后发生显著发育增长,与离体冷冻切片研究小鼠眼球形态发育的结果基本一致。此外,角膜厚度、晶状体厚度和眼轴均增长[32]。
本文实验没有发现SANS最典型的视盘水肿症状,只发现了SANS的亚临床前期症状,这可能与悬尾时间较短有关。为此,将继续开展更长时间的悬尾实验研究,以期观察到完整的SANS症状。由于大鼠的饲养环境为SPF屏障环境,即取出测量后无法再返回屏障环境,因而本实验无法对大鼠进行长期的自身对照研究。后续会对动物房进行改扩建,以容纳大型的眼科设备,便于开展观察节点更为密集的研究,对眼部各症状发生发展的分子机制[33]开展进一步探索。此外,大鼠的尾部悬吊材料和方式也需要进一步优化,减少其对皮肤的刺激,满足更长期悬尾实验的要求。
尽管目前研究均未提出SANS的分子机制,本文根据现有的研究成果提出了TRPV4(Transient Receptor Potential IV)通道和视盘水肿的分子假说:TRPV4是力(例如压力和渗透压)致敏感型瞬时受体电位IV型离子通道,外界压力的改变会使通道失控,最终导致膜电位异常[34-36]。TRPV4通常与水通道蛋白AQP4(Aquaporin)偶联,后者又与多个水肿过程密切相关[34,37],是治疗脑脊液流体动力学受损和颅内压升高的神经疾病的潜在靶点。研究发现视网膜上的视神经细胞膜表面分布了大量TRPV4通道[37],由此可以推断视盘水肿与TRPV4通道异常密切相关。因此可以提出假说:失重造成的颅内压与眼压的反差导致了TRPV4与AQP4的偶联异常,最终诱发不可逆的SANS,后续SANS的症状是其继发的临床表现。本文研究为揭示微观层面的分子机制提供了宏观的动物模型以及观测方法。
4 结论
研究建立了航天相关神经眼综合征(SANS)的动物模型,基于自行构建的ULOCT和UHROCT平台提出了在体眼部测量及评估的新方法。这些新设备和新方法具有更高的精度和稳定性。因此可以发现SANS亚临床期的眼轴长度和眼底亚层厚度发生的细微变化,而传统的眼底彩照技术不能及时观察到这些细微变化。本研究为后续开展微观层面的SANS分子机制研究提供了宏观的动物模型以及在体眼部测量新方法,同时希望尽早与空间站实验鼠的数据进行比对,进一步完善SANS的实验和理论研究。

