甜橙糖转运蛋白 CitSWEET15 基因的表达分析与转运活性检测
郑乾明,王小柯,王红林,解 璞,付慧敏,陈传武*
1. 贵州省农业科学院果树科学研究所,贵州贵阳 550006;2. 广西桂北特色经济作物种质创新与利用实验室/广西特色作物研究院,广西桂林 541004
可溶性糖组分和含量是决定果实品质的最关键因子,也是园艺作物育种和改良的重要研究方向。果实积累的可溶性糖主要包括葡萄糖、果糖、蔗糖和山梨醇等,来自于源器官的光合作用,经韧皮部装载、长距离运输和卸载,进入果实细胞参与代谢、转运和储存[1]。这一系列过程涉及糖的多次跨膜运输,均需要糖转运蛋白(或载体)介导。
植物糖转运蛋白主要包括易化扩散载体超家族(major facilitator superfamily, MFS)的蔗糖转运蛋白(sucrose transporter, SUT)和单糖转运蛋白(monosaccharide transporter, MST),以及新型SWEET家族[2]。SUT和MST通常含有12个跨膜结构域,偶联质子介导糖的跨膜转运[3-4]。2010年CHEN首次使用荧光共振能量转移技术(fluorescence resonance energy transfer, FRET)鉴定了AtSWEET1的葡萄糖转运活性,该蛋白含7个跨膜螺旋结构域,依赖细胞内外糖浓度梯度而非跨膜质子梯度来完成跨膜转运功能[5]。拟南芥SWEET家族的17个成员分为四类,Ⅰ和Ⅱ类均定位于细胞膜,转运葡萄糖等单糖,参与花发育,种子萌发,宿主-病原体互作等;Ⅲ类定位于细胞膜,主要转运蔗糖,参与蔗糖的韧皮部装载,花蜜分泌,花、果实及种子发育等;IV类定位于液泡膜,转运果糖、葡萄糖和蔗糖,控制果糖积累,调控耐寒性[6]。
近年来通过同源搜索获得大量园艺作物的SWEET家族信息,且大量研究表明SWEET影响果实可溶性糖积累,参与果实发育和成熟。葡萄SWEET家族含有17个成员[7],VvSWEET10主要在果实转色期表达,参与己糖积累[8]。番茄SWEET家族含有29个成员[9],SlSWEET7a在绿熟期果实果柄和维管束高表达,推测参与蔗糖的韧皮部装载和卸载[10]。苹果SWEET家族的13个成员与果实可溶性糖积累表现较高的相关性[11],MdSWEET1在番茄中过表达提高果实蔗糖和果糖含量[12]。荔枝SWEET家族含有16个成员,其中8个在果肉(假种皮)中高表达[13]。枣SWEET家族含有19个成员,ZjSWEET2.2定位于细胞膜,与果实己糖积累负相关[14]。
甜橙基因组SWEET家族含有16个成员,其中12个在果实表达,包含在果实高表达的Cs7g02970基因[15]。Cs7g02970基因(命名CitSWEET15)在甜橙果实囊衣和汁胞高表达,与果实可溶性糖积累高度正相关,可能介导蔗糖跨细胞膜转运至质外体[16]。然而CitSWEET15的亚细胞定位和糖转运活性尚不清楚,不能明确其生理功能。对此,本研究克隆了CitSWEET15基因的ORF序列,重点分析其蛋白的亚细胞定位和转运活性,探讨其在甜橙果实可溶性糖积累过程中的生理功能。
1 材料与方法
1.1 材料
供试材料为广西特色作物研究院种植的甜橙品种暗柳橙(Citrus sinensisOsbeck cv.‘Anliu’),选择5株处于盛果期且长势良好的成年结果树,采集成熟叶片和盛开的花,以及花后80 d(80DAF)、110 d(110DAF)、140 d(140DAF)、170 d(170DAF)、200 d(200DAF)、230 d(230DAF)果实。样品置于冰盒带回实验室,果实剥去果皮取果肉和成熟果实(230 d)种子。所有样品设置3次生物学重复,样品液氮速冻后-80 ℃保存。
1.2 方法
1.2.1 基因克隆 在甜橙基因组数据库(http: //citrus.hzau.edu.cn/orange/)查询Cs7g02970,即CitSWEET15,下载其cDNA和CDS序列。提取甜橙果肉总RNA(Aidlab, RN53),利用PrimeScriptTM 1stStrand cDNA Synthesis试剂盒(TaKaRa, 6110A)反转录合成cDNA第一链。以此为模板进行RT-PCR扩增,扩增引物序列为5′-ATGGCCATAATGTTCGAT-3′/5′-TCAAACAG CAACAGCACA-3′,利用高保真PCR酶扩增试剂(Vazyme Biotech,P515-1)进行扩增。PCR扩增产物经电泳和回收,连接至测序载体pMD19-T测序。
1.2.2 序列分析 在甜橙基因组数据库和NCBI网站使用在线Blastn进行检索,下载核苷酸序列。使用DNAMAN软件将核苷酸序列翻译成氨基酸序列,使用在线软件ExPASy(https://web.expasy.org/)预测相对分子量和理论等电点,使用在线软件TMHMM 2.0(https: //services.healthtech.dtu.dk/service.php?TMHMM-2.0)预测跨膜结构。使用Clustal W软件进行氨基酸序列比对,利用MEGA 7.0软件,使用邻接法构建系统进化树,进行1000次重复的Bootstrap值检验。
1.2.3 qRT-PCR检测 提取成熟叶片、花、种子和果肉的总RNA,反转录合成cDNA。使用2×SYBR Green Fast qPCR Mix试剂(Biomarker,RK02001),在荧光定量PCR仪(BIO-RAD, CFX96)检测基因的表达量。目标基因引物序列:5′-GGGAGTTGCATTTGGCATCT-3′/5′-GCACCGG AGCCAGGTACA-3′,内参基因Actin引物序列:5′-CCAAGCAGCATGAAGATCAA-3′/5′-ATCTG CTGGAAGGTGCTGAG-3′。设置3次技术重复,基因的相对表达量使用2-∆∆CT值计算。
1.2.4 亚细胞定位 以含有CitSWEET15基因CDS的质粒为模板,以去除终止密码子的引物(5′-ACAGCCCAAGCTTGCATGCCTGCAGATGGCCA TAATGTTCGAT-3′/5′-CCTCGCCCTTGCTCACCA TGGATCCAACAGCAACAGCACATCCA-3′),利用高保真2×Phanta®Max Master DNA聚合酶(Vazyme Biotech, P515)进行PCR扩增。经PstII和BamHI(NEB)将载体酶切线性化后,使用ClonExpress®II One Step克隆试剂盒(Vazyme Biotech, C112)将扩增产物插入至目标载体16318-hGFP。构建的融合表达载体和空载体分别转化拟南芥叶肉原生质体,具体操作步骤参考YOO等[17]的方法。
1.2.5 酵母表达载体构建和转化 以含有CitSWEET15基因CDS的质粒为模板,使用引物(5′-GTGGATCCCCCGGGCTGCAGGAATTCAT GGCCATAATGTTCGAT-3′/5′-AATTGGGTACCG GGCCCCCCCTCGAGTCAAACAGCAACAGCA CA-3′)进行PCR扩增。使用EcoR I和XhoI(NEB)将载体线性化,利用ClonExpress®II One Step克隆试剂盒(Vazyme Biotech, C112)将扩增产物插入至酵母表达载体pDR196的多克隆位点。经测序确认后将CitSWEET15-pDR196、载体pDR196(载体对照)和AtSWEET10-pDR196(阳性对照)分别转化至酿酒酵母菌株W303a(W303-1A)。酵母转化采用醋酸锂转化法,使用酵母转化试剂盒(Coolaber, SK2400),转化后的单克隆进行PCR扩增验证。
1.2.6 Esculin转运检测 酵母阳性单克隆使用SC/-ura(2%葡萄糖为碳源)液体培养基30 ℃震荡过夜,至OD600为0.6~1.0。酵母细胞吸收Esculin和荧光强度检测方法参考GORA等[18]的方法,略作修改。吸取酵母菌液,加入Esculin溶液(Solarbio, E8230)至终浓度1 mmol/L,30 ℃震荡培养60 min。离心收集酵母细胞,使用磷酸盐缓冲液清洗酵母细胞2次,再加入磷酸盐缓冲液充分重悬。使用多功能酶标仪(Molecular Devices,SpectraMax iD3)检测Esculin荧光强度,激发波长为367 nm,发射波长为454 nm。同时按照1∶2的比例稀释酵母细胞,使用酶标仪(Thermo Scientific, Multiskan GO)检测酵母重悬细胞的OD600值。计算每1个OD600值的酵母细胞的荧光强度值,每个基因或对照的数据均来自于4个独立的酵母单克隆。
2 结果与分析
2.1 基因克隆
经RT-PCR扩增和测序表明,CitSWEET15的ORF长度为918 bp,编码305个氨基酸。预测其等电点为6.29,相对分子量为34.15 kDa,含有7个跨膜结构域。CitSWEET15与拟南芥SWEET家族AtSWEET15的氨基酸序列一致率为55.5%,与其他16个成员的氨基酸序列一致率为28.5%~49.8%。对21个SWEETs的氨基酸序列进行系统进化分析(图1),结果发现,CitSWEET15与PuSWEET15[19]、VvSWEET15[7]、LcSWEET15[13]和AtSWEET15为直系同源,并与AtSWEET9~AtSWEET15同属于SWEET Ⅲ类。
2.2 序列分析
将甜橙CitSWEET15与已有基因组数据报道的柑橘类SWEET15基因比较序列差异,结果见表1。CitSWEET15与柑橘属的克里曼丁橘和莽山野橘SWEET15基因的核苷酸序列一致率为99.90%,氨基酸序列一致率为100%。与金柑属的金柑SWEET15基因的核苷酸和氨基酸序列一致率略低,分别为99.13%和98.03%。与柑橘属的柚、宜昌橙和枸橼SWEET15基因的核苷酸序列一致率为98.69%~99.02%,氨基酸序列一致率为97.38%~97.70%。
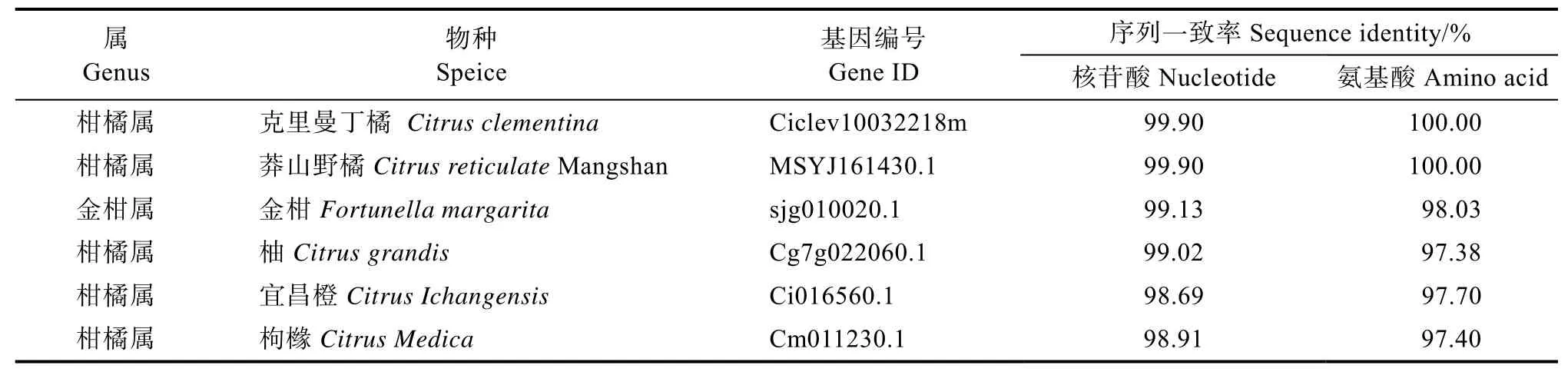
表1 CitSWEET15与其他柑橘类SWEET15基因的序列一致率Tab. 1 Sequence identities between CitSWEET15 and other Citrus SWEET15 genes
前人对SWEET III类成员AtSWEET13蛋白结构解析表明,若干氨基酸残基对蔗糖识别和转运具有决定性作用[20]。将CitSWEET15及上述柑橘类SWEET15的氨基酸序列共同比对,结果见图2。4个特异性识别蔗糖的位点(V/25、S/56、V/146和S/177)与AtSWEET13、AtSWEET15完全一致,3个与蔗糖转运活性相关的位点(W/60、N/77和W/181)也与AtSWEET13、AtSWEET15完全一致,因此推测CitSWEET15和柑橘类SWEET15成员可能均具有蔗糖转运活性。
2.3 基因表达分析
利用qRT-PCR检测CitSWEET15基因在甜橙叶片、花、种子和果实不同发育时期果肉中的表达模式,结果如图3所示。CitSWEET15基因在种子中表达量较叶片和花中高,在果肉中的表达量随果实发育和成熟逐渐增加。花后80、110、140 d的果实中表达量较低,此后快速增加,在花后230 d的果实中的表达量达到最高。

图3 CitSWEET15在甜橙不同组织和果实不同发育时期的表达模式Fig. 3 Expression patterns of CitSWEET15 among various tissues and fruit developmental stages of sweet orange
2.4 亚细胞定位检测
为了解CitSWEET15的亚细胞定位,在其C端融合绿色荧光蛋白,瞬时转化拟南芥叶肉原生质体。如图4所示,空载体p35S-GFP的绿色荧光分布于细胞膜、细胞质和细胞核。目标基因载体CitSWEET15-GFP的绿色荧光围绕原生质体外缘分布,与细胞膜被FM4-64染料标识后产生的红色荧光重合。二者完全融合后产生黄色荧光,说明CitSWEET15定位于细胞膜。

图4 CitSWEET15蛋白的亚细胞定位Fig. 4 Subcellular localization of CitSWEET15 protein
2.5 转运功能验证
使用具有荧光的蔗糖类似物Esculin为转运底物,检测表达CitSWEET15的酵母细胞转运Esculin情况,比较荧光强度明确其转运活性。酵母细胞经Esculin孵育后,阳性对照AtSWEET10的荧光强度显著高于空载体pDR196,强度约为空载体pDR196的1.3倍;CitSWEET15的荧光强度也显著高于空载体pDR196,强度约为空载体pDR196的2.2倍(图5)。以上说明CitSWEET15和阳性对照AtSWEET10均具有蔗糖转运活性。

图5 表达CitSWEET15的酵母细胞转运蔗糖类似物Esculin检测Fig. 5 Transportation test of sucrose analog Esculin by yeast cells expressing CitSWEET15
3 讨论
近年来关于VvSWEET10[8]、ZjSWEET2.2[14]、PbSWEET15[19]、SlSWEET7a[10]和SlSWEET15[21]的研究表明,SWEET家族对果实可溶性糖积累具有重要作用。此前已分离甜橙SWEET家族,根据其表达模式筛选出若干参与果实可溶性糖积累的候选基因[15]。本研究选取在甜橙成熟果实高表达的CitSWEET15深入研究,其在柑橘类不同物种中的核苷酸和氨基酸序列一致性较高,且识别蔗糖的关键氨基酸位点与AtSWEET13等完全一致[20]。因此推测包括CitSWEET15在内的SWEET15类基因在柑橘类物种中序列高度保守,可能都具有蔗糖转运活性。
离体表达体系是检测植物SWEET15类成员蔗糖转运活性的有效方法,如通过HEK293T细胞表达结合FRET检测AtSWEET15[22]和OsSWEET15的蔗糖转运活性[23];通过爪蟾卵母细胞表达结合放射性底物检测AtSWEET15[24]和GmSWEET15b[25]的蔗糖转运活性;通过酵母蔗糖利用缺陷菌株表达结合生长互补检测PbSWEET15[19]和SlSWEET15[21]的蔗糖转运活性,通过酵母蔗糖利用缺陷菌株表达结合放射性底物检测MtSWEET15.3[26]的蔗糖转运活性。本研究利用的Esculin(6,7-二羟基香豆素-b-D-葡糖苷)与蔗糖结构类似,具有较强的自发荧光。此前已建立酵母表达结合Esculin荧光检测验证SUT类AtSUC2和马铃薯StSUT1转运活性的简单方法[18]。Esculin还用于示踪叶肉原生质体[27]、韧皮部[28]、花粉管[29]和花柄[30]的蔗糖转运。SWEETⅢ类的AtSWEET10也具有Esculin转运活性,基于此种特性建立检测该类成员蔗糖转运活性的简单方法[27]。此外,蔗糖正常利用的酵母菌株也能用于Esculin的吸收检测,其结果与使用蔗糖利用缺陷型菌株的结果基本一致[18]。因此,本研究使用常见的酵母蔗糖正常利用的W303a菌株为异源表达体系,通过检测胞内Esculin荧光强度来判断目标基因的蔗糖转运活性。CitSWEET15转运Esculin,荧光强度约为对照的2.2倍,说明其具有蔗糖转运活性。
目前报道的园艺作物SWEET15类基因普遍在果实和花等库器官表达,参与库器官可溶性糖积累。苹果SWEET15基因MdSWEET3.9~11随果实成熟显著上调,与果糖和蔗糖相关性较高[11]。进一步研究发现苹果MdSWEET15a位于染色体上的区域中包含与果实可溶性糖相关的数量性状位点,其序列多态性对果实可溶性糖含量具有较大贡献[31]。VvSWEET15在葡萄果实成熟期间高表达[7];SWEET15基因SlNEC1主要在番茄的花、子叶和果实高表达[9];LcSWEET15在荔枝的花、果肉(假种皮)和种子表达[13],均表明SWEET15类基因在库器官参与可溶性糖积累。此外,PbSWEET15[19]和EjSWEET15[32]分别随梨和枇杷的果实蔗糖积累显著上调,在梨果实高蔗糖积累的芽变品种中的表达量显著高于亲本,进一步说明SWEET15对果实可溶性糖积累的作用。蔗糖是柑橘植株光合产物运输的主要形式[33],果实蔗糖的卸载采用共质体和质外体途径,且以共质体途径为主[34]。CitSWEET15在甜橙果实成熟期间显著上调表达,在高蔗糖积累的芽变品种中表达量显著高于母本[16]。本研究发现CitSWEET15蛋白具有蔗糖转运活性且定位于细胞膜,这也证明CitSWEET15介导的跨细胞膜蔗糖转运(质外体途径)对甜橙果实成熟期间的蔗糖积累具有较大贡献。同时,原位杂交表明CitSWEET15在甜橙果实囊衣和汁胞的表皮细胞高表达,推测其功能是将囊衣维管束和汁胞表皮细胞的蔗糖卸载到质外体[16]。上述报道在组织水平上分析了CitSWEET15的表达,但其在细胞水平的表达仍需深入研究。
本研究对甜橙CitSWEET15开展序列比对、基因表达、亚细胞定位和转运活性检测等分析,结果发现CitSWEET15在柑橘类物种中序列高度保守,定位于细胞膜,具有蔗糖转运活性,参与果实成熟期间的质外体蔗糖跨细胞膜转运。下一步需从细胞水平精细检测CitSWEET15在甜橙果实中的表达模式,深入了解其参与蔗糖通过质外体途径卸载进入果肉细胞的生理功能,明确其参与果实可溶性糖积累的分子机制。

