琼胶寡糖缓解呕吐毒素诱导小鼠肝脏损伤的作用效果与机制
全浩玮 王庆凤 王毓甜 李泽昆 米金秋 李天天 马秋刚 黄世猛*
(1.中国农业大学动物科学技术学院,动物营养学国家重点实验室,北京 100193;2.国家粮食和物资储备局科学研究院,北京 100037)
霉菌毒素污染是畜禽养殖面临的主要风险之一,不仅会造成饲料资源浪费,而且当饲粮中霉菌毒素含量超标时,容易造成畜禽肝脏、肾脏以及免疫器官的损伤,从而影响畜禽生产性能和产品品质[1-3]。脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON),又称呕吐毒素,是污染农作物和畜禽饲料最严重的真菌毒素之一,主要由黄色镰刀菌和禾谷镰刀菌代谢产生[4]。2021年我国饲粮和饲料原料中霉菌毒素污染状况调查显示,调查的1 025份样品中DON检出率均达到88%以上,除杂粕未见超标外,其他样品均有超标[5]。畜禽采食DON污染的饲粮后,会出现采食量下降、营养不良、增重降低、呕吐腹泻等症状,从而导致生产性能下降和代谢紊乱,给畜牧业带来巨大的经济损失。同时,动物产品中残留的DON可能通过食物链对人类健康构成威胁[6-7]。
畜禽采食DON污染的饲粮后,不仅会造成肠道损伤,还会引起肝脏等脏器毒性。肝脏是机体重要的解毒器官,也是DON在畜禽机体内最重要的靶器官,因此,DON造成的肝脏损伤机制是当前研究热点之一[8]。研究表明,低浓度和高浓度的DON均可引起肝脏不同程度的组织损伤和细胞损伤,例如肝脏纤维化和细胞毒性,其潜在机制可能与DON抑制DNA、RNA和蛋白质合成,促进核糖体应激、氧化应激和内质网应激,破坏线粒体和细胞膜,最后通过不同途径诱导细胞死亡有关[9-11]。DON在肝脏组织中降解成DON-葡糖苷酸,并且通过改变不同细胞系中肿瘤抑制蛋白53(p53)、半胱天冬蛋白酶-3(Caspase-3)、半胱天冬蛋白酶-7(Caspase-7)、半胱天冬蛋白酶-8(Caspase-8)、B细胞淋巴瘤-2相关X蛋白(Bax)的表达,诱导肝脏损伤[12-13]。同时,DON可诱导糖原减少,增加铁血黄素颗粒,使光滑内质网和干细胞内核糖体丢失,高浓度的DON可导致肝小叶-门静脉局部坏死和肝脏损伤[14-16]。当前,DON污染和防治问题引起了人们的强烈关注。因此,寻找有效缓解DON诱导肝脏损伤的技术方案对畜禽生产至关重要。
琼胶寡糖(agaro-oligosaccharide,AO)作为来源于红藻的一种低分子质量糖,聚合度为2~20,是经由海藻多糖降解后保留的功能活性成分,易于被机体吸收,生物利用度高,是一种具有益生活性以及抗氧化、抗炎和保肝作用的新型海洋功能性低聚合度寡糖分子[17-21]。研究发现,琼胶寡糖可提高脂多糖(LPS)刺激后RAW264.7的细胞活力,剂量依赖性地抑制LPS诱导细胞上清中一氧化氮(NO)、肿瘤坏死因子-α(TNF-α)和活性氧(ROS)的生产,减轻炎症反应,从而预防细胞炎症的发生[17]。琼胶寡糖能否缓解DON诱导的肝脏损伤目前尚未报道。因此,本试验以DON诱导的小鼠肝脏损伤为研究对象,探究琼胶寡糖缓解DON诱导小鼠肝脏损伤的作用效果与机制,为琼胶寡糖作为饲料添加剂的开发应用提供理论参考。
1 材料与方法
1.1 试验设计
选用7周龄、初始体重为(20.04±0.80) g的无特定病原体(specific pathogen free,SPF)级C57BL/6J雌性小鼠32只,适应期为1周,小鼠饲养在中国农业大学SPF标准环境中,所有动物试验均按照中国农业大学试验动物福利与动物试验伦理委员会批准的规程进行。32只小鼠根据体重随机分为4组,每组8个重复,每个重复1只。试验共28 d,分为毒素处理前和毒素处理2个阶段。毒素处理前阶段,对照组(CON组)和呕吐毒素组(DON组)小鼠每天灌胃200 μL(200 mg/kg BW)无菌生理盐水,琼胶寡糖组(AO组)和琼胶寡糖+呕吐毒素组(AO+DON组)小鼠每天灌胃200 μL琼胶寡糖,连续处理21 d。毒素处理阶段,DON组和AO+DON组小鼠每天灌胃100 μL(4.8 mg/kg BW)DON,CON组和AO组小鼠每天灌胃100 μL无菌生理盐水,连续处理7 d。
饲养环境温度为18~22 ℃,相对湿度为35%~44%,昼夜光照交替时间为12 h/12 h,自由采食和饮水,每周记录小鼠的采食量和体重。基础饲粮组成及营养水平见表1。

表1 基础饲粮组成及营养水平(干物质基础)
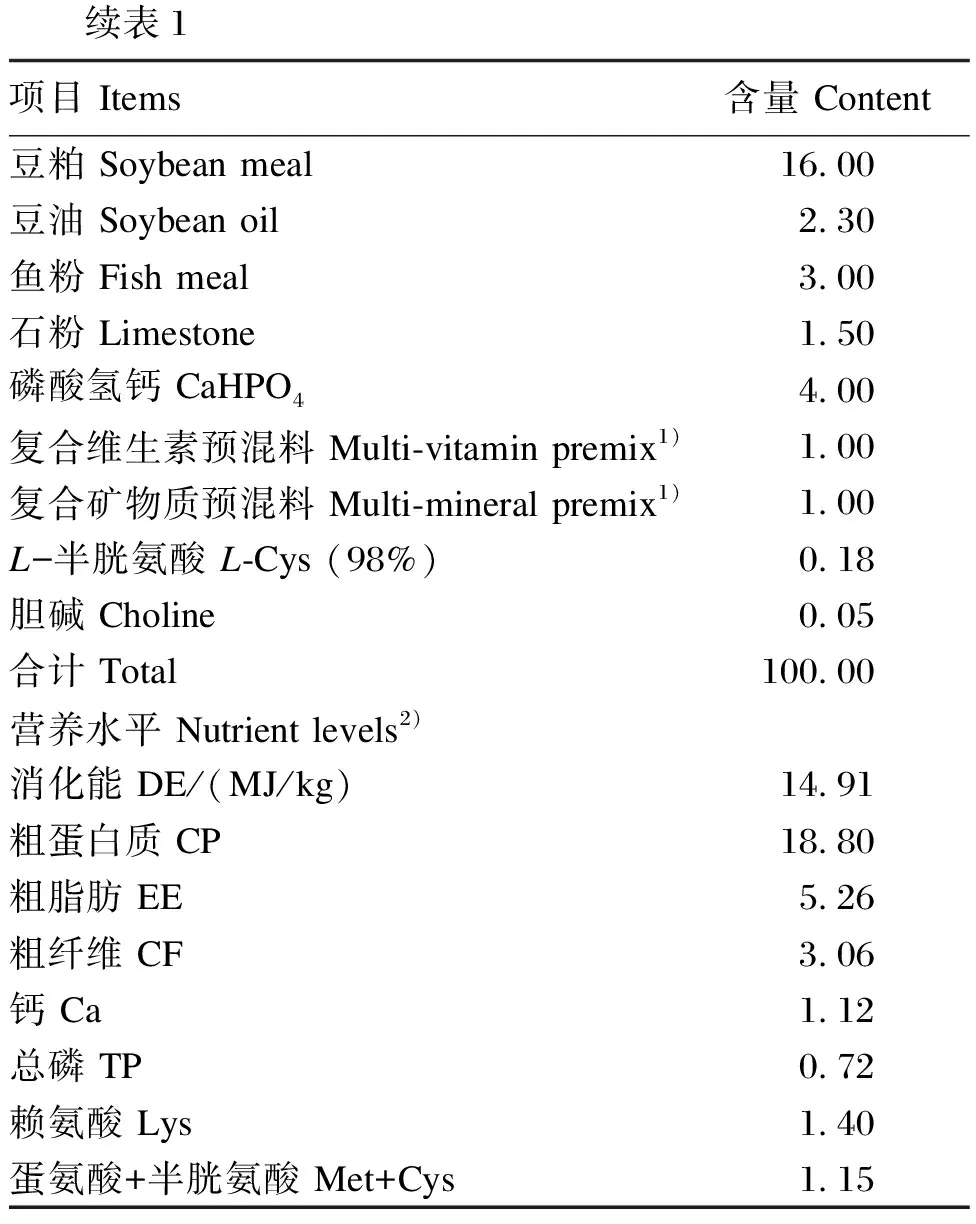
续表1项目 Items含量 Content豆粕 Soybean meal16.00豆油 Soybean oil2.30鱼粉 Fish meal3.00石粉 Limestone1.50磷酸氢钙 CaHPO44.00复合维生素预混料 Multi-vitamin premix1)1.00复合矿物质预混料 Multi-mineral premix1)1.00L-半胱氨酸 L-Cys (98%)0.18胆碱 Choline0.05合计 Total100.00营养水平 Nutrient levels2)消化能 DE/(MJ/kg)14.91粗蛋白质 CP18.80粗脂肪 EE5.26粗纤维 CF3.06钙 Ca1.12总磷 TP0.72赖氨酸 Lys1.40蛋氨酸+半胱氨酸 Met+Cys1.15
1.2 样品采集
在试验结束时,采用眼球采血,收集小鼠血液样品。小鼠断颈、脱臼处死,剖开腹部,收集肝脏组织,称重并记录数据;无机械损伤收集肝脏组织,一部分用灭菌生理盐水冲洗干净后,置于4%多聚甲醛固定液保存,用于制备切片分析肝脏组织病理学;另一部分液氮速冻后置于-80 ℃冰箱保存。
1.3 指标测定
1.3.1 体重
以组为单位每周对小鼠称重,记录数据,计算8、9、10、11、12周龄的体重。
1.3.2 肝脏指数
每只小鼠称重后,完整取下肝脏组织,用灭菌生理盐水冲洗干净,然后用滤纸将血水擦拭干净后称重,计算肝脏指数:
肝脏指数(%)=[肝脏重量(g)/体重(g)]×100。
1.3.3 血清细胞因子含量
将采集的血液置于无抗凝剂的离心管,在4 ℃、3 000 r/min离心15 min后收集血清,采用酶联免疫吸附测定(ELISA)法测定血清白细胞介素-1β(IL-1β)和TNF-α含量,试剂盒均购于南京建成生物工程研究所,试验步骤参照试剂盒说明书。
1.3.4 肝脏细胞因子含量和抗氧化指标
取肝脏组织样品,置于冰上解冻,经匀浆、离心后,取上清液,测定肝脏IL-1β、白细胞介素-6(IL-6)和TNF-α含量;同时测定肝脏丙二醛(MDA)含量、总抗氧化能力(T-AOC)及过氧化氢酶(CAT)、总超氧化物歧化酶(T-SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性,试剂盒均购于南京建成生物工程研究所,试验步骤参照试剂盒说明书。
1.3.5 肝脏组织形态
每组随机选取3个重复,小心剪取各组小鼠约1 cm3的肝脏组织,用无菌磷酸盐缓冲液(PBS)清洗后,用4%多聚甲醛固定液保存。经脱水、包埋、切片制作5 μm的肝脏组织切片,苏木精-伊红(HE)染色后,在光学显微镜下观察肝脏组织病理学结构。
肝脏组织免疫荧光(IF)试验操作均在武汉赛维尔生物科技有限公司进行,具体的试验步骤如下:将石蜡切片进行脱蜡、脱水、抗原修复处理。按照试剂盒的操作说明滴加3%过氧化氢室温孵育抑制内源性过氧化物酶的活性;用PBS洗涤后加试剂A(封闭液)室温封闭30 min,甩掉试剂A,滴加一抗F4/80(1∶500)4 ℃过夜,用PBS代替一抗作阴性对照。PBS洗涤后滴加二抗37 ℃孵育30 min,玻片置于PBS(pH 7.4)中在脱色摇床上晃动洗涤3次,每次5 min。加4′,6-二脒基-2-苯基吲哚(DAPI)染液,避光室温孵育10 min。玻片置于PBS(pH 7.4)中在脱色摇床上洗涤3次,每次5 min。加自发荧光淬灭剂B液5 min,流水冲洗10 min。抗荧光淬灭封片剂封片,然后镜检照相,采集图像。
1.3.6 肝脏生化指标
使用全自动血液生化分析系统(AU5400,Beckman Coulter,美国)测定肝脏谷丙转氨酶(ALT)、谷草转氨酶(AST)活性及总胆固醇(TC)、甘油三酯(TG)含量,采用南京建成生物工程研究所生产的试剂盒进行测定。
1.3.7 肝脏炎症损伤相关基因表达
采用RNA提取试剂盒抽提小鼠肝脏组织总RNA,根据说明书要求进行操作,采用逆转录试剂盒将提取的总RNA逆转录成cDNA,得到的cDNA用于实时荧光定量PCR检测肝脏炎症损伤相关基因表达,引物序列见表2。反应体系为:0.25 μL上游引物,0.25 μL下游引物,6.5 μL无核酸水,3 μL cDNA和10 μL SYBR Green Master Mix,混合成20 μL的反应体系。使用荧光定量PCR仪通过其特异性引物扩增目的基因[TNF-α、IL-1β、IL-6、白细胞介素-8(IL-8)、核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)、核因子E2相关因子2(Nrf2)、半胱天冬蛋白酶-1(Caspase-1)、Caspase-3和微管相关蛋白1轻链3β(LC3B)]mRNA。反应程序为:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,72 ℃ 30 s,95 ℃ 15 s,60 ℃ 60 s,35个循环。以甘油醛-3-磷酸脱氢酶(GAPDH)为内参基因,采用2-△△Ct法计算目的基因相对表达水平。

表2 引物序列
1.4 数据处理与分析
所有试验数据采用SPSS 23.0软件进行单因素方差分析(one-way ANOVA),并采用Duncan氏多重比较检验分析组间差异显著性。结果用平均值±标准误表示,P<0.05为差异显著。使用GraphPad Prism 9.0软件制作数据图。
2 结果与分析
2.1 琼胶寡糖对DON诱导小鼠体重和肝脏指数的影响
如表3所示,4组小鼠8、9、10、11、12周龄的体重均无显著差异(P>0.05)。DON组和AO+DON组小鼠肝脏指数显著高于CON组和AO组(P<0.05);与DON组相比,AO+DON组小鼠肝脏指数有所降低,但差异不显著(P>0.05)。
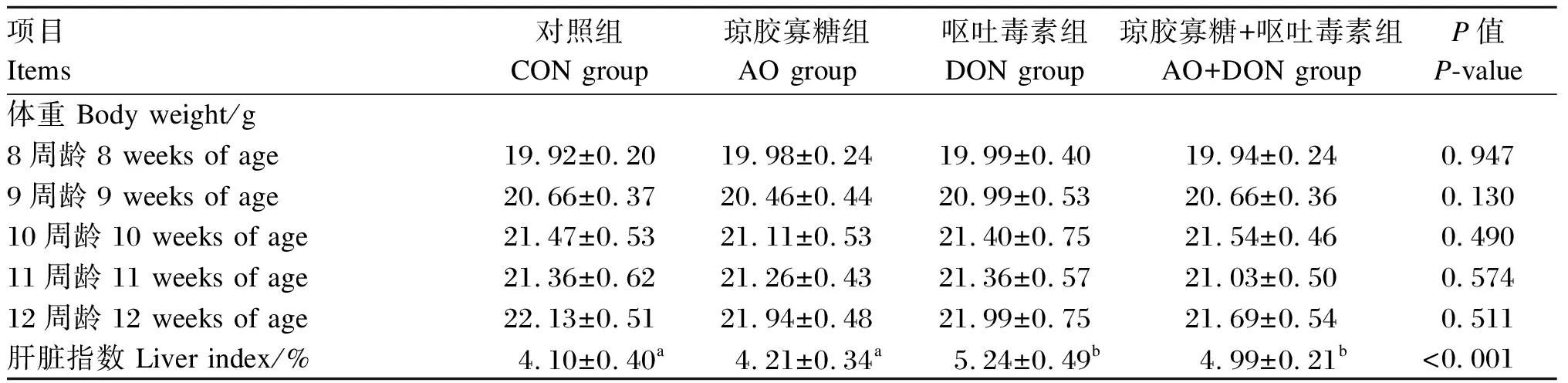
表3 琼胶寡糖对DON诱导小鼠体重和肝脏指数的影响
2.2 琼胶寡糖对DON诱导小鼠血清和肝脏细胞因子含量及肝脏抗氧化指标的影响
如图1所示,在血清中(图1-A和图1-B),与CON组相比,DON组IL-1β和TNF-α含量显著增加(P<0.05);与DON组相比,AO+DON组IL-1β和TNF-α含量显著减少(P<0.05)。在肝脏中(图1-C~图1-J),与CON组相比,DON组IL-1β、IL-6、TNF-α和MDA含量显著增加(P<0.05),T-AOC及CAT、T-SOD和GSH-Px活性显著减少(P<0.05);与DON组相比,AO+DON组IL-1β、IL-6、TNF-α和MDA含量显著减少(P<0.05),T-AOC及CAT、T-SOD和GSH-Px活性显著增加(P<0.005)。
以上结果表明,DON诱导会增加小鼠血清和肝脏中促炎细胞因子的含量,而添加AO通过降低小鼠血清和肝脏组织中促炎细胞因子含量,增加抗炎细胞因子含量缓解DON诱导的小鼠炎症损伤。
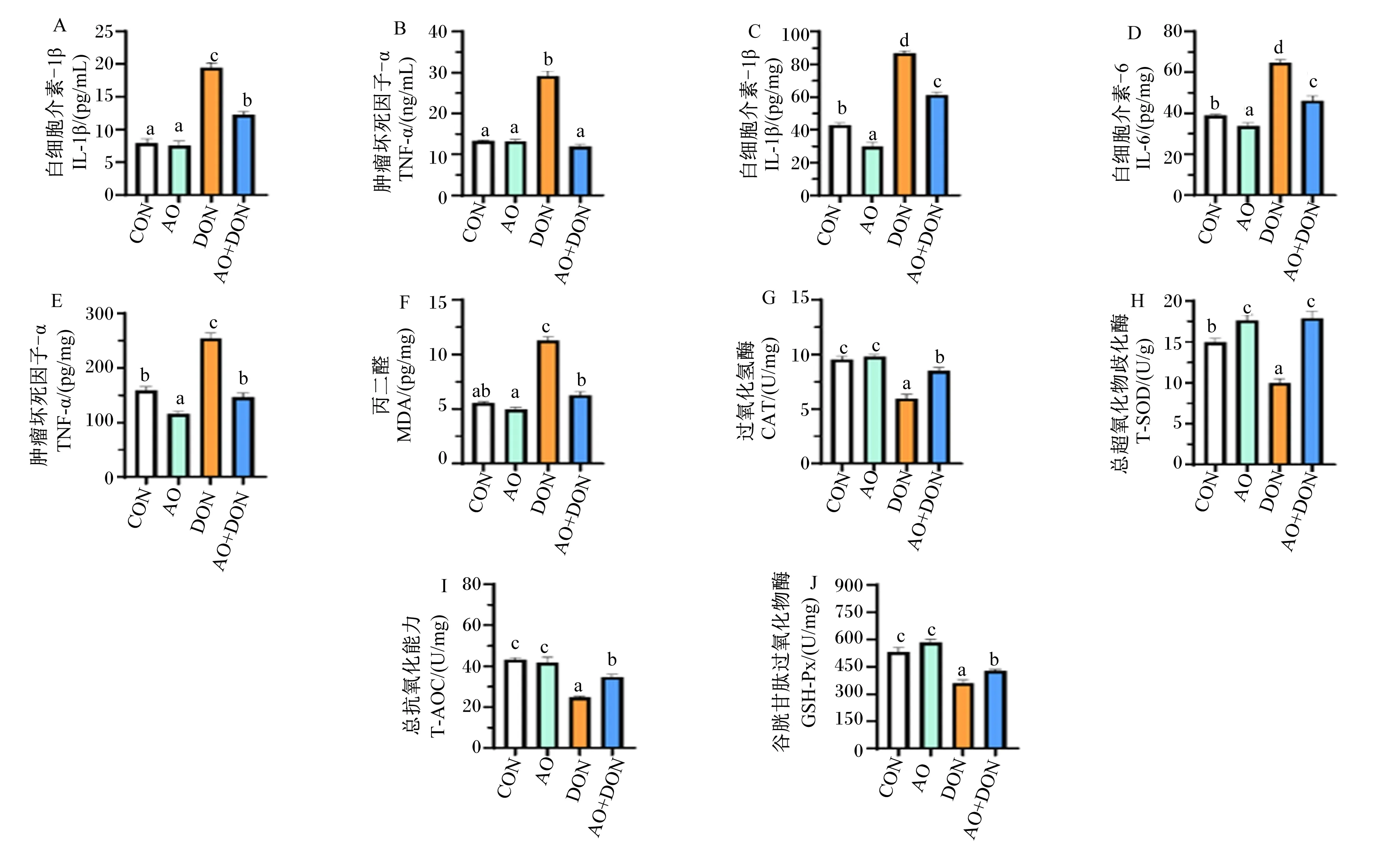
CON:对照组;AO:琼胶寡糖组;DON:呕吐毒素组;AO+DON:琼胶寡糖+呕吐毒素组。数据柱标相同或无小写字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。下图同。
2.3 琼胶寡糖对DON诱导小鼠肝脏组织形态的影响
如图2所示(如箭头所示),CON组和AO组小鼠肝脏组织病理学切片中肝细胞形态正常,排列规则,细胞核位于肝细胞中央,大静脉附近无明显炎性浸润。DON组肝脏细胞出现明显的细胞瘤样病变,大静脉附近出现明显的炎性浸润,肝细胞排列呈现不规则结节状,有特征性放射纤维状。与DON组相比,AO+DON组肝脏组织呈现明显改善。F4/80免疫荧光染色结果表明,与CON组相比,DON组肝脏巨噬细胞浸润显著增加(P<0.05);与DON组相比,AO+DON组肝脏巨噬细胞浸润显著降低(P<0.05)。
以上结果表明,琼胶寡糖可缓解DON诱导的小鼠肝脏损伤。

DAPI:4’,6-二脒基-2-苯基吲哚 4’,6-diamidino-2-phenylindole;H&E:苏木精-伊红 hematoxylin eosin。
2.4 琼胶寡糖对DON诱导小鼠肝脏生化指标的影响
如图3所示,与CON组相比,AO组肝脏AST、ALT活性和TG、TC含量显著降低(P<0.05),而DON组肝脏AST、ALT活性和TG、TC含量显著增加(P<0.05);与DON组相比,AO+DON组肝脏AST、ALT活性和TC含量显著降低(P<0.05)。
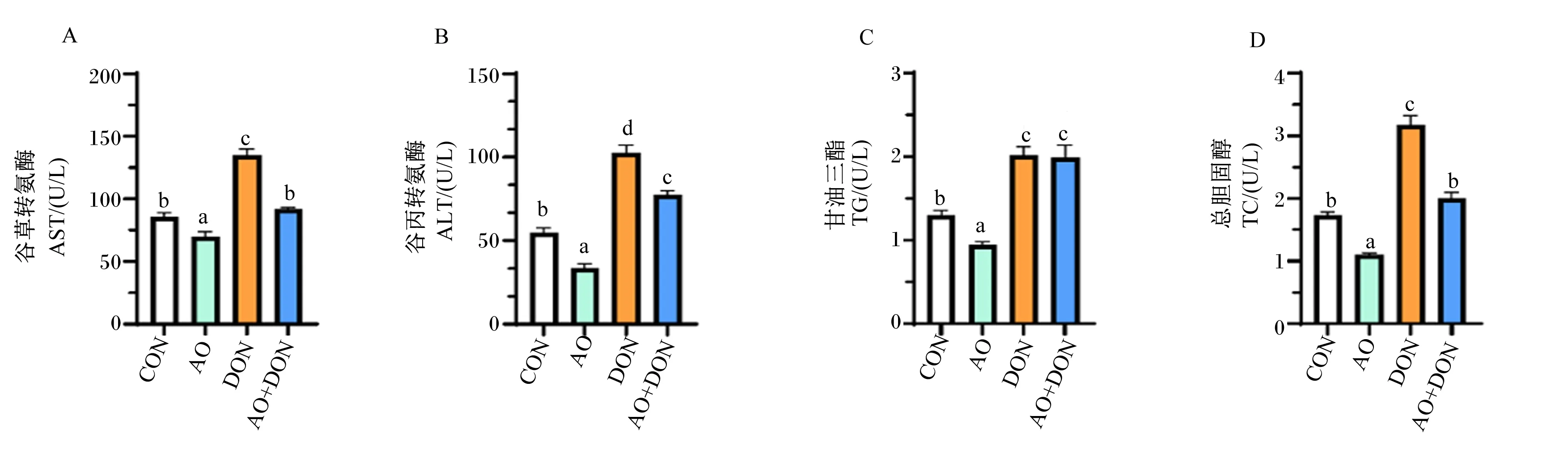
图3 琼胶寡糖对DON诱导小鼠肝脏生化指标的影响
以上结果表明,DON可导致小鼠肝脏组织功能紊乱,AO可通过调节AST、ALT活性和TG、TC含量改善肝脏组织功能,缓解DON诱导的小鼠肝脏功能损伤。
2.5 琼胶寡糖对DON诱导小鼠肝脏炎症损伤相关基因表达的影响
如图4所示,与CON组相比,DON组的肝脏IL-1β、TNF-α、IL-6、NLRP3、Caspase-3、LC3B的mRNA相对表达水平显著升高(P<0.05),Bcl-2的mRNA相对表达水平显著降低(P<0.05);与DON组相比,AO+DON组的肝脏IL-1β、TNF-α、IL-6、NLRP3、Caspase-3、LC3B的mRNA相对表达水平显著降低(P<0.05)。
以上结果表明,AO对DON诱导的小鼠肝脏炎症和氧化损伤具有改善作用。
3 讨 论
DON作为全球范围内普遍存在的一种霉菌毒素,全世界每年70%的农作物产品受到霉菌毒素的污染,不仅造成了巨大的经济损失,也危害动物和人类的健康,例如摄入DON污染的食物会导致急性毒性、胃肠道毒性、肝脏毒性、神经毒性等[5-6]。近些年研究表明,肝脏是DON的主要靶器官,是体内DON解毒和代谢的主要器官,DON在体内和体外均可引发急性或慢性肝脏损伤(肝脏毒性)[22]。大量研究表明,较高浓度的DON可导致机体肝脏损伤,例如肝脏重量减少、门静脉和门静脉周纤维化、肿瘤病变和干细胞细胞质的改变[23],低浓度的DON会导致肝脏组织中度病变。肝脏作为机体重要的代谢器官,广泛参与许多生物过程,包括新陈代谢、免疫反应、蛋白质合成、解毒和抗菌防御等[24]。因此,本研究致力于明晰DON对小鼠肝脏功能的影响,寻找和筛选能有效缓解DON诱导肝脏损伤的益生元。琼胶寡糖作为海洋红藻植物细胞壁中的多糖成分,其分子质量小、水溶性好且易被人体吸收,生物活性和应用价值得到显著提高,琼胶寡糖的生物学功能受到人们越来越多的关注,但琼胶寡糖与缓解肝脏损伤相关联的报道却很少,本研究探讨了琼胶寡糖缓解DON诱导小鼠肝脏损伤的效果和作用机制。
脏器指数是重要的生物学特性指标,是指受试动物实质器官重量与体重的比值,在一定程度上反映动物机体内各器官发育程度。在一般情况下,脏器重量与机体重量呈正相关,但是脏器重量受到多种因素的影响,如自身因素的影响和环境因素的影响[25],动物机体受到损伤后,其体内脏器重量会发生变化,脏器指数变大,可能表明该脏器发生充血、水肿、增生、肥大等病变;脏器指数变小,可能表明该脏器已经萎缩或发生其他损伤现象。小鼠肝脏指数是反映其肝脏功能是否正常的指标之一[26]。在本研究中,DON导致小鼠的肝脏指数显著增加,表明肝脏在DON作用下发生充血、增生和肥大等病变,相比DON组,AO+DON组的小鼠肝脏指数无显著差异,但有降低的趋势。同时,与DON组相比,添加琼胶寡糖可明显改善DON引起的肝脏组织病理性损伤。F4/80免疫荧光染色结果表明,添加琼胶寡糖可显著改善肝脏组织巨噬细胞浸润,提示了琼胶寡糖可缓解DON诱导的肝脏损伤。Hong等[27]研究了新琼寡糖对小鼠高脂饲粮所致肥胖和血糖的影响,结果表明饲喂新琼寡糖可显著降低体重,缓解肝脏组织脂肪堆积和囊泡性脂肪变性;同时,新琼寡糖可显著降低血清TC、TG、游离脂肪酸含量,可以通过诱导脂联素的产生来有效抑制肥胖和与肥胖有关的代谢综合征[28]。由此可见,新琼寡糖可调节肝脏组织功能,发挥抗肥胖和抗糖尿病作用。
抗氧化酶如超氧化物歧化酶(SOD)和GSH-Px被认为是防止氧化损伤的主要防御系统,前人研究表明,琼胶寡糖能提高SOD和GSH-Px活性,降低MDA含量和AST、ALT活性;琼胶寡糖添加剂量在400 mg/kg时,肝脏中MDA含量降低了44%,肝脏和血清中SOD和GSH-Px活性升高,血清中ALT活性下降了22.16%[29]。由此可见,琼脂寡糖不仅通过自身的自由基清除活性发挥抗氧化作用,而且通过增强宿主抗氧化酶系统来清除ROS,从而缓解氧化损伤,保护肝脏。机体内的抗氧化酶主要包括CAT、SOD、T-AOC和GSH-Px,可从不同角度协助机体清除体内的ROS,在抗氧化过程中发挥着重要作用,其含量与机体抗氧化能力呈正相关,通常以上述抗氧化酶活性来评价机体抗氧化能力。与前人研究结果较为一致,本试验结果提示了DON可导致小鼠肝脏组织中抗氧化酶活性降低和氧化损伤标志物MDA含量增加,而添加琼胶寡糖可增加抗氧化酶(CAT、T-SOD、T-AOC和GSH-Px)活性。林福娣[30]研究发现,新琼寡糖可缓解过氧化氢(H2O2)诱导的氧化应激,增加HepG2肝脏细胞系GSH-Px、SOD和CAT等抗氧化酶活性,抑制细胞ROS的产生,从而提升细胞活性。本试验中,DON显著增加了小鼠血清AST、ALT活性和TG、TC含量,而添加琼胶寡糖后,可显著降低血清AST、ALT活性和TC含量。ALT与AST主要分布在肝细胞内,如果肝脏受损,肝细胞中的转氨酶便进入血液,血清AST、ALT活性便会升高,ALT和AST活性升高程度与肝细胞受损程度相一致。因此,DON可导致小鼠肝细胞损伤,而添加琼胶寡糖可以在一定程度上缓解DON对小鼠肝脏的氧化损伤。
同时,在本研究中,DON显著增加了小鼠血清中促炎细胞因子IL-1β、TNF-α含量,也显著增加了肝脏中促炎细胞因子IL-1β、IL-6和TNF-α含量,添加琼胶寡糖后可显著降低血清和肝脏中促炎细胞因子(IL-1β、IL-6和TNF-α)含量,缓解DON诱导的小鼠炎症反应。通过对肝脏mRNA相对表达水平的检测,DON可显著增加肝脏IL-1β、TNF-α和NLRP3的mRNA相对表达水平量,而添加琼胶寡糖后可显著降低肝脏IL-1β、TNF-α和NLRP3的mRNA相对表达水平。通过分析前人研究,例如郑雅君等[17]研究发现,琼胶寡糖对LPS诱导细胞炎症反应过程中NO的产生具有明显的抑制作用,且呈剂量依赖,对NO的作用主要源于自身抗炎活性作用,可以显著抑制LPS刺激巨噬细胞中IL-1β、IL-6、TNF-α的产生和释放。琼胶寡糖抑制细胞炎症主要通过丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)信号通路。Lu等[31]发现琼胶寡糖预处理后,添加LPS诱导细胞的MAPK家族激酶c-Jun氨基末端激酶(c-Jun amino-terminal kinase,JNK)、细胞外信号调节蛋白激酶 (extracellular signals regulate protein kinases,ERK)、p38的磷酸化水平显著降低,琼胶寡糖通过阻断该信号通路的传导,进而降低细胞的炎症介质和细胞因子分泌,减轻细胞炎症损伤。与大多数研究一致,多糖或寡糖对LPS诱导巨噬细胞的抗炎作用与MAPK信号通路传导的阻断密切相关。Lu等[31]研究发现,茯苓多糖通过MAPK信号通路抑制LPS诱导RAW264.7细胞炎症,阻断其中促炎介质ERK和JNK信号通路,抑制促炎因子的基因表达和分泌。Ma等[32]研究发现,壳聚糖抑制了LPS诱导巨噬细胞中p38、ERK和JNK磷酸化,降低巨噬细胞中促炎细胞因子IL-6和TNF-α的产生。在本研究中,通过分析肝脏中NLRP3、Caspase-3和LC3B的mRNA相对表达水平发现,与DON组相比,添加琼胶寡糖可显著降低上述基因的mRNA相对表达水平,这在一定程度上解释了琼胶寡糖可缓解DON诱导的小鼠肝脏损伤。针对琼胶寡糖通过何种途径抑制DON诱导肝脏炎症反应,缓解肝脏损伤,还需后续试验的深入探索。
4 结 论
琼胶寡糖可改善小鼠机体代谢功能,提高小鼠肝脏功能,缓解DON诱导的小鼠肝脏组织的病理损伤、代谢功能损伤、炎症和氧化损伤,增强机体抗病能力。

