鲁米诺化学发光的过氧化氢酶活性测定系统
孙岑岑, 方 瑜, 董伟仁, 顾一峰
(浙江大学a.医学院;b.动物科学学院,杭州 310058)
0 引 言
过氧化氢酶(catalase)是一类广泛地存在于动植物和微生物中的末端氧化酶,可将过氧化氢(H2O2)分解为氧气和水,从而保护机体免受H2O2的伤害,是生物体防御保护系统中的关键酶之一[1-2],并在食品、医药、化工等众多领域具有很高的应用价值[3-5]。因此,对catalase活性的准确测定是深入探究其生物学功能和扩展其实际应用的重要基础。传统的catalase 活性测定通常采用高锰酸钾(KMnO4)滴定法进行[6-8],但该方法存在很多问题:滴定终点的判断存在主观差异性,易引入实验误差;滴定反应先慢后快,耗时较长,且易造成实验失误;KMnO4溶液配制程序繁琐,耗时较长;实验过程(强酸环境)存在安全隐患。
由此,本文利用鲁米诺(Luminol)化学发光原理,改进并建立基于Luminol 化学发光的catalase 活性检测平台,拟对新系统的测量稳定性和灵敏度等进行评估,以期实现catalase 酶活性的方便、快捷、安全的精准测定。
1 实验原理
在碱性条件下,利用Luminol 化学发光性被氧化剂(如H2O2)氧化生成Luminol 的激发态产物3-氨基邻苯二酸(3-aminophthalate,3-AP),当其返回到基态的过程中发出光子(λmax=425 nm)[9-10],如图1 所示。与KMnO4滴定法类似,Luminol 法测定酶活性的设计思路也是通过Luminol 被剩余H2O2氧化产生化学发光的光强度确定H2O2剩余量,从而反推得到H2O2分解量,进而计算出酶促反应速度[11-12]。
本新型Luminol过氧化氢酶活检测系统需满足以下几个条件:①Luminol被H2O2氧化产生的化学光强度与H2O2的摩尔浓度c(H2O2)有良好的线性关系;②化学光强度高,足以被常规仪器捕捉并记录;③化学光达到峰值后可维持一定时间,为实验操作提供时间窗,减少因操作时间的差异而带来测量误差,降低对设备的要求,提高可行性。
已有研究显示,在过渡金属(二价钴Co(II)[13],一价铜Cu(I)[13-14],二价铁Fe(II)[15])和螯合剂(柠檬酸或乙二胺四乙酸(Ethylene Diamine Tetraacetic Acid,EDTA))存在的碱性硼酸缓冲液(pH8.5 ~10)中,Luminol被H2O2氧化产生的化学光可在几分钟内达到峰值且稳定持续一定时间(2 ~30 s),同时光强度与c(H2O2)在一定范围内有良好的线性关系,Luminol发光反应过程如图2 所示。对比不同过渡金属和螯合剂对Luminol发光强度和稳定性的影响及实验操作的可行性、便捷性等[13],本文选择Co(II)作为过渡金属,EDTA为螯合剂,并以前人研究成果为基础[10,13],进行改良和优化,设计并构建基于Luminol/H2O2化学发光的catalase类的酶动力学测定平台(简称Luminol/H2O2catalase检测系统)。
2 实验方法
2.1 Luminol/H2O2 catalase检测系统的建立
(1)实验试剂的配制。①Luminol 发光液配制:100 mg/mL(0.56 mmol/L)Luminol溶液,用硼酸溶液(0.05 mol/L,pH 8.5 ~10.0)进行配制;②反应液A配制:Co(II)(4 mg/ml)的水溶液(Co(II)的硼酸溶液长期放置易形成沉淀,不易保存,故配置为水溶液以便长期保存);③反应液B 配制:含EDTA(10 mg/mL)的0.1 mol/L的硼酸溶液,其中pH 值在8.5 ~10之间,具体依据测定的c(H2O2)选择;④H2O2标准溶液配置20 μmol/L ~10 mmol/L。
(2)标准曲线的绘制。曲线的绘制过程:①反应预混液配制,将500 μL 反应液A和500 μL 反应液B充分混合,该溶液现配现用;②取100 μL H2O2标准溶液加入10 μL PBS溶液(pH=7.0),混匀后,加入反应混合液和100 μL Luminol 发光液;③利用Luminol化学发光检测仪Berthold FB12-luminometer 检测Luminol化学发光值(Chemiluminescence,CL),CL将在10 ~300 s 内达到最大值,记录最大值;④绘制c(H2O2)-CL标准曲线,当R2>0.95 方可进行后续实验。
(3)catalase 活性检测。活性检测的过程:①用PBS稀释catalase样品至适合的摩尔浓度;配制反应预混液;②取10 μL catalase样品与100 μL已知摩尔浓度的H2O2混合,室温反应1 min 后,加入反应预混液和发光液,此时酶促反应终止,检测CL;③利用标准曲线获得CL 对应的c(H2O2),推算得到H2O2消耗量,进而得到该H2O2摩尔浓度下catalase 的反应速度。实验中需注意,若H2O2消耗量大于5%,则应对酶进行稀释,以确保得到的数据可真实反映酶促反应初速度。
2.2 Lumino/H2O2 catalase 检测系统的性能评估方法
2.2.1 适用范围和数据准确度
按照实验方法1 配制Luminol 发光、反应液A 和pH分别为8.5、9 和10 的反应液B,H2O2标准溶液(20 μmol/L ~10 mmol/L),参照1 中的方法测定并绘制不同pH值下的H2O2标准曲线。
2.2.2 catalase活力的测定
(1)反应液终止酶促反应的效果检测。按上述2.1 的实验方法配制Luminol 发光、反应液A,发光液B(pH 8.5),1 mmol/L H2O2溶液以及0.1μg/mL 的catalase溶液(Merk,2 000 ~5 000 U/mg)。其中:实验组I为H2O2(1 mmol/L,100 μL)+ PBS(10 μL)反应2 min后立即加入反应预混液和发光液进行检测;实验组II 为H2O2(1 mmol/L,100 μL)+catalase(1μg/mL,10 μL)反应2 min,而后加入反应预混液、发光液并进行检测;实验组III为H2O2(1 mmol/L,100 μL)+catalase(1μg/mL,10 μL)反应2 min,与反应预混液混合5 min而后再加入发光液进行检测。
(2)catalase 活力测定。按照上述2.1 的实验方法测定catalase活性,具体如下,配制1、2.5、5、7.5、10 mmol/L的H2O2溶液,反应液B 调至pH =8.5,10 μL catalase溶液分别与不同摩尔浓度的H2O2溶液100 μL混合室温反应1 min,加入反应预混液终止反应并加入100 μL Luminol发光液,检测并读取CL 最大值,根据CL 计算反应初速度,并利用Lineweaver-Burk 双倒数作图法计算catalase的米氏常数Km值。
2.3 利用传统KMnO4 法测定catalase酶活力
配制25% H2SO4溶液,0.01 mol/L KMnO4溶液,10 ~50 mmol/L H2O2溶液,1μg/mL的catalase 溶液。10 mL H2O2溶液(10 ~50 mmol/L)与100 μL catalase溶液混合,室温反应10 min 后立即加入2 mL 25%H2SO4溶液终止反应,用0.01 mol/L KMnO4溶液滴定剩余的H2O2溶液至微红色,记录消耗的KMnO4体积,进而推算反应速率,并利用Lineweaver-Burk 双倒数法测定catalase的Km值。
2.4 数据分析
使用SPSS13.0 软件对实验结果进行分析。实验数据以平均值±标准差表示,组间两两比较采用t 检验,以p <0.05 表示差异具有统计学意义。
3 实验结果与分析
3.1 Luminol/H2O2catalase 检测系统适用范围的确定
检测体系的pH 对CL-H2O2线性关系有直接影响,为确定新检测系统的使用范围和测定准确度,分别测定并绘制了pH =8.5、9.0、10.0 下,CL-c(H2O2)数据图,分析CL 与c(H2O2)的线性关系,实验结果与已有研究相符,如图3 所示。Luminol 发光强度与H2O2在0.02 ~10 mmol/L浓度范围内呈现非常好的线性关系,且不同pH 下,存在线性关系的H2O2c 范围不同(pH=8.5:H2O21 ~10 mmol/L,R2=0.999 8;pH =9.0:H2O20.1 ~1 mmol/L,R2=0.993 5;pH =10.0:H2O240 ~200 μmol/L,R2=0.998 1;),即不同pH 的检测体系适用于不同摩尔浓度范围的H2O2的检测,因此在实际应用时,可根据酶活性选择适宜的底物c(H2O2),进而选择适宜的缓冲液pH值。
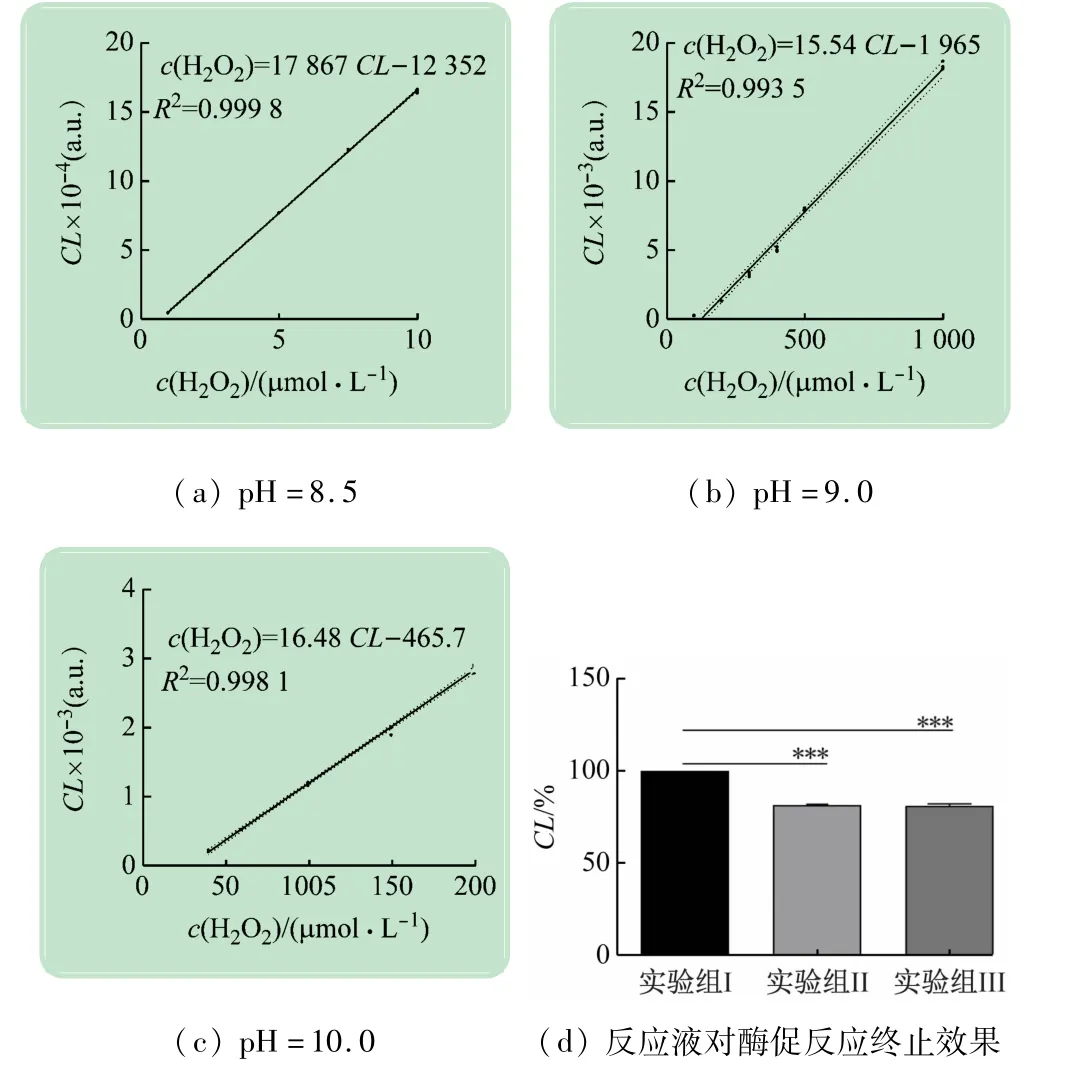
图3 不同pH值的检测系统下CL与c(H2O2)的线性关系
3.2 Luminol/ H2O2 catalase检测系统性能分析
catalase反应速率的准确测定,首先要保证反应时间的准确性,故反应终止点需实现精确控制。传统方法中通常利用浓硫酸终止酶促反应,步骤繁琐且存在安全隐患。新检测系统的实验结果显示,catalase 和H2O2的混合液与反应预混液混合5 min 后再加入发光液,检测得到的光强度与立即加入反应预混液、发光液所测得的光强度无明显差异[见图3(d)],即H2O2的含量没有显著变化(p >0.05),说明酶促反应在加入反应预混液后即被终止,故新检测系统通过加入反应预混液即可实现酶促反应的快速终止,方法简单、便捷,安全性高。
为评估新检测系统的测定质量,利用该检测系统对catalase酶活性进行测定,并以KMnO4滴定法作为参照,如图4 所示。结果显示,Luminol/ H2O2catalase检测系统获得的反应速率倒数(1/v)与底物摩尔浓度倒数(1/S)呈现显著的线性关系(R2=0.998 3),重复实验的数据离散度小,数据稳定性高,计算得到米氏常数Km=(12.4 ±0.11)mmol/L。而利用KMnO4滴定法得到的Km值明显低于Luminol 系统(Km=(9.4 ±1.02)mmol/L,p <0.01),且1/v与1/S 的线性关系较差(R2=0.936 3),数据相对标准误较大,说明新检测系统可更加准确和真实的反映catalase的活性。
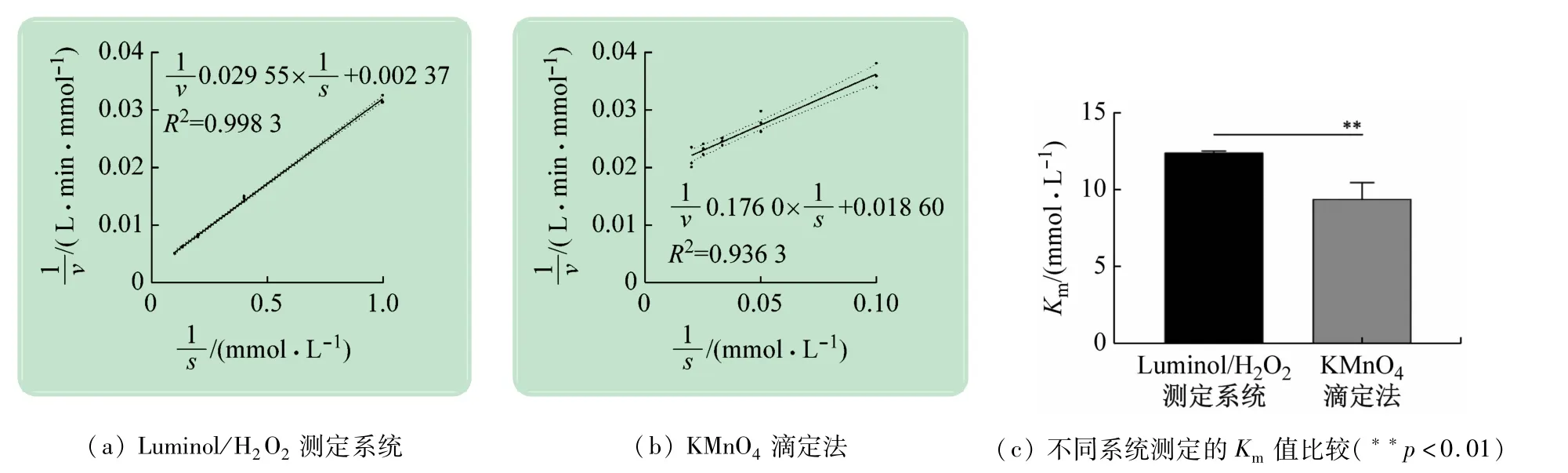
图4 不同检测系统对过氧化氢酶活性测定的比较
此外,KMnO4滴定法对样本量要求较高(1μg/mL catalase,100 μL),而新系统所需的catalase 量仅是传统方法的1/100(0.1μg/mL,10 μL),因此,本系统对待检测样品的活性和蛋白量要求较低,更适合于活性低,获得量少的过氧化氢酶类蛋白样品的测定。
4 结 语
本文以Luminol/ H2O2化学发光为原理,以Co(II)为过渡金属、EDTA 为螯合剂建立Luminol/H2O2酶活检测系统,实现了对catalase 酶活力的准确测定,并对该系统性能进行了测评。结果表明,新系统测定精度高,稳定性强,可广泛适用于对微量H2O2的摩尔浓度检测及对包括catalase 在内的具有分解H2O2能力的各种酶类的活力测定,为过氧化氢酶类的深入研究和开发应用提供重要的技术支持。同时该系统操作简单,耗时较短,对样本量、蛋白活性、操作技术和实验设备要求较低,在教学、科研以及工业等多领域具有较高的应用价值,值得推广。

