55 型人腺病毒致hDSG2 转基因小鼠肺感染动物模型的建立及意义
周恩禄,孙军平,张明月,韩欣洁,王浚宇,汪建新,
1解放军医学院,北京 100853;2 解放军总医院第八医学中心呼吸与危重症医学部,北京 100091
人腺病毒(human adenovirus,HAdV) 是一种没有包膜的双链DNA 病毒,已报道110 余种基因型,可以分为A~ G 7 组[1]。HAdV 具有组织嗜性,7 型、11 型、14 型和55 型等B 组腺病毒主要引起呼吸道感染,在我国常于冬春季交际时节暴发流行[2]。其中,55 型人腺病毒(HAdV-B55)感染力、致病力较强,尤其是在军队和学校曾多次暴发流行[3-5]。50%以上感染的患者可发展成病毒性肺炎,若不及时治疗可发展至危重症肺炎危及生命[6-7]。在探究HAdV 感染发病机制、药物治疗以及多价疫苗研制等研究过程中,啮齿类小动物模型的作用不可或缺[8]。目前已知,HAdV 感染进入宿主细胞的主要途径是通过与细胞膜表面的受体结合后诱导胞饮作用。因此,不同宿主间细胞表面受体的不同是HAdV 具有种属特异性的主要原因。已有研究表明细胞膜表面的桥粒芯糖蛋白2 是HAdV-B55 进入细胞的主要受体[9-11]。而小鼠与人的桥粒芯糖蛋白2 种属差异较大,HAdVB55 无法进入野生型小鼠肺组织细胞,不能完整复制出HAdV-B55 感染人肺组织的病理生理过程。随着CRISPR-Cas9 技术的应用发展,用人源化转基因小鼠感染动物模型进行研究能够有效地解决这一问题[12-14]。因此本实验采用人源化受体桥粒芯糖蛋白2(humanized receptor desmoglein-2,hDSG2)转基因小鼠复制HAdV-B55 肺感染动物模型,以进一步研究HAdV-B55 致病机制和防治措施。
材料与方法
1 实验动物及分组 6~ 8 周龄、体质量(20 ± 2) g的雄性hDSG2 转基因小鼠[北京维通达生物技术有限公司,许可证号:SCXK(京)2019-0002] 和相同周龄、体质量的雄性SPF 级野生型C57BL/6N(C57)小鼠各25 只[北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2012-0001]。按体质量随机数随机将hDSG2 转基因小鼠组(hD 组)和C57 小鼠组(C57 组)各分为感染后3 d、5 d、7 d、14 d 组和PBS 对照组(C 组) 5 个亚组,每组5 只。在中国疾病预防控制中心动物实验中心ABSL-2 负压屏障系统中分笼饲养,使用高温高压灭菌后的饲料和饮水饲养,饲养环境符合国家标准。在实验开始前所有动物在安静条件下适应性饲养3 d,自由食水。本实验已通过中国疾病预防控制中心实验动物福利伦理审查(批准文号:2018-CCDCWER-009)。
2 主要试剂及仪器 (1)病毒株:解放军疾病预防控制中心实验室保存的HAdV-B55 病毒株(编号S1291809019)。通过HAdV-B55 感染A549 细胞的方法[11],传代、分离、纯化取得复制不超过3 代的HAdV-B55 浓缩液(108TCID50)。(2) 主要试剂:戊巴比妥钠(实验室保存),PBS 缓冲液(Gibco),组织DNA 提取试剂盒(天根生化),组织RNA 提取试剂盒(天根生化),超敏多因子试剂盒(Meso Scale Discovery,MSD)。(3) 主要仪器:BS48 生物安全工作台(Tecniplast),荧光定量PCR 仪(Bio-rad),超敏多因子电化学发光分析仪(MSD),全景切片扫描仪[3DHISTECH(Hungary)]。
3 病毒感染方法 采用2%戊巴比妥钠40 μL/10 g腹腔注射麻醉,麻醉后hDSG2 转基因小鼠组和C57 小鼠组的感染实验亚组用HAdV-B55 液(108TCID50)滴鼻感染,50 μL/只。对照组用相同剂量的PBS 缓冲液滴鼻,以上操作均在当日同条件下完成。
4 小鼠一般状况及体质量观察 每日观察小鼠活动情况。在实验动物麻醉滴鼻前,对小鼠进行称重并记录为原始体质量;自滴鼻感染后1 d 开始至14 d,每日同一时间对所有小鼠进行称重并记录为当日体质量。体质量变化(%)计算公式:体质量变化(%)=[(当日体质量-原始体质量)/原始体质量] × 100%。
5 肺系数测定和肺组织病理观察 取小鼠双肺组织,去除血管、气管等多余组织,滤纸吸干表面水分,用电子天平称双肺湿重,计算肺系数(%)[肺系数=肺湿重(g)/小鼠体质量(kg) × 100%]。左肺组织4%多聚甲醛固定,HE 染色光镜下观察肺组织病理变化。
6 HAdV-B55 基因拷贝量实时荧光定量检测 取右肺组织10 mg,经低温组织研磨匀浆后,提取DNA,实时荧光定量法(qPCR)检测肺组织HAdVB55 基因拷贝量(2-ΔΔCt法)。内参使用GAPDH。
7 hDSG2 基因及炎症因子mRNA 表达实时荧光定量检测 取右肺组织10 mg,经低温组织研磨匀浆后,提取RNA,逆转录实时荧光定量法(RTqPCR)检测肺组织内hDSG2 基因、白细胞介素-6(interleukin-6,IL-6)、γ 干扰素(interferon-γ,IFN-γ)mRNA 表达量(2-ΔΔCt法)。内参使用GAPDH。
8 血清中炎症因子水平检测 腹腔注射麻醉下,采用心脏釆血法取小鼠全血,室温静置20 min,3 000 r/min 离心10 min,分离血清。采用MSD 超敏多因子电化学发光检测法检测小鼠血清中炎症因子水平。
9 统计学分析 所有实验数据统计分析和图片绘制均采用Graphpad Prism 8.0 (GraphPad Software Inc.)软件,计量资料以表示,两独立样本间比较采用t检验,多组样本采用单因素方差分析或双因素方差分析,重复观测资料使用重复测量的双因素方差分析,组间比较两两t检验。P<0.05为差异有统计学意义。
结果
1 小鼠感染后一般状况和体质量变化 滴鼻感染HAdV-B55 后第1 天开始,感染小鼠均表现出活动减少,在笼内抱团蜷缩,个别小鼠毛发凌乱、倒立,对照组小鼠精神较感染组活跃,毛发顺滑有光泽;自第3 天开始,hD 组感染小鼠较C57 组活跃度差,反应相对迟钝。hD 组小鼠感染后1 d 体质量降低较显著,体质量增长慢(P<0.01)。见图1。

图1 各组小鼠体质量变化(aP<0.01)Fig.1 Changes in mice weight in each group (aP<0.01)
2 肺系数 hDSG2 转基因小鼠组和C57 小鼠组感染病毒后3 d、5 d、7 d 和14 d 的肺系数均比各自PBS 对照组高;感染后14 d hDSG2 转基因小鼠组的肺系数显著高于C57 小鼠组(P<0.05),提示感染病毒后14 d hDSG2 转基因小鼠肺组织内水肿、渗出等病理变化较C57 小鼠重。见图2。

图2 两组小鼠肺系数比较Fig.2 Comparison of lung coefficient between the two groups
3 肺组织病理变化 感染HAdV-B55 后小鼠肺组织可见肺泡壁增厚、肺间质水肿、支气管肺泡扩张、腔内嗜酸性渗出物、小支气管及血管周围炎性细胞浸润等炎症表现[15];hD-14 d 组较C57-14 d 组炎症表现重。对照组小鼠肺组织未见明显炎症表现。见图3。
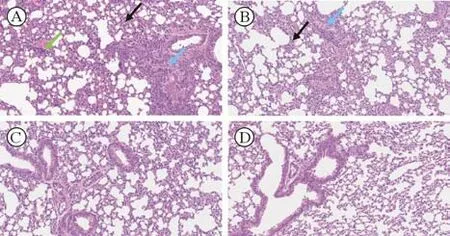
图3 肺组织病理变化(20×)A:hD-14 d 组,可见大面积肺泡壁重度增厚,伴大量炎性细胞浸润(黑色箭头);可见支气管上皮细胞排列不规则,腔内可见嗜酸性物质、坏死脱落的上皮细胞(蓝色箭头);血管周围可见淋巴细胞浸润(绿色箭头)。B:C57-14 d 组,可见肺泡壁轻度增厚,伴少量炎性细胞浸润(黑色箭头);少量支气管上皮细胞 排列不规则,腔内可见嗜酸性物质(蓝色箭头)。C:hD 对照组,正常肺组织病理表现。D:C57 对照组,正常肺组织病理表现Fig.3 Pathological changes in lung tissue (20×)A: hDSG2-14 d group,extensive severe thickening of alveolar wall with massive inflammatory cell infiltration (black arrow)was observed,and irregular arrangement of bronchial epithelial cells could be seen,with eosinophilic matters as well as necrotic and exfoliated epithelial cells in the cavity (blue arrow);lymphocyte infiltration surrounding blood vessels(green arrow) was observed.B: C57-14 d group,mild thickening of alveolar wall with slight inflammatory cell infiltration (black arrow) was observed;irregular arrangement of a small amount of bronchial epithelial cells,with eosinophilic matters could be seen in the cavity (blue arrow);lymphocyte infiltrations surrounding blood vessels (green arrow) was observed.C: hDSG2 control group,pathological of normal lung tissue.D: C57 control group,pathological of normal lung tissue
4 肺组织内hDSG2 mRNA 表达水平和HAdVB55 基因拷贝量 RT-qPCR 结果显示,转基因小鼠肺组织内hDSG2 mRNA 表达水平基本一致,无统计学差异(图4)。C57 小鼠RT-qPCR 检测结果显示CT 值大于35 或无数值,根据判读标准判定为阴性,可以认定C57 小鼠肺组织内不存在hDSG2 基因片段。qPCR 结果显示,hD 组在感染HAdV-B55 后7 d、14 d 病毒基因拷贝量显著高于C57 组(P<0.05)。见图5。

图4 hD 组小鼠肺组织内 hDSG2 mRNA 表达水平Fig.4 mRNA expression of hDSG2 in lung tissues of mice in hD group

图5 两组小鼠肺组织内 HAdV-B55 基因拷贝量Fig.5 Copy number of HAdV-B55 gene in lung tissue in two groups
5 感染后不同时间点肺组织内IL-6、IFN-γ mRNA表达水平比较 hD 组在HAdV-B55 滴鼻感染后,肺组织内的IL-6 mRNA 表达存在显著变化(P<0.01),呈现先逐步升高后下降的趋势;其中hD-3 d、5 d、7 d 组较hD-C 组表达水平显著上调(P<0.05,vshD-3 d、hD-5d 组;P<0.01,vshD-7 d 组),并且均高于hD-14 d 组(P<0.01),hD-14 d 组较hD-C 组表达水平显著降低(P<0.05)。C57 小鼠滴鼻感染病毒后肺组织内IL-6 mRNA 表达出现先短暂上升后下降的趋势,其中C57-14 d 组较C57-C 组表达水平显著降低(P<0.01),但整体变化差异无统计学意义(P>0.05),见图6。hD 组和C57组在HAdV-B55 感染后肺组织内IFN-γ mRNA 表达水平均出现了轻微上调(P<0.01),但因表达量相对倍数差异小于1.5 倍,根据结果判读认为生物学意义不大。

图6 肺组织内 IL-6 mRNA 表达量Fig.6 mRNA expression of IL-6 in lung tissues
6 血清中IL-6、IFN-γ 浓度水平比较 HAdV-B55感染后,hD 组较C57 组血清中IL-6 浓度显著升高(P<0.01);血清中IFN-γ 浓度在感染病毒后无显著变化。见图7。

图7 两组血清 IL-6、IFN-γ 浓度比较(aP<0.01)A:血清 IL-6 浓度;B:血清 IFN-γ 浓度Fig.7 Comparison of sera IL-6 and IFN-γ concentrations between the two groups (aP<0.01)A: serum IL-6 concentration;B: serum IFN-γ concentration
讨论
在既往的一些研究中,B 组人腺病毒能够造成C57、Balb/c 等野生型小鼠肺组织短期炎症表现,但病毒无法在小鼠体内进行复制,炎症持续时间短,病毒感染的病理生理过程不完整。本研究发现hDSG2 转基因小鼠采用滴鼻方式感染HAdV-B55 后,体质量在1 d 内较C57 小鼠显著下降,并且随着实验时间的增加,体质量增长慢,在感染后1 周仍未恢复到感染前的原始体质量,提示hDSG2 转基因小鼠的疾病表现较C57 小鼠持续时间更长。
我们在HAdV-B55 感染小鼠的肺组织病理切片中发现,在感染后14 d hDSG2 转基因小鼠较C57 小鼠的炎症表现更加严重,而C57 小鼠炎症表现呈快速自愈趋势,说明hDSG2 转基因小鼠的肺部感染持续时间更长。
肺系数是常用评价实验动物急性肺损伤的指标之一,其能够反映出肺组织因纤维化、水肿、渗出等病理变化导致的肺脏器重量增加[16-17]。在感染后14 d hDSG2 转基因小鼠肺系数显著高于C57 小鼠,与病理结果一致,提示hDSG2 转基因小鼠肺组织炎症反应较C57 小鼠持续性更好。
通过比较两组小鼠在感染后不同时间肺组织内HAdV-B55 基因拷贝量存在的差异,我们发现在感染后14 d hDSG2 转基因小鼠肺组织内HAdVB55 基因拷贝量约为C57 小鼠组的2 倍,反映出hDSG2 转基因小鼠肺组织内病毒清除速率较C57小鼠慢,提示HAdV-B55 通过胞饮作用进入了肺组织细胞内,存在一定量的病毒复制。
IL-6 是一种重要的多功炎症因子,且是提示感染性疾病严重程度和预后的重要指标[18-20]。本研究中,HAdV-B55 感染后hDSG2 转基因小鼠肺组织内IL-6 mRNA 表达量显著增加,与hDSG2 转基因小鼠血清中IL-6 浓度水平上升相符,并且随着感染时间的延长,hDSG2 转基因小鼠血清IL-6 浓度始终保持相对较高的水平。而C57 小鼠肺组织内IL-6 mRNA 表达量和血清IL-6 浓度均未出现显著变化,提示HAdV-B55 感染后hDSG2 转基因小鼠炎症反应较C57 小鼠更为剧烈、严重,也更贴近人感染HAdV 后的炎症因子表现。
HAdV-B55 感染后hDSG2 转基因小鼠和C57小鼠肺组织中IFN-γ mRNA 表达均出现了轻微上调,但两种小鼠感染病毒后血清IFN-γ 浓度与对照组比较未出现显著变化。病毒感染早期hDSG2 转基因小鼠血清IFN-γ 浓度有过一过性轻度上升,而血清浓度相对较低,可能与抗病毒过程中INF-γ 的消耗有关,也可能与未形成病毒血症有关[21]。
综上所述,我们初步建立了 hDSG2 转基因小鼠HAdV-B55 肺部感染动物模型,该模型在肺感染的持续性和疾病表现等方面,比较接近人感染HAdV 肺炎的临床表现,可借此模型进一步深入研究HAdV-B55 的致病机制和防治措施。本研究为今后进一步完善HAdV 感染模型打下良好的理论基础,通过类似hDSG2 转基因小鼠这类的单受体、双受体或多受体转基因动物来突破种属特异性,构建更多类型的HAdV 感染动物模型,可为研究HAdV 感染机体的机制、疾病的治疗、药物的评价和多价腺病毒疫苗的研制提供研究基础。
作者贡献周恩禄:总体构思,进行实验,数据分析处理,文章撰写;张明月、韩欣洁、王俊宇:协助实验;孙军平:文章修改校对;汪建新:监督指导,资金获取,文章校对。
利益冲突所有作者声明无利益冲突。
数据共享声明本篇论文相关数据可依据合理理由从作者处获取,Email:674000199@qq.com。

