健康人群接种15 价肺炎球菌结合疫苗的安全性评估
潘璐璐 高招 李敏捷 周卫维 信亚楠 方文建 赵颖 杜琳 赵玉良
1 河北省疾病预防控制中心疫苗临床研究所, 石家庄 050021;2 涞水县疾病预防控制中心疫苗临床研究项目办公室,保定 074100;3 北京智飞绿竹生物制药有限公司,北京100176
肺炎链球菌与全球严重疾病负担相关,2 岁以下婴幼儿是肺炎球菌疾病的主要易感人群,病死率尤其高[1-3]。 接种疫苗是预防肺炎球菌疾病的有效方法[4-5]。 目前,国际上使用的疫苗包括用于2 岁及以上人群的肺炎球菌多糖疫苗 (例如23 价肺炎球菌多糖疫苗,PPSV23)[6-7]和2 岁以下婴幼儿的肺炎球菌结合疫苗(例如13 价肺炎球菌结合疫苗)[8]。尽管国内目前上市的13 价肺炎球菌多糖结合疫苗诱导的功能性抗体滴度通常高于肺炎球菌多糖疫苗[9-10],但疫苗未覆盖的血清型已逐渐成为各年龄组肺炎球菌疾病的重要原因[11-12]。 北京智飞绿竹生物制药有限公司研制的15 价肺炎球菌结合疫苗, 每剂疫苗除含有13 价肺炎球菌结合疫苗的血清型外,另增加了2 型和12F 型,这2 个血清型在亚洲较常见[13],适合我国乃至亚洲的肺炎球菌疾病的控制。 该疫苗经过国家药品监督管理局批准开展临床试验(临床试验批件号:2017L04692)。 本研究就15 价肺炎球菌结合疫苗在人群中开展单中心、单臂试验设计的Ⅰ期临床试验的安全性研究结果报告如下。
对象与方法
一、研究对象
2020 年1—8 月在河北省疫苗临床研究基地涞水县疾病预防控制中心开展单中心、单臂设计的Ⅰ期临床试验。 纳入当地常住人口符合年龄要求的受试者共100 名, 其中18 岁及以上成人、1~5 周岁儿童、7~11 月龄婴儿、3 月龄婴儿和2 月龄(最小可至6 周龄)婴儿各20 名。入选标准:符合年龄要求且无肺炎球菌结合疫苗接种史和疫苗接种禁忌症者。 排除标准: 既往有由肺炎链球菌引起的侵袭性疾病史;有疫苗接种或药物严重过敏史;对白喉类毒素过敏者;1 岁以内婴儿出生时体重<2.5 kg、或有产程异常等;有惊厥、癫痫、脑病和精神病病史或家族史;患血小板减少或其它凝血障碍病史;严重先天性畸形、发育障碍等;严重心血管疾病、肝肾疾病、恶性肿瘤或其他急性感染或慢性病活动期;患免疫缺陷症、接受免疫抑制剂治疗等。 本研究经河北省疾病预防控制中心伦理委员会批准 (伦理审批号:IRB2019-002),筛选前向研究对象本人或其法定监护人面对面讲解并签署知情同意书。
二、试验疫苗
本研究所用疫苗为北京智飞绿竹生物制药有限公司研制的15 价肺炎球菌结合疫苗, 该疫苗选择1、2、3、4、5、6A、6B、7F、9V、12F、14、18C、19A、19F、23F 共15 个血清型, 以白喉类毒素作为疫苗的载体蛋白, 采用15 种肺炎球菌培养收获菌体, 经提取、纯化获得荚膜多糖部分,与载体蛋白质结合后经磷酸铝佐剂吸附制备而成。 疫苗规格为每人0.5 mL/支,每支含15 种肺炎球菌荚膜多糖各2 μg(6B 为4 μg), 白喉类毒素30~75 μg。 疫苗批号为20180902,有效期至2021 年9 月25 日。 试验疫苗经中国食品药品检定研究院检验合格, 疫苗均在2~8 ℃条件下运输和保存,有效期内使用。
三、疫苗接种
采用单中心、单臂设计,按照年龄由高到低依次入组。 18 岁以上成人和1~5 岁儿童受试者接种1剂试验疫苗,7~11 月龄组以0、2 月程序接种2 剂试验疫苗,3 月龄组和2 月龄组分别按0、1、2 月程序和0、2、4 月程序接种3 剂试验疫苗,每月按30 d计。成人及儿童于上臂外侧三角肌肌肉注射,1 岁以下婴儿可在大腿前外侧(中间1/3 处)接种,每次0.5 mL。
四、安全性观察
研究对象于接种后留观30 min, 记录接种后30 min 内发生的不良事件。≥18 岁受试者在接种后第4 天进行实验室指标(血常规、血生化及尿常规)检测。 收集所有研究对象接种后30 d 内的不良反应。 按照《预防用疫苗临床试验不良反应分级标准指导原则》对不良反应事件严重程度进行分级。
五、统计学分析
所有统计分析采用统计软件SAS 9.4 完成。 计量资料用均数±标准差(±s)描述。 计数资料或等级资料用频数、频率表述。
结果
一、基本情况
各年龄组男、女性别比分别为2∶3、11∶9、1∶1、11∶9和9∶11。 成人组(≥18 岁)和儿童组(1~5 岁)人群全部完成1 剂疫苗接种和30 d 内的安全性随访。7~11月龄婴儿全部完成2 剂疫苗接种。 3 月龄婴儿全部完成第1 剂疫苗接种,19 名完成第2 剂和第3 剂疫苗接种。 2 月龄婴儿全部完成第1 剂疫苗接种,19名完成第2 剂疫苗接种,18 名完成第3 剂疫苗接种。 婴儿组共脱落3 例。
二、成人(≥18 岁)组及儿童(1~5 岁)组的安全性评估
成人(≥18 岁)及儿童(1~5 岁)组人群共计40名研究对象接种1 剂疫苗后有24 例共发生47 次不良反应, 发生率为60.00%(24/40)。 成人组有14例共发生22 次不良事件;儿童组有10 例共发生25次不良事件。 在观察期内该组研究对象未发生4 级及以上严重不良反应。 两组研究对象共发生3 级不良反应3 例,发生率为7.50%(3/40),均发生于接种后7 d 内,其中2 例为发热症状,1 例为接种部位红肿,且全部发生在儿童(1~5 岁)组,详见表1。

表1 儿童及成人组接种15 价肺炎球菌结合疫苗后不良反应及其严重程度
三、婴儿组人群的安全性评估
20 名7~11 月龄人群中有11 例共发生26 例次不良反应,其中10 例为全身反应,主要为发热(10例)和胃肠道症状(厌食1 例,恶心/呕吐3 例,腹泻3 例);接种部位发红3 例。 20 名受试者接种第1 剂后,有7 例共发生12 例次不良反应;19 名受试者接种第2 剂后,有7 例共发生14 例次不良反应。 观察期内该组研究对象未发生4 级及以上严重不良反应,发生3 级不良反应3 例,均发生于第1 剂接种后7 d 内,其中2 例为发热症状,1 例为接种部位发红。 第2 剂接种后未发生3 级及以上严重不良反应,详见表2。
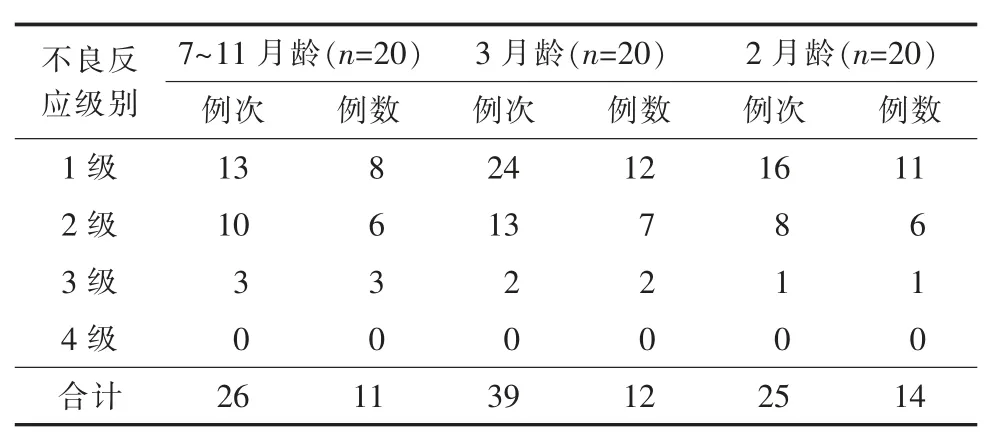
表2 婴儿组接种15 价肺炎球菌结合疫苗后不良反应及其严重程度
40 名2~3 月龄组人群中有26 例共发生64 例次不良反应,发生率65.0%(26/40)。 其中3 月龄12例发生39 例次,2 月龄14 例发生25 例次, 以全身反应为主, 共发生26 例58 例次, 其中发热(57.50%,23/40)和胃肠道反应(腹泻15.00%,6/40)症状较多见,且2 月龄全身反应发生人数(14 例)高于3 月龄(12 例);局部反应共发生2 例6 例次,以接种部位红肿为主,且全部发生于3 月龄组。 该组研究对象共发生3 级及以上不良反应3 例,发生率为7.50%(3/40),2 月龄组发生人数为1 例, 低于3月龄组(2 例)。3 月龄组1 例于接种第1 剂后7 d 内发生3 级腹泻,1 例于接种第3 剂后7 d 内发生3级接种部位发红;2 月龄组1 例于接种第2 剂后7 d内出现3 级超敏反应。 该组人群全部不良反应均发生在接种后7 d 内, 未发生4 级及以上的严重不良反应,详见表2。
讨论
一、 国产15 价肺炎球菌结合疫苗不良反应大多为轻度或中度
随着7 价肺炎球菌结合疫苗(PCV7)纳入婴儿免疫规划后,接种疫苗的儿童及未接种疫苗的其他年龄组人群的疾病负担显著降低,达到了群体保护的效果。 本研究疫苗由国内自主研发,除含有13 价肺炎球菌结合疫苗的血清型外, 另增加了2 型和12F型,较13 价肺炎球菌多糖结合疫苗更高价次,保护范围更广,可用于2 岁以下婴儿。 安全性评价结果显示,成人、儿童、婴儿组人群无论以何种程序接种研究疫苗,发生的全身和局部不良反应大多为轻度或中度,持续时间短暂,且出现不良反应的时间均与接种疫苗间隔较短。
二、 婴儿接种国产15 价肺炎球菌结合疫苗不良反应与成人有所不同
本研究疫苗在18 岁以上成人显示的最主要局部不良反应为接种部位轻度疼痛,全身反应为轻度发热,全部发生在接种后7 d 内。与其他相关研究报告的肺炎球菌结合疫苗在成人接种后安全性结果一致[13-14]。1~5 岁儿童组的局部症状如轻度红、肿、疼痛发生例数相当。 1 岁以上人群未见胃肠道及过敏症状,观察期未发生严重不良反应及死亡事件。 一项随机、双盲、多中心的Ⅱ期临床研究比较了两种配方(无佐剂或铝佐剂)15 价肺炎球菌结合疫苗和13 价肺炎球菌结合疫苗的安全性和免疫原性,结果显示,12~15 月龄婴儿接种后出现的主要局部症状有发红、肿和硬结,且各剂接种后的不良反应发生率未见明显差异[14],与本文同年龄组人群的不良反应结果一致。
本研究1 岁以内婴儿组不良反应与成人有所不同, 全身不良反应主要为轻度发热和轻度腹泻,持续时间较短,可能与婴儿消化系统及免疫系统发育不成熟有关。 7~11 月龄主要表现为全身症状,包括发热、胃肠道反应如厌食、恶心、腹泻等,与其他肺炎球菌结合疫苗在6~10 周龄婴儿肿接种后的不良反应相似[15]。 局部症状以接种部位红肿多见,未见2~3 月龄组人群报告的烦躁、易激惹等神经系统症状。2 月龄组未见接种部位的不良反应,全身反应与3 月龄发生率基本相同。 观察期内未见其他相关研究报告的嗜睡症状[15-16],而轻度食欲减退、应激反应等全身症状与相关研究报告结果一致[16]。
综上, 国产15 价肺炎球菌结合疫苗安全性良好,于各年龄组人群的接受度较高,未发生与疫苗接种有关的严重不良反应或死亡事件。 该研究结果对后期评价该疫苗用于婴幼儿人群中的安全性和免疫原性的Ⅱ、Ⅲ期临床试验提供数据支持。 另外,为开发同类的创新型疫苗,探索提高疫苗保护效果的方法和策略提供参考。 根据《疫苗临床试验技术指导原则》要求,Ⅰ期临床试验为样本量较小(20~30 人)的研究,按照先成人、后儿童、最后婴儿的顺序分步进行,本研究为满足以上要求,样本量受限,可能无法观察到较为罕见的不良反应,因此需要进一步实施大样本的Ⅱ/Ⅲ期临床试验确认本研究疫苗的安全性和有效性。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明潘璐璐、高招、赵玉良:研究设计,数据采集和分析,文章撰写;李敏捷、周卫维、信亚楠:收集资料,解答学术问题;方文建、赵颖:文章审阅,工作支持;杜琳:研究设计、文章审阅、工作支持

