汉防己甲素对支气管哮喘小鼠气道重塑的影响及机制探讨
王生成 李琪 蔡潇阳 唐咏婕
摘要:目的 探究汉防己甲素对支气管哮喘小鼠气道重塑及高迁移率族蛋白B1(HMGB1)/Toll样受体4(TLR4)/核因子κB(NF-κB)信号通路的影响。方法 构建支气管哮喘小鼠模型,将建模成功的40只小鼠随机分为模型组,汉防己甲素低(20 mg/kg)、高(40 mg/kg)剂量组和地塞米松(10 mg/kg)组,每组10只。另取10只小鼠不建模作为对照组。各组小鼠给予相应干预2周。ELISA法检测血清肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-6、IL-1β水平;苏木素-伊红染色观察肺组织病理学变化并进行肺损伤评分;测定小鼠支气管管壁厚度和支气管平滑肌厚度;荧光定量PCR(qPCR)和蛋白印迹法(Western blot)检测肺组织HMGB1、TLR4、NF-κB mRNA和蛋白表达水平。结果 对照组小鼠肺组织支气管无病理损伤。与对照组相比,模型组小鼠支气管管壁及平滑肌增厚,黏膜上皮增生、皱襞增多,管腔缩小,气管内黏液渗出明显;血清TNF-α、IL-6、IL-1β水平,肺损伤评分,支气管管壁及支气管平滑肌厚度,HMGB1、TLR4、NF-κB mRNA和蛋白表达水平显著升高(P<0.05)。与模型组相比,汉防己甲素低、高劑量组小鼠肺组织病变程度逐渐减轻,血清TNF-α、IL-6、IL-1β水平,肺损伤评分,支气管管壁及支气管平滑肌厚度,HMGB1、TLR4、NF-κB mRNA和蛋白表达水平依次降低(P<0.05);汉防己甲素高剂量组和地塞米松组小鼠各项指标比较差异均无统计学意义(P>0.05)。结论 汉防己甲素可减轻支气管哮喘小鼠气道重塑程度和炎性因子水平,保护肺组织,其机制可能与抑制HMGB1/TLR4/NF-κB信号通路有关。
关键词:粉防己碱;哮喘;气道重塑;HMGB1蛋白质;Toll样受体4;NF-κB
中图分类号:R562.25,R349.6文献标志码:ADOI:10.11958/20222063
Effect and mechanism of tetrandrine on airway remodeling in bronchial asthma mice
WANG ShengchengLI Qi CAI Xiaoyang TANG Yongjie
1 Department of Respiratory Medicine, Danzhou People's Hospital, Danzhou 571700, China;
2 Department of Respiratory Medicine, the First Affiliated Hospital of Hainan Medical College
Corresponding Author E-mail: lqlq198210@sina.com
Abstract: Objective To investigate the effect of tetrandrine on airway remodeling and high mobility group protein box 1 (HMGB1)/Toll-like receptor 4 (TLR4)/nuclear factor-κB (NF-κB) signaling pathway in bronchial asthma mice. Methods A mouse model of bronchial asthma was established, and 40 model mice were randomly divided into the model group, the tetrandrine low dose (20 mg/kg) group, the high dose (40 mg/kg) group and the dexamethasone (10 mg/kg) group, with 10 mice in each group. Another 10 mice without modeling were useed as the control group. Each group was given corresponding intervention for 2 weeks. Serum levels of tumor necrosis factor-α (TNF-α), interleukin (IL-6) and IL-1β were determined by ELISA. Hematoxylin-eosin staining was used to observe lung histopathological changes, and lung injury score was performed. The thickness of bronchial tube wall and bronchial smooth muscle were determined. Expression levels of HMGB1, TLR4, NF-κB mRNA and protein in lung tissue were detected by fluorescence quantitative PCR (qPCR) and Western blot assay. Results No pathological damage was found in bronchus of lung tissue in the control group. Compared with the control group, the bronchial tube wall and smooth muscle of lung tissue in the model group were thickened, mucosal epithelium hyperplasia, and lumen shrank and tracheal mucus exudated significantly. Serum levels of TNF-α, IL-6 and IL-1β, lung injury score, bronchial wall thickness, bronchial smooth muscle thickness, HMGB1, TLR4, NF-κB mRNA and protein expression levels were increased significantly (P<0.05). Compared with the model group, the degree of lung lesions was gradually reduced in the low and high dose tetrandrine groups, and serum levels of TNF-α, IL-6, IL-1β, lung injury scores, bronchial wall and bronchial smooth muscle thickness, HMGB1, TLR4, NF-κB mRNA and protein expression were successively decreased. There were no significant differences in above indexed between the tetrandrine high dose group and the dexamethasone group (P>0.05). Conclusion Tetrandrine can reduce the degree of airway remodeling and the level of inflammatory factors in mice with bronchial asthma, and protect lung tissue, which may be related to the inhibition of HMGB1/TLR4/NF-κB signal pathway.
Key words: tetrandrine; asthma; airway remodeling; HMGB1 protein; Toll-like receptor 4; NF-kappa B
支气管哮喘是一种由气道平滑肌细胞、上皮细胞、嗜酸性粒细胞等多种细胞参与的呼吸道炎症疾病[1]。由于气道炎症迁延不愈,导致组织增生,气道重塑;而气道重塑的发生会进一步引起不可逆的气道阻塞,使得哮喘变得更加难以治愈[2]。高迁移率族蛋白B1(high mobility group protein box 1,HMGB1)是一种内源性炎性因子,由坏死细胞或巨噬细胞等在炎症刺激下释放,释放出细胞外可以激发免疫反应或参与信号转导过程[3]。Toll样受体4(Toll like receptor 4,TLR4)是一种免疫识别受体,可参与炎症的启动和调节过程[4]。研究发现,HMGB1与TLR4结合可激活核因子κB(NF-κB)炎症通路,引起下游的炎性因子释放[5]。HMGB1/TLR4/NF-κB信号通路在哮喘大鼠气道炎症及气道重塑方面发挥重要作用[6]。汉防己甲素又称粉防己碱,是一类具有良好生物活性的天然双苄基四氢异喹啉生物碱,具有抗炎效果[7]。研究表明,汉防己甲素能有效改善尘肺患者的临床症状和肺通气功能,减轻炎症反应,改善病情[8]。但汉防己甲素可否通过HMGB1/TLR4/NF-κB信号通路发挥对哮喘的治疗效果尚不明确。本研究分析汉防己甲素对支气管哮喘小鼠气道重塑及HMGB1/TLR4/NF-κB信号通路的影响,以期为支气管哮喘的临床防治提供参考。
1 材料与方法
1.1 材料
1.1.1 实验动物 50只SPF级BALB/c小鼠(雌雄各半),6~8周龄,体质量18~22 g,购自四川横竖生物科技股份有限公司,生产许可证号:SCXK(川)2021-0007,小鼠饲养于温度为24 ℃±2 ℃、相对湿度为65%±3%、12 h光暗交替的饲养房中,自由饮食。本研究经儋州市人民医院伦理委员会批准(批准编号:DYLS2022-5-4)。
1.1.2 药物、试剂与仪器 汉防己甲素(原料药,纯度≥99.5%)购自西安飞达生物技术有限公司;地塞米松片购自广东华南药业集团有限公司;卵清蛋白(OVA)、氢氧化铝、HE染色试剂盒、PCR试剂盒、蛋白检测试剂盒均购自雅安普莱美生物科技有限公司;肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-6、IL-1β酶联免疫吸附试验(ELISA)试剂盒、Trizol试剂、蛋白裂解液、ECL发光液均购自深圳灵赋拓普生物科技有限公司;兔源HMGB1、TLR4、NF-κB、GAPDH一抗,羊抗兔二抗均购自武汉时胜生物科技有限公司。超声雾化器(型号JWS-CWN)、显微镜(型号XSZ-107)均购自上海聚慕医疗器械有限公司;酶标仪(型号K3-PLus)、荧光定量PCR(qPCR)仪(型号MA-1640Q)、凝胶成像系统(型号WD-9413B)均购自杭州比格飞序生物科技有限公司。
1.2 方法
1.2.1 模型的建立及分组给药 采用OVA致敏法构建支气管哮喘小鼠模型[9]。各组小鼠于第1、14天腹腔注射致敏液(20 μg OVA和1 mg氢氧化铝溶于0.2 mL生理盐水),第20天开始使用超声雾化器用3%OVA生理盐水喷雾激发小鼠哮喘发作,喷雾每日1次,每次30 min,连续7 d,小鼠出现腹肌痉挛、呼吸加快、站立不稳等现象提示建模成功[10]。将建模成功的40只小鼠按照随机数字表法分为模型组,汉防己甲素低(20 mg/kg)、高(40 mg/kg)剂量组[11]和地塞米松(10 mg/kg)组[12],每组10只。另取10只小鼠作为对照组,以等量生理盐水代替致敏液和喷雾,重复同样实验操作。
汉防己甲素低、高剂量组小鼠分别给予20、40 mg/kg汉防己甲素灌胃给药[11](将汉防己甲素以生理盐水溶解成浓度分别为2、4 g/L的混悬液,灌胃体积10 mL/kg);地塞米松组小鼠给予10 mg/kg地塞米松灌胃给药[12](将地塞米松片以生理盐水溶解浓度为1 g/L的混悬液,灌胃体积10 mL/kg);模型组和对照组小鼠给予等体积生理盐水灌胃。各组给药每日1次,连续2周。
1.2.2 ELISA法检测血清中TNF-α、IL-6、IL-1β水平 给药结束24 h后,戊巴比妥钠麻醉小鼠,腹主动脉取血,4 ℃、4 700 r/min离心14 min,取上层血清。ELISA法检测血清中TNF-α、IL-6、IL-1β水平。
1.2.3 标本采集 采血后处死小鼠,分离肺组织,切取左肺组织和部分支氣管,4%多聚甲醛固定,切取部分右肺组织冻存于液氮中。
1.2.4 HE染色观察肺组织病理学变化及肺损伤评分 将左肺组织于4%多聚甲醛固定24 h后,常规石腊包埋,切片(厚度5 μm),HE染色,光镜下观察。同时根据肺间质水肿、肺泡水肿、中性粒细胞浸润、肺泡内充血沉积4项指标病理变化情况进行肺损伤评分[13]:每项指标0~4分,无明显变化记0分,轻度变化记1分,中度变化记2分,重度变化记3分,严重变化记4分,总分为16分。肺损伤评分总分为4项指标评分之和。每只小鼠取3张切片,每张切片随机选取6个视野观察,记录肺损伤评分,取平均值。
1.2.5 支气管管壁厚度和支气管平滑肌厚度测定 取1.2.4中HE染色的肺组织切片,置于光镜下观察,挑选有完整横断面的支气管进行测量,用Image-Pro Plus 6.0图像分析软件分别测量肺组织中支气管基底膜周径(Pbm)、支气管管壁总面积(Wat)、支气管平滑肌面积(Wam)。根据上述测量指标计算支气管管壁厚度和支气管平滑肌厚度。支气管管壁厚度(μm)=Wat/Pbm,支气管平滑肌厚度(μm)=Wam/Pbm,以这2个指标代表小鼠气道重塑程度,比值越大,表明气道重塑程度越高。
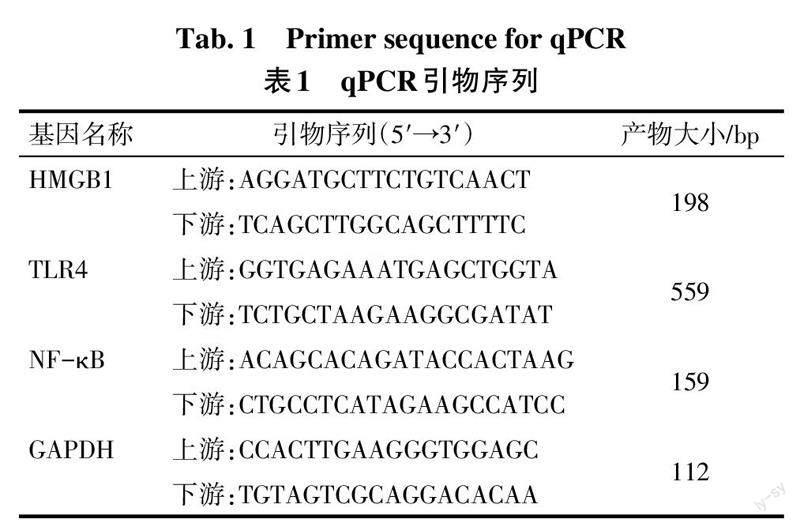
1.2.6 qPCR检测肺组织中HMGB1、TLR4、NF-κB mRNA表达水平 取1.2.3中小鼠右肺组织,Trizol试剂提取总RNA,逆转录合成cDNA,采用qPCR法检测HMGB1、TLR4、NF-κB mRNA表达水平,内参基因为GAPDH。反应体系:cDNA 2 μL,缓冲液5 μL,dNTPs 4 μL,上、下游引物各1 μL,DNA聚合酶1 μL,ddH2O 16 μL,共30 μL。反应程序:95 ℃预变性10 min;95 ℃ 10 s,55 ℃ 35 s,72 ℃ 60 s,40个循环;72 ℃延伸10 min。引物由湖北逸挚诚生物科技有限公司合成,引物序列见表1。采用2-ΔΔCt法计算目的mRNA相对表达量。
1.2.7 蛋白印迹法检测肺组织中HMGB1、TLR4、NF-κB蛋白表达水平 取1.2.3中小鼠右肺组织,匀浆后加入蛋白裂解液提取总蛋白,BCA蛋白检测试剂盒定量总蛋白。取适量蛋白,上样,电泳分离,转膜,用5%脱脂奶粉室温封闭1 h,然后加入兔源HMGB1(1︰620)、TLR4(1︰550)、NF-κB(1︰750)、GAPDH(1︰720)一抗,4 ℃下孵育过夜,再加入羊抗兔二抗(1︰1 700),室温孵育1 h,ECL发光液显色。以GAPDH为内参,使用Image J软件进行灰度值分析,计算目标蛋白相对表达量(目标蛋白与内参GAPDH灰度值之比)。
1.3 统计学方法 使用SPSS 26.0软件进行数据分析,计量资料以x±s表示,多组间均数比较采用单因素方差分析,组间多重比较行SNK-q检验,P<0.05为差异有统计学意义。
2 结果
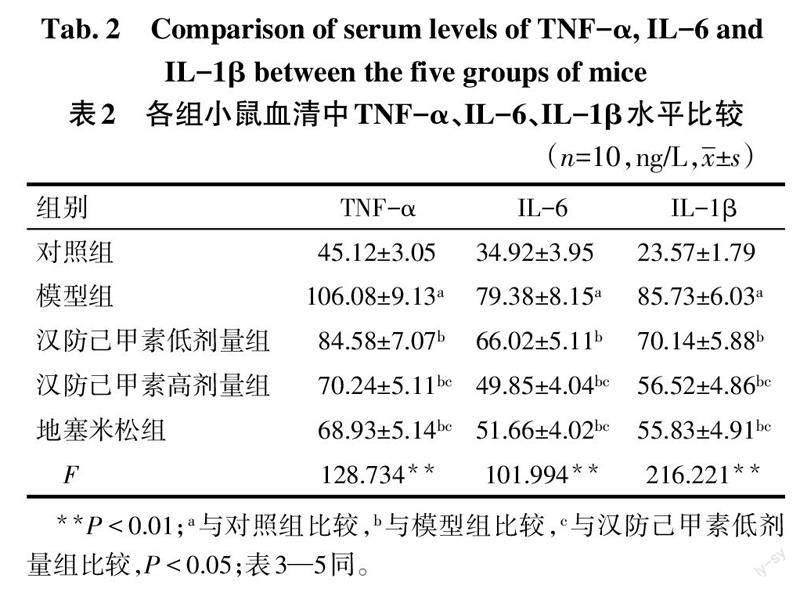
2.1 各组血清TNF-α、IL-6、IL-1β水平变化 与对照组相比,模型组小鼠血清中TNF-α、IL-6、IL-1β水平升高(P<0.05);与模型组相比,汉防己甲素低、高剂量组小鼠血清中TNF-α、IL-6、IL-1β水平依次降低(P<0.05);汉防己甲素高剂量组和地塞米松组上述3项指标水平差异无统计学意义(P>0.05)。见表2。
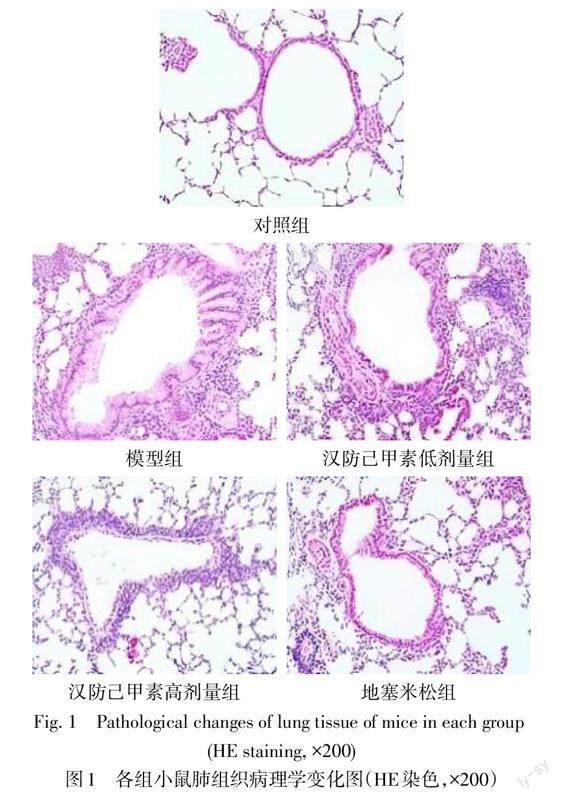
2.2 各组肺组织病理学改变及肺损伤评分变化 HE染色显示,对照组小鼠支气管管壁完整、平滑肌厚度正常、黏膜平整,基层细胞排列整齐;模型组小鼠支气管管壁及平滑肌厚度明显增厚,黏膜上皮增生、皱襞增多,管腔缩小,气管内黏液渗出明显;汉防己甲素低、高剂量组的上述病理学变化程度逐渐减轻;汉防己甲素高剂量组与地塞米松组小鼠肺组织病理学变化相近;见图1。
对照组、模型组、汉防己甲素低剂量组、汉防己甲素高剂量组、地塞米松组小鼠肺损伤评分分别为(0.00±0.00)、(9.95±0.87)、(6.37±0.52)、(3.06±0.45)、(3.20±0.42)分,差异有统计学意义(n=10,F=508.567,P<0.01)。与对照组相比,模型组小鼠肺损伤评分升高(P<0.05);与模型组相比,汉防己甲素低、高剂量组小鼠肺损伤评分依次降低(P<0.05);汉防己甲素高剂量组与地塞米松组小鼠肺损伤评分差异无统计学意义(P>0.05)。
2.3 各组支气管管壁和平滑肌厚度改变 与对照组相比,模型组小鼠支气管管壁及平滑肌厚度增厚(P<0.05);与模型组相比,汉防己甲素低、高剂量组支气管管壁及平滑肌厚度依次降低(P<0.05);汉防己甲素高剂量组与地塞米松组支气管管壁及平滑肌厚度差异无统计学意义(P>0.05)。见表3。
2.4 汉防己甲素对肺组织中HMGB1、TLR4、NF-κB mRNA表达水平的影响 与对照组相比,模型组小鼠肺组织中HMGB1、TLR4、NF-κB mRNA表达水平显著升高(P<0.05);与模型组相比,汉防己甲素低、高剂量组小鼠肺组织中HMGB1、TLR4、NF-κB mRNA表达水平依次降低(P<0.05);汉防己甲素高剂量组与地塞米松组上述指标差异无统计学意义(P>0.05)。见表4。
2.5 汉防己甲素对肺组织中HMGB1、TLR4、NF-κB蛋白表达水平的影响 与对照组相比,模型组小鼠肺组织中HMGB1、TLR4、NF-κB蛋白表达水平显著升高(P<0.05);与模型组相比,汉防己甲素低、高剂量组小鼠的肺组织中HMGB1、TLR4、NF-κB蛋白表达水平依次降低(P<0.05);汉防己甲素高剂量组与地塞米松组上述指标差异无统计学意义(P>0.05)。见图2、表5。
3 讨论
3.1 支气管哮喘小鼠模型的建立 支气管哮喘会引发肺功能进行性损伤和下降,最终导致气道阻塞,这一系列变化被称为气道重塑[14]。气道重塑是引起气道阻塞和气道高反应性的重要机制,是影响哮喘反复发作及肺功能进行性下降的重要因素[15]。因此,有效緩解哮喘气道重塑反应在支气管哮喘的治疗中具有重要作用。本研究发现支气管哮喘小鼠血清TNF-α、IL-6、IL-1β水平升高,肺损伤评分增加,支气管管壁及支气管平滑肌厚度增厚。病理学结果显示,对照组小鼠肺组织支气管无病理损伤;模型组小鼠肺组织支气管管壁及平滑肌厚度明显增厚,黏膜上皮增生、皱襞增多,管腔缩小,气管内黏液渗出明显。提示建模成功的小鼠炎性因子增多且气道发生重塑。
3.2 汉防己甲素对支气管哮喘的保护作用 汉防己甲素是中药汉防己的提纯物,具有抗炎、抗过敏、抗肿瘤等多重功效,临床常应用于治疗关节痛、肺纤维化、矽肺等疾病[16]。Song等[17]研究发现,汉防己甲素可抑制肺巨噬细胞中的NOD样受体热蛋白结构域相关蛋白3炎症小体来减轻矽肺病的症状。Jiao等[18]研究表明,汉防己甲素通过抑制NF-κB和细胞外信号调节激酶1/2途径,改善高氧诱导的新生大鼠肺损伤。本研究结果显示,汉防己甲素处理后的支气管哮喘小鼠肺组织病变程度减轻,血清TNF-α、IL-6、IL-1β水平,肺损伤评分,支气管管壁厚度,支气管平滑肌厚度降低,且汉防己甲素剂量越高,改善效果越明显。由此表明汉防己甲素能降低支气管哮喘小鼠炎性因子水平,改善气道重塑程度。
3.3 漢防己甲素可能通过抑制HMGB1/TLR4/NF-κB通路保护支气管哮喘小鼠肺组织 HMGB1/TLR4/NF-κB是促成炎症损伤的重要信号通路,作为应激信号,HMGB1可通过与晚期糖基化终末产物受体、TLR4等受体识别结合,激活NF-κB等信号通路,发挥其生物学效应[19]。朴颖等[20]研究发现,通过抑制HMGB1/TLR4/NF-κB通路可减轻OVA诱导的过敏性哮喘豚鼠的气道炎症。Zhang等[21]研究发现,维生素D通过抑制HMGB1/TLR4/NF-κB通路减轻哮喘小鼠的炎症反应和肺组织中的细胞凋亡。本研究发现,支气管哮喘小鼠肺组织中HMGB1、TLR4、NF-κB mRNA和蛋白表达升高;汉防己甲素处理后的支气管哮喘小鼠肺组织中三者mRNA和蛋白表达降低,且汉防己甲素剂量越高效果越明显。表明汉防己甲素可抑制HMGB1/TLR4/NF-κB通路,结合朴颖等[20-21]的研究结果,笔者认为汉防己甲素可能通过抑制HMGB1/TLR4/NF-κB通路保护支气管哮喘小鼠肺组织。
综上所述,汉防己甲素可减轻支气管哮喘小鼠气道重塑程度和炎性因子水平,保护肺组织,其机制可能与抑制HMGB1/TLR4/NF-κB信号通路的激活有关。但本研究仅限于动物实验,与临床应用还有很大差距。
参考文献
[1] BATRAKOVA E,KARTASHOVA O,BABASKINA L,et al. Effect of combined glucocorticoid therapy on bronchial asthma dynamics[J]. Allergol Immunopathol (Madr),2022,50(1):68-74. doi:10.15586/aei.v50i1.481.
[2] SCHIFFER M,PETERS K,PETERS M,et al. Comparison of airway remodeling in two different endotypes of allergic asthma[J]. Int Arch Allergy Immunol,2022,183(7):714-725. doi:10.1159/000522189.
[3] CHEN G,ZHAO Q,YUAN B,et al. ALKBH5-modified HMGB1-STING activation contributes to radiation induced liver disease via innate immune response[J]. Int J Radiat Oncol Biol Phys,2021,111(2):491-501. doi:10.1016/j.ijrobp.2021.05.115.
[4] CIESIELSKA A,MATYJEK M,KWIATKOWSKA K. TLR4 and CD14 trafficking and its influence on LPS-induced pro-inflammatory signaling[J]. Cell Mol Life Sci,2021,78(4):1233-1261. doi:10.1007/s00018-020-03656-y.
[5] MIAO L,HUANG F,SUN Y Y,et al. Curcumin plays a local anti-inflammatory and antioxidant role via the HMGB1/TLR4/NF-ΚB pathway in rat masseter muscle under psychological stress[J]. J Oral Rehabil,2022,49(2):249-257. doi:10.1111/joor.13289.
[6] WANG Q,CUI Y,WU X,et al. Evodiamine protects against airway remodelling and inflammation in asthmatic rats by modulating the HMGB1/NF-κB/TLR-4 signalling pathway[J]. Pharm Biol,2021,59(1):192-199. doi:10.1080/13880209.2020.1871374.
[7] 张翔宇,曹世杰,王小莹,等. 汉防己甲素及其衍生物的研究进展[J]. 中国药物化学杂志,2022,32(1):43-52. ZHANG X Y,CAO S J,WANG X Y,et al. Research progress on tetrandrine and its derivatives[J]. Chinese Journal of Medicinal Chemistry,2022,32(1):43-52. doi:10.14142/j.cnki.cn21-1313/r.2022.01.008.
[8] 侯博文,李宝平,孙治平,等. 汉防己甲素片联合大容量全肺灌洗术治疗尘肺的临床效果[J]. 职业与健康,2020,36(16):2164-2167. HOU B W,LI B P,SUN Z P,et al. Clinical effect of Tetrandrine Tablets combined with large-volume whole lung lavage on pneumoconiosis[J]. Occup and Health,2020,36(16):2164-2167. doi:10.13329/j.cnki.zyyjk.2020.0580.
[9] 王璇,钱桂英,凌晓颖,等. 黄龙止咳颗粒治疗哮喘的网络药理学研究及实验验证[J]. 南京中医药大学学报,2022,38(6):496-503. WANG X,QIAN G Y,LING X Y,et al. The network pharmacological study and experimental verification of huanglong antitussive granule in the treatment of asthma[J]. J Nanjing Univ Tradit Chin Med,2022,38(6):496-503. doi:10.14148/j.issn.1672-0482.2022.0496.
[10] 侯从岭,芦晓帆,雷小婷,等. 川贝母对卵清蛋白致敏哮喘小鼠的作用及其机制[J]. 解放军医学杂志,2022,47(8):789-794. HOU C L,LU X F,LEI X T,et al. Effect of FRITILLARIA cirrhosae bulbus on ovalbumin sensitized mouse asthma and its mechanism[J]. Med J Chin PLA,2022,47(8):789-794. doi:10.11855/j.issn.0577-7402.2022.08.0789.
[11] 向军英,陈丽,贺国斌. 汉防己甲素对小鼠溃疡性结肠炎的作用机制研究[J]. 中国临床药理学杂志,2020,36(22):3769-3772. XIANG J Y,CHEN L,HE G B. Effects and mechanism of tetrandrine on the ulcerative colitis in mice[J]. Chin J Clin Pharmacol,2020,36(22):3769-3772. doi:10.13699/j.cnki.1001-6821.2020.22.046.
[12] 朱翔,肖云斌,易晓莲. 槲皮素对支气管哮喘小鼠气道炎症的作用及机制研究[J]. 中国现代医学杂志,2020,30(13):19-22. ZHU X,XIAO Y B,YI X L. Inhibitory effect of quercetin on airway inflammation in mice with bronchial asthma[J]. China Journal of Modern Medicine,2020,30(13):19-22. doi:10.3969/j.issn.1005-8982.2020.13.004.
[13] 赵利芳,杨建功,文先杰,等. 激活蛋白-1对机械通气性肺损伤小鼠肺组织炎症反应、细胞凋亡和MMP-9/TIMP-1平衡的影响[J]. 郑州大学学报(医学版),2022,57(1):97-102. ZHAO L F,YANG J G,WEN X J,et al. Influence of AP-1 on lung tissue inflammatory response, cell apoptosis and MMP-9/TIMP-1 balance in ventilator-induced lung injury mice[J]. Journal of Zhengzhou University(Medical Sciences),2022,57(1):97-102. doi:10.13705/j.issn.1671-6825.2021.11.034.
[14] WINKLER T,FREY U. Airway remodeling:Shifting the trigger point for exacerbations in asthma[J]. J Allergy Clin Immunol,2021,148(3):710-712. doi:10.1016/j.jaci.2021.07.010.
[15] CHEN X,XIAO Z,JIANG Z,et al. Schisandrin B attenuates airway inflammation and airway remodeling in asthma by inhibiting NLRP3 inflammasome activation and reducing pyroptosis[J]. Inflammation,2021,44(6):2217-2231. doi:10.1007/s10753-021-01494-z.
[16] 席苑,张海静,叶祖光,等. 汉防己甲素现代药理作用研究进展[J]. 中国中药杂志,2020,45(1):20-28. XI Y,ZHANG H J,YE Z G,et al. Research development on modern pharmacological effect of tetrandrine[J]. China Journal of Chinese Materia Medica,2020,45(1):20-28. doi:10.19540/j.cnki.cjcmm.20190830.401.
[17] SONG M Y,WANG J X,SUN Y L,et al. Tetrandrine alleviates silicosis by inhibiting canonical and non-canonical NLRP3 inflammasome activation in lung macrophages[J]. Acta Pharmacol Sin,2022,43(5):1274-1284. doi:10.1038/s41401-021-00693-6.
[18] JIAO B,TANG Y,LIU S,et al. Tetrandrine attenuates hyperoxia-induced lung injury in newborn rats via NF-κB p65 and ERK1/2 pathway inhibition[J]. Ann Transl Med,2020,8(16):1018-1020. doi:10.21037/atm-20-5573.
[19] WANG J,LI R,PENG Z,et al. HMGB1 participates in LPS?induced acute lung injury by activating the AIM2 inflammasome in macrophages and inducing polarization of M1 macrophages via TLR2,TLR4,and RAGE/NF-κB signaling pathways[J]. Int J Mol Med,2020,45(1):61-80. doi:10.3892/ijmm.2019.4402.
[20] 朴颖,王重阳,宋艺兰,等. 朝医麻黄定喘汤对OVA诱导的过敏性哮喘豚鼠模型HMGB1/TLR4/NF-κB信号通路的影响[J]. 中国病理生理杂志,2022,38(5):913-919. PIAO Y,WANG C Y,SONG Y L,et al. Effects of Chao medicine Mahuang-Dingchuan decoction on HMGB1/TLR4/NF-κB signaling pathway in guinea pig model of allergic asthma induced by OVA[J]. Chinese Journal of Pathophysiology,2022,38(5):913-919. doi:10.3969/j.issn.1000-4718.2022.05.018.
[21] ZHANG H,YANG N,WANG T,et al. Vitamin D reduces inflammatory response in asthmatic mice through HMGB1/TLR4/NF-κB signaling pathway[J]. Mol Med Rep,2018,17(2):2915-2920. doi:10.3892/mmr.2017.8216.
(2023-01-16收稿 2023-03-16修回)
(本文编辑 李鹏)

