ANCA 相关性血管炎维持性血液透析再发肺出血1 例并文献复习
金爽晨,位红兰,董骏武*,
(1.江汉大学 医学部,湖北 武汉 430056;2.武汉市第四医院 肾病内科,湖北 武汉 430030)
抗中性粒细胞胞浆抗体(anti-neutrophil cytoplasmic aitibodies,ANCA)相关血管炎(ANCAassociatiod vasculitis,AAV)是一组累及多系统的由ANCA 介导的小血管壁炎症和纤维蛋白样坏死为特征的疾病。该病最易受累的是肾脏和肺,常表现为急进型肾小球肾炎和弥漫性肺泡出血[1]。据目前研究可知,AAV 患者进入透析后血管炎复发率较低(10%),再发弥漫性肺泡出血(diffuse alveolar hemorrhage,DAH)概率更低[2]。本研究报道1 例ANCA 相关性血管炎维持性血液透析再发弥漫性肺泡出血,旨在提高对本病的认识,减少误诊和漏诊。
1 一般资料
患者,男性,55 岁,因“血液透析1 年半,咳嗽、咳血2 天”于2018 年10 月9 日入院。患者2016 年12 月3 日无明显诱因出现腹痛、无尿伴发热,于外院诊断为ANCA 相关性血管炎,遂行连续性血液净化、激素(甲强龙80 mg × 3 d+甲强龙500 mg × 3 d+甲强龙80 mg × 5 d)、环磷酰胺(200 mg × 5 d)及抗感染等治疗。患者腹痛、发热症状好转,但仍无尿,转武汉第四医院行维持性血液透析治疗并减停激素及免疫抑制剂。2018 年10 月7 日无明显诱因出现咳嗽、咳血痰,无明显畏寒、发热,无胸闷、气促、呼吸困难,持续2 d 无缓解。自起病以来,患者精神、食欲、睡眠欠佳,大便正常,无尿,体力较前明显下降,近2 个月体重下降5 kg。
既往史:有高血压病史5 年,血压最高达210/105 mmHg,自服硝苯地平控释片,血压控制可。手术史:该院2017 年1 月12 日行左前臂动静脉造瘘术;2017 年2 月20 日行右颈部半永久透析用导管拔除术;2017 年11 月13 日因左前臂动静脉内瘘闭塞行手术重建。无吸烟史。家族史无特殊。
入院查体:体温:36.5 ℃,脉搏:78 次/min,呼吸:19 次/min,血压:170/85 mmHg,神志清楚,体型消瘦,全身体表淋巴结未触及,双肺呼吸音粗,中下肺可闻及细湿啰音,心律齐,未闻及病理性杂音,腹软,无压痛及反跳痛,肝脾肋下未触及,左前臂动静脉内瘘可闻及血管杂音,双下肢无水肿。
实验室检查:2018 年10 月10 日血常规:白细胞计数6.31 × 109/L,中性粒细胞计数4.99 ×109/L,淋巴细胞计数0.70×109/L(↓),血小板计数159×109/L,红细胞计数3.13×1012/L(↓),血红蛋白90 g/L(↓);肝肾功能:钾3.40 mmol/L(↓),钠143.0 mmol/L,氯97.0 mmol/L(↓),总钙2.61 mmol/L(↑),镁1.13 mmol/L(↑),磷0.90 mmol/L,尿素氮20.23 mmol/L(↑),血肌酐561.8 μmol/L(↑),谷丙转氨酶6 U/L(↓),谷草转氨酶12 U/L(↓),白蛋白37.9 g/L(↓);炎症及补体:红细胞沉降率31 mm/h(↑),类风湿因子78.50 IU/mL(↑),C 反应蛋白46.50 mg/L(↑),补体C3 0.99 g/L,免疫球蛋白IgG 17.30 g/L(↑),淋巴细胞免疫分析:CD4/CD8 比值2.42(↑);隐血试验阳性(+);降钙素原0.54 ng/mL(↑),血脂、心肌酶谱、凝血五项、粪便常规未见明显异常。ANCA 谱:(IIF)抗中性粒细胞抗体核周1∶10 阳性(+),(ELISA)抗髓过氧化物酶抗体阳性(+);抗肾小球基底膜抗体阴性(-)。痰培养阴性(-);结核涂片检查阴性(-),T-spot阴性(-);真菌D-葡聚糖检测:真菌(1-3)-β-D 葡聚糖12.60 pg/mL;CMV-IgM 测定(化学发光法):巨细胞病毒IgM 抗体0.63 COI,CMV-IgG 测定(化学发光法):巨细胞病毒IgG 抗体65.75 IU/mL。
2018 年10 月10 日胸部CT 提示:双肺多发斑片状高密度影,双侧胸腔见少许弧形液体密度影,双下肺膨胀不全。心脏增大,心包见大量液性低密度影(见图1)。
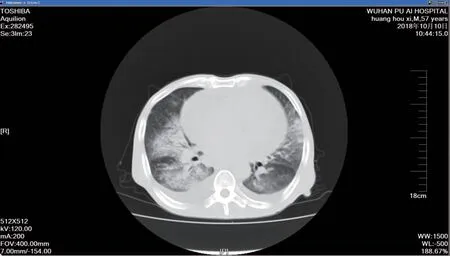
图1 2018 年10 月10 日胸部CT:双肺多发斑片状高密度影Fig.1 Chest CT on October 10,2018: multiple patchy high-density shadows in both lungs
诊断:(1)主要症状为咳血痰;(2)体格检查:双肺呼吸音粗,可闻及细湿啰音;(3)实验室检查:血常规提示白细胞计数及中性粒细胞计数正常;肝肾功能示C 反应蛋白及红细胞沉降率升高;ANCA 谱:(IIF)抗中性粒细胞抗体核周1∶10 阳性(+),(ELISA)抗髓过氧化物酶抗体阳性(+);抗肾小球基底膜抗体阴性(-);(4)胸部CT 提示双肺肺出血;(5)既往有ANCA 相关性血管炎病史。考虑诊断ANCA 相关性血管炎维持性血液透析再发肺出血。
鉴别诊断:(1)肺部感染:①细菌感染,多表现为咳嗽、咳痰,可有发热、气促症状,查体可闻及肺部干湿性啰音,血常规提示血象异常,降钙素原明显增高,胸部CT 示磨玻璃片状影。本病例无发热,白细胞计数、中性粒细胞计数正常,降钙素原仅轻度升高,痰培养阴性(-),胸部CT表现为双肺弥漫性高密度影,细菌感染性肺炎可能性小;②肺结核,多表现为午后潮热、盗汗,咳嗽、咳痰中带血、咯血等,结核涂片阳性(+),胸部CT 示上叶尖后段、下叶背段和后基底段的斑片状阴影或空洞。本病例症状不完全符合,T-spot 阴性(-),结核涂片检查阴性(-),胸部CT不支持肺结核;③真菌感染,可有咳嗽、咳痰,真菌(1-3)-β-D 葡聚糖抗原阳性(+)、半乳甘露聚糖抗原阳性(+),痰培养可见真菌,胸部CT 示浸润影或空洞。本病例真菌D-葡聚糖检测:真菌(1-3)-β-D 葡聚糖12.60 pg/mL,但痰培养及胸部CT 不支持真菌感染;④巨细胞病毒感染,可表现为咳嗽、呼吸困难,唾液脱落细胞镜检有巨大细胞及嗜酸性包涵体,IgM 阳性(+),IgG抗体4 倍以上,胸部CT 示斑片状高密度模糊影。本病例CMV-IgM 测定(化学发光法):巨细胞病毒IgM 抗体0.63 COI,CMV-IgG 测定(化学发光法):巨细胞病毒IgG 抗体65.75 IU/mL,胸部CT 不支持巨细胞病毒感染。(2)肺水肿:心源性肺水肿多继发于急性左心衰,轻度可表现为咳嗽、胸闷,重度为阵发性呼吸困难、端坐呼吸、咳粉红色泡沫痰、BNP 明显增高等,查体两肺满布湿啰音及哮鸣音,影像表现为双肺出现对称的蝴蝶征。非心源性肺水肿包括感染性肺水肿、肺复张后肺水肿、神经源性肺水肿等。本例患者虽有痰中带血,但无明显端坐呼吸症状,胸部CT 不符合典型肺水肿征象,故排除诊断。
治疗:入院后予以抗炎(甲泼尼龙80 mg qd × 5 d(2018 年10 月11 日-2018 年10 月15 日)+甲泼尼龙40 mg qd × 6 d(2018 年10 月16 日-2018 年10 月21 日)+环磷酰胺200 mg qd × 4 d(2018年10 月18 日-2018 年10 月21 日))、血液透析、控制血压(硝苯地平片30 mg qd、培哚普利叔丁胺片8 mg qd、酒石酸美托洛尔12.5 mg bid)、抗感染(盐酸莫西沙星氯化钠注射液250 mL qd)及对症支持治疗,2018 年10 月21 日胸部CT 提示双肺多发斑片状高密度影较前明显好转(见图2)。

图2 2018 年10 月21 日胸部CT:双肺散在小斑片状影Fig.2 Chest CT on October 21,2018:small patchy shadows scattered in both lungs
治疗结果:2018 年10 月22 日出院口服甲泼尼龙32 mg qd,此后每月减量1 片。环磷酰胺冲击方案如下:2018 年11 月1 g、2018 年12 月0.4 g、2019 年1 月0.6 g、2019 年3 月0.4 g、2019 年4 月1 g、2019 年5 月患者胸部CT 提示轻度感染,暂不予环磷酰胺。2019 年6 月11 日复查抗中性粒细胞抗体筛查+确证试验抗MPO-ANCA 抗体转阴(-),抗GBM 抗体持续阴性(-),口服甲泼尼龙以8 mg qd 维持治疗,予环磷酰胺1 g,累积5.2 g。2020 年11 月26 日复查胸部CT 提示肺部未见明显异常(见图3),口服甲泼尼龙以4 mg qd 维持治疗至今。
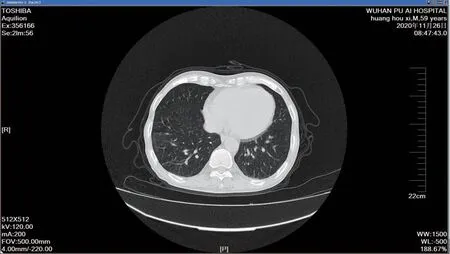
图3 2020 年11 月26 日胸部CT:未见斑片状高密度影Fig.3 Chest CT on November 26,2020:no patchy high-density shadow
随访:随访8 个月,血常规指标恢复正常(见图4 和图5),抗MPO-ANCA 抗体转阴(-),抗GBM 抗体持续阴性(-)(见表1),患者未再咳嗽、咳痰,未再发肺出血。

表1 住院期间患者抗MPO-ANCA 抗体、抗GBM 抗体变化Tab.1 Changes of anti-MPO-ANCA antibody and anti-GBM antibody during hospitalization
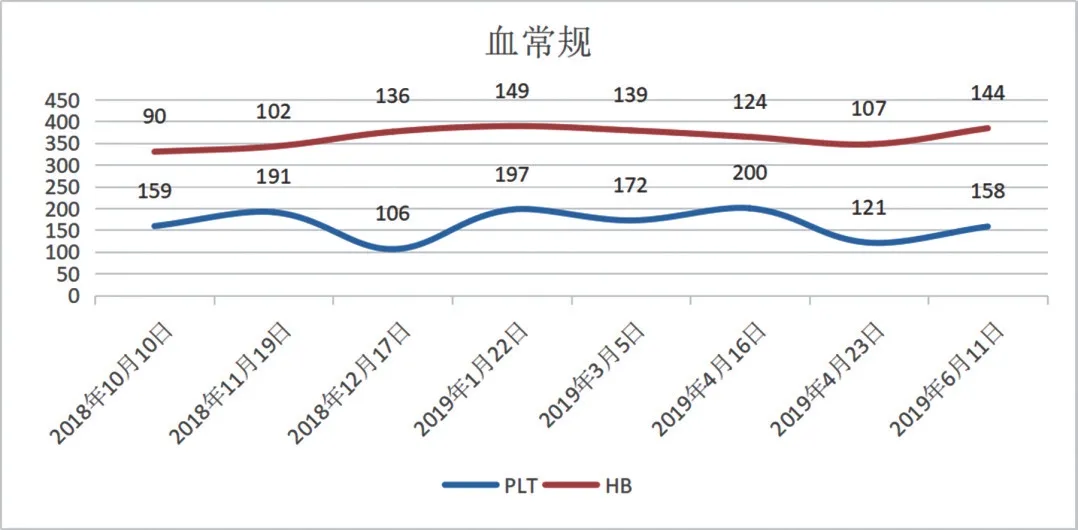
图4 血常规变化Fig.4 Changes in blood routine examination
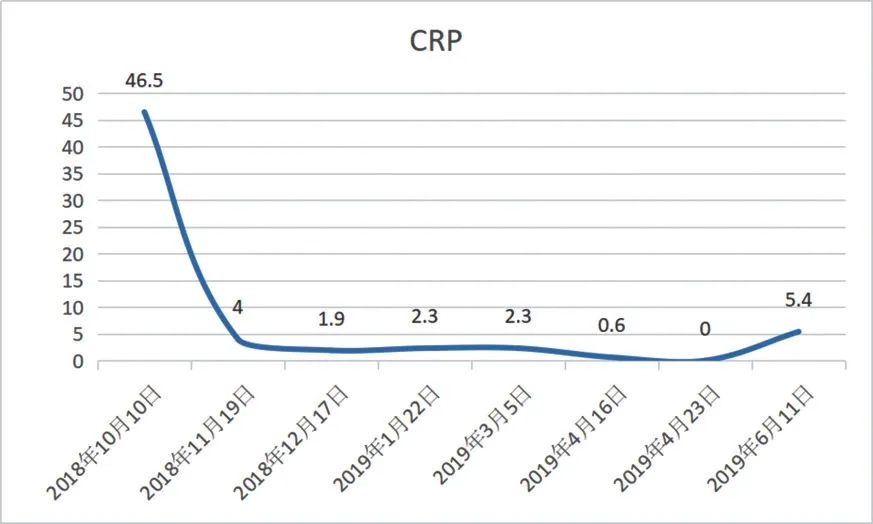
图5 C 反应蛋白变化Fig.5 Change of C-reactive protein
2 讨论
抗中性粒细胞胞浆抗体(ANCA)相关血管炎(AAV)是一组以中小型血管炎症和纤维素样坏死为特征的系统性疾病。可分为肉芽肿合并多血管炎(granulomatosis with polyangioitis,GPA)、显微镜下多发性血管炎(microscopic multiple vasculitis,MPA)和嗜酸性肉芽肿合并多血管炎(eosinophilic Granulomatosis with polyangioitis,EGPA)[3]。其中,MPA 以影响中小血管的少血细胞免疫坏死性血管炎为特征,肺是重要的受累器官之一,主要包括弥漫性肺泡出血和间质性肺疾病(interstitial lung disease,ILD)。DAH 在抗MPO-ANCA 阳性的患者中多见,可发生在糖皮质激素和免疫抑制剂治疗期间[4]。
本例患者诊治过程中,肾脏病原发诊断明确,停用激素及免疫抑制剂并规律维持性血液透析治疗一年零十个月,病情尚平稳。但于此次住院中出现咳血痰,结合抗体、实验室检查、胸部CT、药物疗效等临床证据,排除肺部感染、心衰所致肺水肿、肿瘤等疾病,诊断考虑为ANCA 相关性血管炎维持性血液透析再发弥漫性肺泡出血。
AAV 患者未进入透析治疗前常规治疗方案大致分三类:(1)支持治疗,包括输血、纠正凝血障碍和呼吸机支持;(2)病因治疗,包括糖皮质激素联合环磷酰胺或利妥昔单抗治疗以抑制炎症反应,血液透析、血浆置换以去除自身抗体,以及抗病毒或抗生素治疗感染相关的肺出血;(3)对症治疗,快速有效的止血等[5]。
AAV 患者进入透析治疗后是否应该接受维持激素联合免疫抑制治疗尚存在争议。AAV 患者进入透析治疗后复发率低,但感染及心血管疾病发生率较高[2],应基于激素联合免疫抑制风险与复发相对风险的双评估上作出决定。Jefferson 等[6]的一项研究表明,激素联合免疫抑制可增加严重感染、恶性肿瘤、骨质减少和血液毒性的风险导致患者死亡,并且,由于维持性血液透析可导致自身免疫过程的相对静止,透析患者的感染率较非透析患者更高,因而维持免疫抑制治疗风险也是较高的。如果患者无肾外表现,特别是MPO-ANCA 型,可考虑6 个月后停用免疫抑制。因而,建议进入透析后维持免疫抑制治疗仅限用于有AAV 伴有积极肾外表现的临床证据的患者。本例病例发病初期未见明显肾外受累证据,故而进入维持性透析治疗后停用了激素及免疫抑制治疗,但患者在透析治疗一年零十个月后突然发生弥漫性肺泡出血,极其罕见。
维持性透析患者血管炎复发累及肺部早期症状可能仅表现为咳嗽咳痰,容易被误诊为肺部感染,导致治疗延误,更快发展为弥漫性肺泡出血[7]。临床上目前仍然缺乏早期识别AAV 透析患者弥漫性肺泡出血的敏感指标。临床上常规需要监测ANCA 及抗体滴度、红细胞沉降率、C 反应蛋白及胸部CT 检查。然而,Yen 等[8]的研究表明,ANCA 滴度高与肾血管炎相关,而与肾外血管炎的严重程度相关性较低。目前,维持性血液透析患者的ANCA 抗体滴度对于监测AAV 复发的作用尚存在争议。如果患者出现不典型的临床症状及肺部影像结果时,可以行纤维支气管镜肺泡灌洗术(bronchofibroscope alveolar lavage,BAL)[9],必要时送NGS 检查尽早明确诊断。
复发AAV 的最佳治疗方案为免疫抑制剂和糖皮质激素[10]。如果患者在透析开始后有血管炎复发,建议仅给予低剂量糖皮质激素及低免疫抑制方案,以减少潜在致命感染的风险[11]。而如本例病例再发弥漫性肺泡出血的情况,建议大剂量激素脉冲(甲泼尼龙500 mg/d 静滴3 d 后口服泼尼松0.6~ 0.8 mg/kg/d,2~ 4 周后逐步减量,3 个月后减量至7.5~ 10 mg/d)联合环磷酰胺或利妥昔单抗,血浆置换视情况而定[12]。在呼吸衰竭伴低氧血症时,可使用有创机械通气。更严重的情况下,可行体外膜氧合(extracorporeal membrane oxygenation,ECMO)辅助治疗[13]。治疗必须个体化,同时考虑到透析患者AAV 复发的严重程度、患者的一般情况和感染风险,酌情使用激素联合免疫抑制剂及治疗时间。本例病例治疗方案为糖皮质激素联合环磷酰胺,糖皮质激素逐步减量至4 mg qd 维持用药,治疗效果尚可,患者目前未再复发弥漫性肺泡出血。
综上所述,对于维持性透析AAV 再发弥漫性肺泡出血的病例,需排除肺部感染、肺水肿等,结合ANCA 抗体滴度增高、红细胞沉降率增快、C 反应蛋白增高及胸部CT 异常、纤维支气管镜肺泡灌洗及药物疗效等临床证据尽早明确诊断,并给予大剂量激素脉冲联合环磷酰胺或利妥昔单抗,视情况行血浆置换治疗,以免贻误病情,导致严重后果。

