基于特征图谱结合化学计量学和一测多评法的薤白质量评价
孟俊华,刘 媛,占慧慧,唐 宏,崔培梧*
基于特征图谱结合化学计量学和一测多评法的薤白质量评价
孟俊华1, 2, 3,刘 媛1, 2, 3,占慧慧1, 2, 3,唐 宏1, 2, 3,崔培梧1, 2, 3*
1. 湖南中医药大学药学院,湖南 长沙 410208 2. 国家中医药管理局中药药性与药效三级科研实验室,湖南 长沙 410208 3. 湖南中医药大学菌物药研究室,湖南 长沙 410208
建立薤白特征图谱分析方法,并结合化学计量学和一测多评法(quantitative analysis of multi-components with a single-marker,QAMS)开展薤白质量控制研究。采用HPLC方法,Agilent Eclipse Plus C18色谱柱(250 mm×4.6 mm,5 µm),以甲醇-超纯水溶液为流动相梯度洗脱,体积流量1.0 mL/min,柱温30 ℃,检测波长261 nm,进样量20 μL,建立薤白特征图谱,接着采用聚类分析(clustering analysis,CA)、主成分分析(principal component analysis,PCA)、正交偏最小二乘法-判别分析(orthogonal partial least square method-discriminant analysis,OPLS-DA)对不同批次薤白饮片进行化学模式识别分析,实现数据集的可视化。同时以腺苷为内参物建立QAMS法,建立内参物与胞苷、尿苷、鸟苷的相对校正因子,采用外标法(external standard method,ESM)与QAMS法分别测定12批次薤白样品中胞苷、尿苷、鸟苷、腺苷4种核苷类成分的含量,以验证QAMS法结果的可靠性。建立的HPLC特征图谱方法较全面地反映了薤白药材的化学成分,分析方法专属性强,准确可靠;化学计量学分析结果基本一致;并通过OPLS-DA找出了3种可能的标志性成分;QAMS法与外标法测定结果之间无显著差异。建立的薤白特征图谱分析方法、化学计量学方法、多指标成分QAMS法可为薤白和其他植物药的质量控制与评价提供参考。
薤白;特征图谱;化学计量学;胞苷;尿苷;鸟苷;腺苷;一测多评;外标法
薤白为百合科(Liliaceae)葱属L.植物小根葱Bge.或薤G. Don.的干燥鳞茎,别名野薤、野葱、薤白头[1],我国除新疆、青海外各省区均产,俄罗斯、朝鲜和日本也有分布[2]。薤白在临床广泛用于治疗胸痹、心绞痛、哮喘等疾病,皂苷类化合物是其主要药效成分[3]。国家卫生部于20世纪90年代将薤白列入药食同源植物名录[4],因此薤白也可用于功能性食品的开发,具有广泛的应用前景。薤白主要含有甾体皂苷、挥发油、苯丙素类化合物、氨基酸、多糖与脂肪酸等多种生物活性成分[5-7],具有抗肿瘤[8]、调血脂和抗动脉粥样硬化[9]、抗痉挛[10]、抗氧化[11]等活性。近年来,薤白的化学成分和药理作用已经得到深入的研究,但其质量控制研究仍需加强,《中国药典》2020年版也暂无薤白有效成分[含量测定]项标准[1],而中药又有多成分多靶点的特点,且其品质易受产地和加工方式影响。因此,单一的成分难以全面评价中药质量的优劣,通过多指标同步质量控制反映中药质量已成为当前中药质量评价领域的共识。
化学计量学是通过统计学或数学方法结合计算机科学将对化学体系的测量值与体系的状态之间建立联系[12]。而一测多评法(quantitative analysis of multi-components le-marker,QAMS)是采用一种相对易得、价廉的内参比物质对照品,实现对多个成分的同时测定[13]。特征图谱结合化学计量学和一测多评法可以根据多变量数值分析把同类与异类中药材区别开实现数据集的可视化[14]。本研究通过上述方法对薤白药材进行分类和质量评价,为薤白的鉴定和质量评价提供参考。
1 仪器与材料
1.1 仪器
Agilent 1200高效液相色谱仪;皖仪3100型高效液相色谱仪、EX224ZH型万分之一电子分析天平(OHAUS公司);JS-40型超声波清洗仪(常州鸿泽实验科技有限公司),Agilent Eclipse Plus C18色谱柱(250 mm×4.6 mm,5 µm),Welch Ultimate XB-C18色谱柱(250 mm×4.6 mm,5 µm),Agilent 5 TC-C18(2)色谱柱(250 mm×4.6 mm,5 µm)、Agilent XDB C18色谱柱(250 mm×4.6 mm,5 µm)、Synergi Hydro-RT C18色谱柱(250 mm×4.6 mm,5 µm)。
1.2 材料
对照品胞苷(批号T16J7X9000)、尿苷(批号M02HS176753)、鸟苷(批号D25GS172600)购自上海源叶生物科技有限公司,质量分数均为99%;腺苷(批号RP210402,质量分数为99.85%)购自成都麦德生物科技有限公司;乙腈为色谱纯,水为怡宝纯净水,其余试剂为分析纯。薤白样品来源见表1,由湖南中医药大学药学院中药资源中心王智副教授鉴定为薤G. Don.和小根葱Bge.。
2 方法与结果
2.1 色谱方法
色谱柱为 Agilent Eclipse Plus C18柱(250 mm×4.6 mm,5 μm);流动相为甲醇(A)-超纯水(B),梯度洗脱:0~17 min,0.5% A;17~18 min,0.5%~5% A;18~30 min,5%~9% A;30~32 min,9% A;32~42 min,9%~11% A;42~45 min,11%~ 0.5% A;45~50 min,0.5% A;体积流量1.0 mL/min;检测波长261 nm;柱温30 ℃;进样量20 μL。色谱图如图1所示。
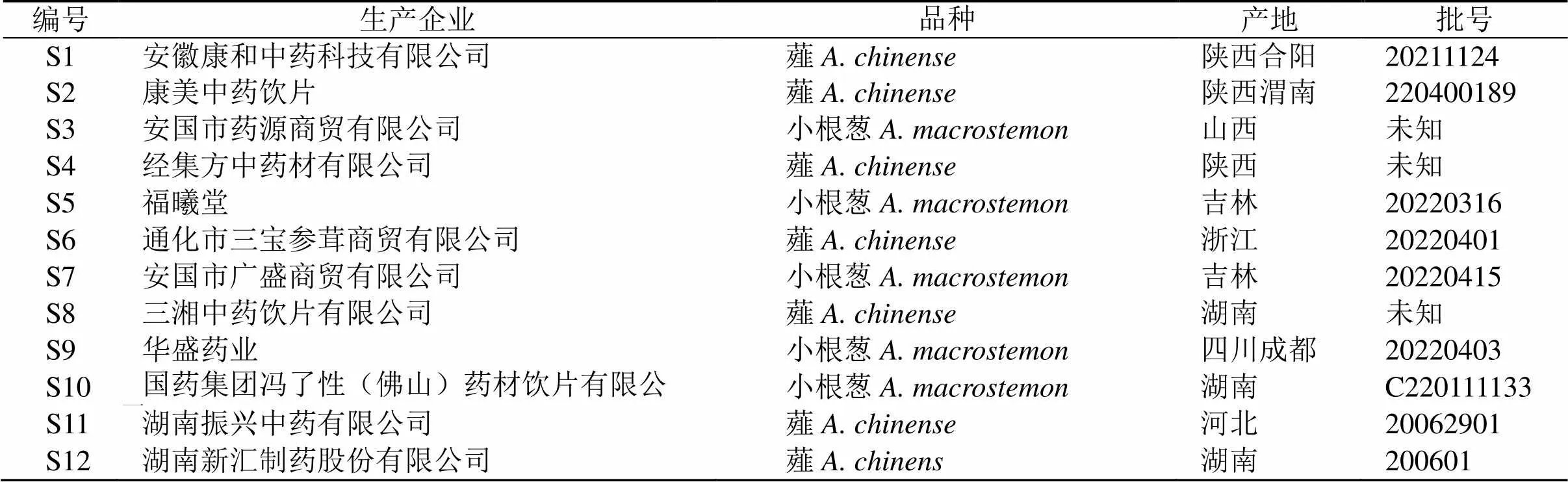
表1 样品信息
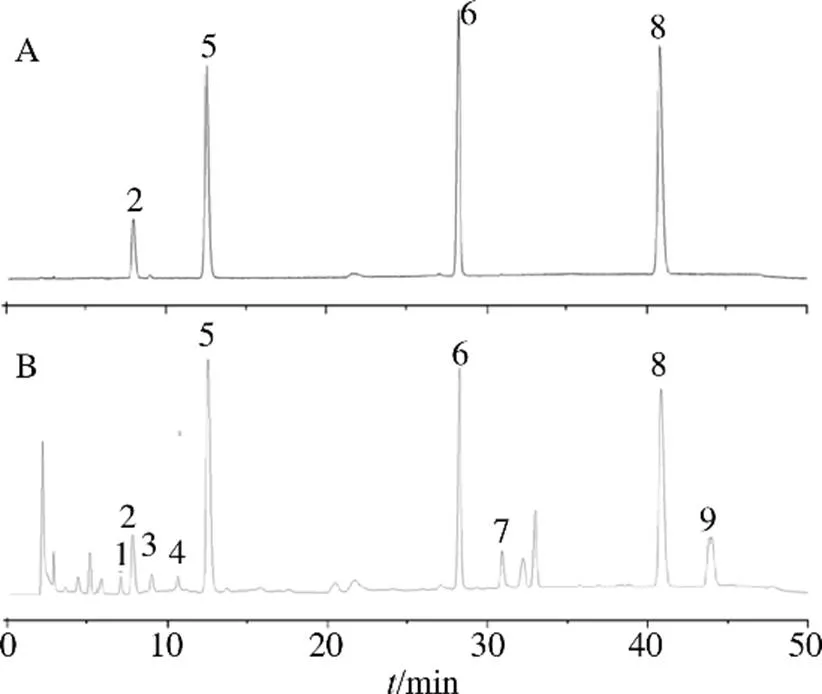
2-胞嘧啶核苷 5-尿嘧啶核苷 6-鸟嘌呤核苷 8-腺嘌呤核苷
2.2 对照品储备液的制备
精密称取对照品适量,加10%甲醇溶解制成含胞苷、尿苷、鸟苷、腺苷质量浓度分别为5.016、14.884、15.120、14.960 μg/mL的混合对照品溶液用作外标法定量和色谱峰指认。另精密称取适量对照品加10%甲醇溶解制成含胞苷、尿苷、鸟苷、腺苷质量浓度分别为10.20、34.20、35.40、35.00 μg/mL的混合对照品溶液STD1,后将STD1用10%甲醇分别稀释至其0.8、0.6、0.4、0.2、0.1倍的混合对照品溶液STD2、STD3、STD4、STD5、STD6用作方法学线性考察[15]。置于4 ℃冰箱,备用。
2.3 供试品溶液的制备
取薤白样品粉末1.0 g(过60目筛),精密称定,置于100 mL干燥具塞锥形瓶中,加10%甲醇25 mL,密塞,称定质量,超声(功率240 W,频率40 kHz)处理30 min,放冷,用10%甲醇补足减失的质量,滤过,经0.22 µm微孔滤膜过滤,取续滤液,即得。
2.4 方法学考察
2.4.1 专属性考察 分别精密吸取胞苷、尿苷、鸟苷和腺苷对照品溶液及混合对照品溶液、薤白对供试品溶液,按“2.1”项下色谱条件测定。结果表明各成分保留时间基本一致,最大紫外吸收波长高度吻合、各色谱峰分离度均大于1.5,表明方法专属性良好。
2.4.2 精密度试验 精密吸取同一供试品溶液S1,按“2.1”项下色谱条件连续进样6次,每次20 μL,记录峰面积,计算RSD值。结果显示1~9号峰峰面积RSD分别为1.87%、1.11%、1.54%、1.08%、0.49%、0.73%、0.86%、0.43%、1.01%,表明仪器精密度良好。
2.4.3 重复性试验 精密称取同一批号样品(S1),按“2.3”项下方法平行制备6份供试品溶液,按“2.1”项下色谱条件进样分析,记录色谱图,以腺苷峰为参照,记录各色谱峰相对保留时间与相对峰面积。结果显示1~9号峰相对保留时间RSD分别为0.35%、0.17%、0.46%、0.68%、0.75%、0.22%、0.31%、0.07%、0.18%,相对峰面积RSD分别为1.07%、1.44%、0.82%、1.15%、1.34%、0.54%、0.63%、0.70%、0.59%,表明方法重复性良好。
2.4.4 稳定性试验 精密吸取同一供试品溶液(S1)适量,分别于0、2、4、8、12、18、24 h以“2.1”项下色谱条件进样分析,记录各个测定时间点的峰面积,计算RSD值。结果显示1~9号峰峰面积RSD分别为1.32%、1.49%、1.63%、0.98%、1.01%、0.69%、0.75、0.63%、0.47%,表明供试品溶液在24 h内稳定。
2.5 特征图谱的分析及评价
2.5.1 特征图谱的建立及共有峰归属 12批薤白样品分别按“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件进样分析,将色谱信息导入中药色谱指纹图谱相似度软件进行Mark峰匹配(版本:2012.130723),共确定9个共有峰,共有峰见图2。其中共有峰中8号峰(腺苷)分离度较好,响应较高,故以8号峰(腺苷)为参照峰(S峰)。经与对照品色谱峰保留时间相比对和DAD光谱分析,共指认出4个特征峰,分别为1号峰胞苷、5号峰尿苷、6号鸟苷、8号峰腺苷。
2.5.2 相似度评价 以薤白12批样品9个共有峰峰面积为变量,导入Origin Pro 2021软件进行样品相关性分析,并绘制相关系数图。图3中,红色表示正相关,蓝色表示负相关,圈的朝向代表正负相关性,圈越大越圆相关系数绝对值越小,值代表样品相关性显著程度,从根据9个共有峰峰面积数据绘制的相关系数图来看样品S1~S12全部呈现正相关,整体相似度在0.80~1.00,有一定的波动情况,样品S3、S11、S12的相似度相对较低,表明不同产地不同批次的薤白样品质量存在着差异。2.5.3 主成分分析(principal component analysis,PCA) PCA分析是通过降维的思想在损失很少信息的前提下将多个互相关联的变量转化成少数几个互不相关的综合指标的统计学方法,可以用较少的变量去解释原始多变量中的大多数变异[16]。利用12批次薤白样品的9个共有峰峰面积为变量,结果导入SPSS 26.0软件,计算主成分特征值、方差贡献率及因子载荷矩阵。结果如表2、3所示。第1主成分的特征根为4.321,能够解释的总变异为58.552%,第2主成分的特征根为1.816,能够解释的总变异为16.130%,第3主成分的特征根为1.740,能够解释12.844%的变异,因此提取主成分3个,累积贡献率可达87.526%,可代表薤白样品87.526%的信息。以绝对值为依据,第1主成分的信息主要来自于胞苷、尿苷、鸟苷、腺苷、9号、7号、1号峰峰面积、第2主成分的信息主要来自于4号峰峰面积、第3主成分的信息主要来自于3号峰峰面积。将12批次薤白样品的9个共有峰峰面积为变量导入SIMCA 14.1软件建模,得到PCA得分图(图5),PCA得分图表明以第1主成分为依据,t[1]轴将12批样品分成2部分,表明12批次薤白样品质量存在着较大差异。
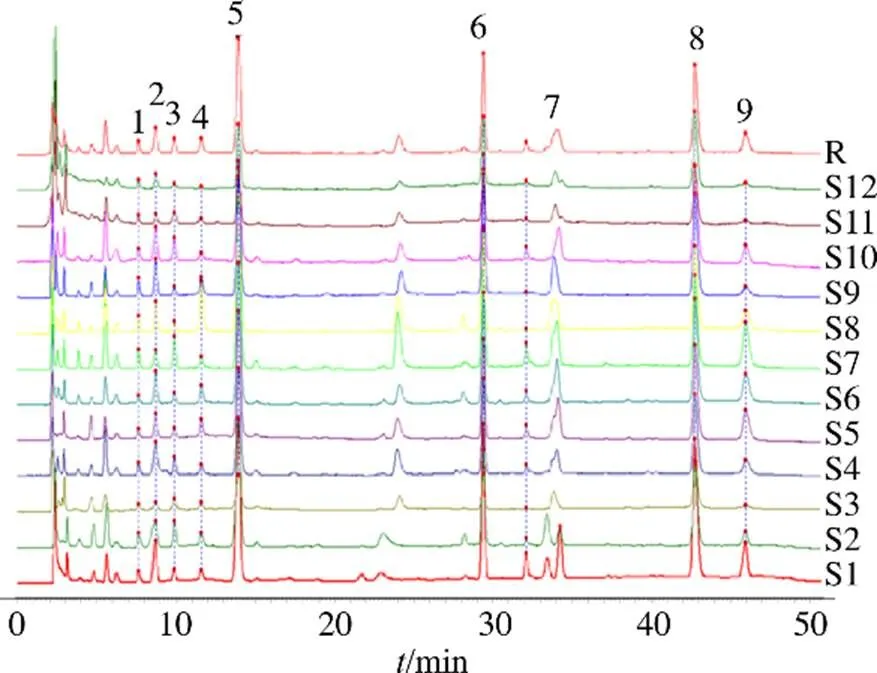
图2 薤白HPLC特征图谱共有峰

表2 PCA特征值及方差贡献率

表3 PCA因子载荷矩阵
2.5.4 正交偏最小二乘-判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)分析 因为PCA为一种无监督的模型验证方法,并不能够对所有样本加以区分以使得每个样本对模型都有相同的贡献。所以,当样本组间差异大而组内差异较小时,PCA分析难以区分和发现组内差异。因此有必要采用一种有监督模式的OPLS-DA分析[17]。
为进一步寻找导致薤白质量差异的标志成分,本研究将12批薤白中9个共有峰的相对峰面积导入SIMCA 14.1软件,以获得OPLS-DA分析模型,见图5。结果显示,在模型中解释能力参数2、2分别为0.940和0.965,预测能力参数2(cum)为0.903,表明该模型预测能力较好,12批薤白共有峰峰面积均落在95%置信区间内,将样品根据PCA分析结果分为2类。对所建立的OPLS-DA模型进行200次置换检测,结果显示2=(0.0,0.512),2=(0.0,−2.22),由于2拟合直线轴截距为−2.22,为负数,且最右侧点2和2均高于左侧,所以模型未出现过拟合的情况[18],表明所构建的OPLS-DA模型可以作为判别12批次薤白质量成分的差异。由变量贡献值图(图5)可见,VIP值大于1的有5号峰(尿苷)、6号峰(鸟苷)、8号峰(腺苷),VIP值分别为1.80361、1.305 27、1.201 45。因此,此3种成分可能是薤白的主要差异成分,可作为薤白质量标准[含量测定]项的参考组分[19]。
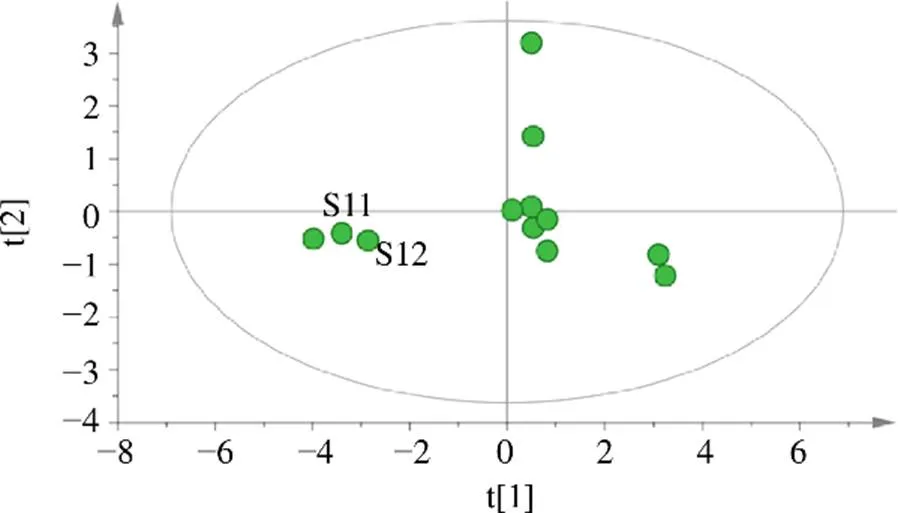
图4 PCA得分图
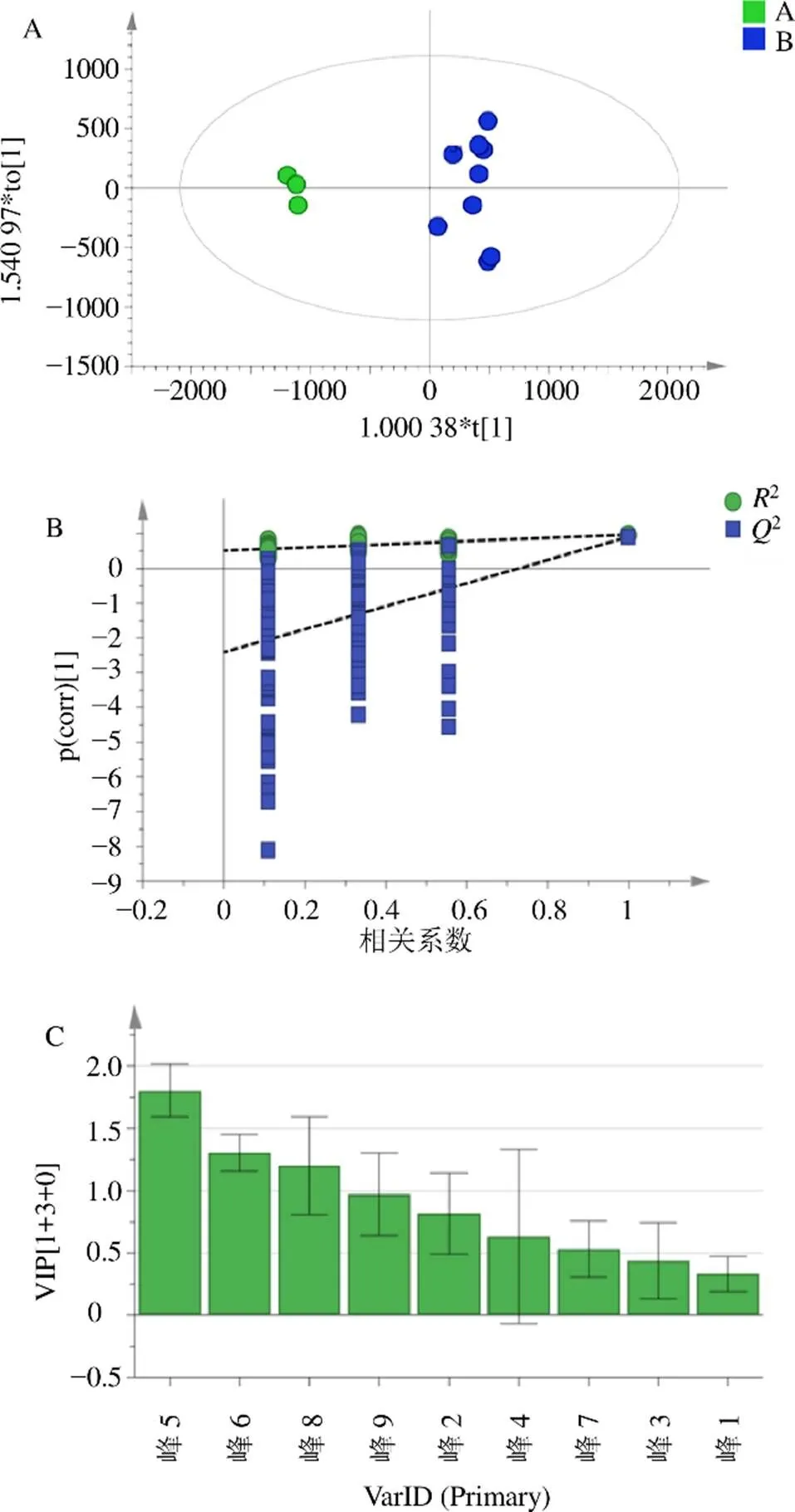
图5 OPLS-DA得分图(A)、置信检测图(B) 和变量贡献值图(C)
2.5.5 聚类分析 将9个薤白HPLC特征图谱共有峰峰面积作为变量导入Origin Pro 2021软件进行聚类分析时,行标签为样本编号,列标签为9个共有峰名称,对行数据进行标准化使得行数据具有可比性,采用平均聚类方法、曼哈顿距离类型,得到图7,由蓝至黄至红的颜色及颜色深浅变化则表示薤白9个特征共有峰的峰面积差异程度。聚类分析将12批样品分为2大类,S3、S11、S12被分为一大类,其余样品则被分为另一大类。由此可知,不同薤白样品的特征成分含量可能存在显著差异,也不可仅仅依靠薤白产地、个头大小等对其质量进行评价,基于特征图谱结合化学计量学和QAMS法的薤白分析方法可为薤白的品质评价提供快速、准确的分析策略。
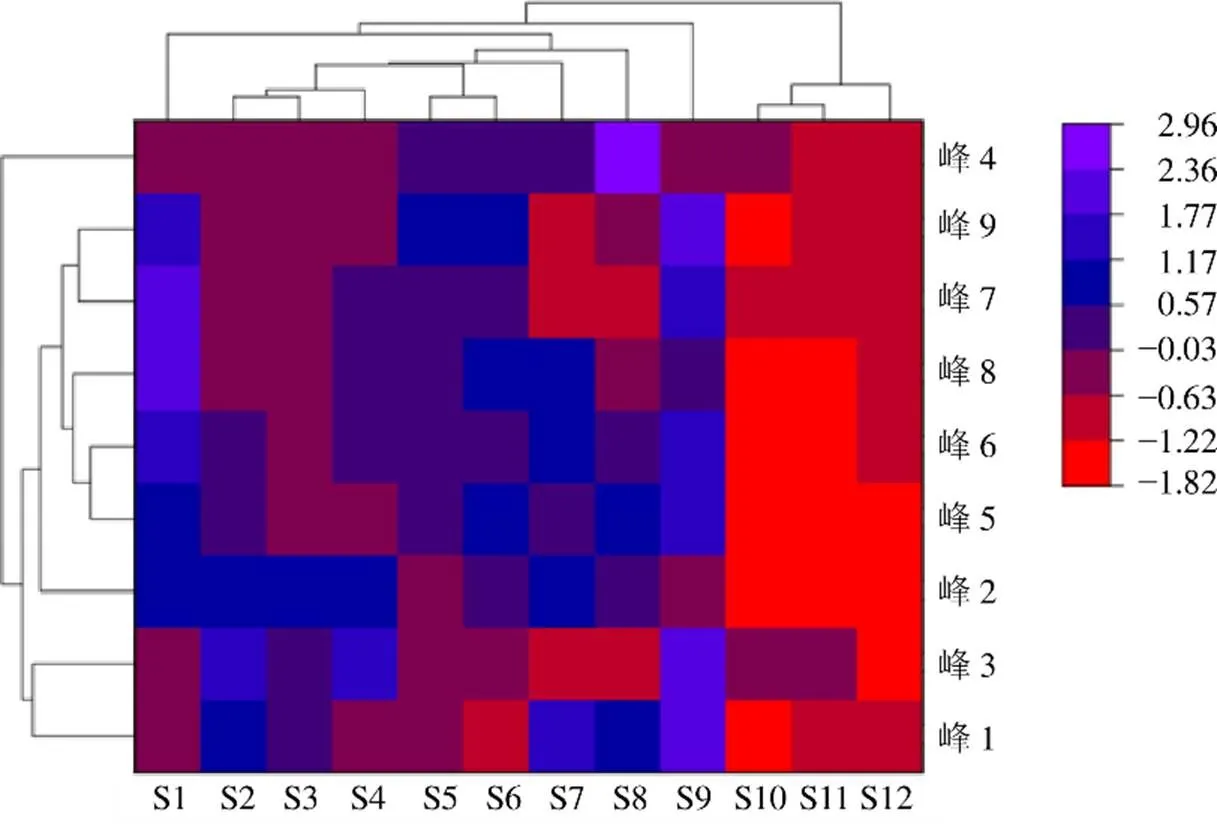
图6 12批次薤白样品聚类分析热图
2.6 多指标成分的含量测定
为了对薤白更好地进行质量评价,在特征图谱的基础上,建立了QAMS方法测定胞苷、尿苷、鸟苷、腺苷4个成分含量。
2.6.1 供试品溶液的制备 同“2.1”项。
2.6.2 对照品溶液的制备 同“2.2”项。
2.6.3 色谱条件 同“2.3”项。
2.6.4 线性关系考察 分别精密吸取混合对照品溶液STD1、STD2、STD3、STD4、STD5、STD6,20 µL,注入高效液相色谱仪,按照“2.1”项色谱条件,测定对照品的色谱峰面积。以各对照品浓度()对相应峰面积()进行回归处理,得4个薤白核苷成分的回归方程及线性范围。结果表明4个薤白核苷成分的线性关系良好,如表4所示。

表4 4个核苷成分的线性回归方程
2.6.5 精密度试验 精密吸取同一供试品溶液S1,按“2.1”项下色谱条件连续进样6次,每次20 μL,记录峰面积,计算RSD值。结果显示胞苷、尿苷、鸟苷、腺苷峰的峰面积RSD分别为1.11%、0.79%、0.73%、0.43%,表明仪器精密度良好。
2.6.6 重复性试验 精密称取同一批号样品(S1),按“2.3”项下方法平行制备6份供试品溶液,按“2.1”项下色谱条件进样分析,记录色谱图,以腺苷峰为参照,记录各色谱峰相对保留时间与相对峰面积。结果显示胞苷、尿苷、鸟苷、腺苷峰相对保留时间RSD分别为0.17%、0.75%、0.22%、0.18%,相对峰面积RSD分别为1.44%、1.34%、0.54%、0.70%,表明方法重复性良好。
2.6.7 稳定性试验 精密吸取同一供试品溶液(S1)适量,分别于0、2、4、8、12、18、24 h以“2.1”项下色谱条件进样分析,记录各个测定时间点的峰面积,计算RSD值。结果显示胞苷、尿苷、鸟苷、腺苷号峰峰面积RSD分别为1.49%、1.01%、0.69%、0.63%,表明供试品溶液在24 h内稳定。
2.6.8 加样回收率试验 精密称取适量已测定含量样品(S1),按“2.3”项方法将称样量减半平行制备6份供试品溶液,并以1︰1的比例加入定量对照品,以“2.1”项下色谱条件进样分析,计算胞苷、尿苷、鸟苷、腺苷的平均加样回收率分别为97.88%、103.4%、99.22%、97.63%,RSD分别为1.60%、0.74%、2.27%、2.01%。
2.6.9 相对校正因子()的测定 在建立的梯度洗脱HPLC色谱条件“2.1”下,取混合对照品溶液分别进样5、10、15、20、25、30、35 µL[20],记录各成分的峰面积,以腺苷为内参物,计算待测成分与内参物的[21]。
=(A/C)/(A/C)
A为待测成分峰面积,C为待测成分量浓度,s为内参物峰面积,s为内参物浓度
结果表明,腺苷作为内参物时其他成分的的RSD均小于3%,见表5。
2.6.10 不同色谱柱对的影响 取“2.2”项混合对照品溶液,进样量为20 µL,采用皖仪3100高效液相色谱仪,分别考察Agilent 5 TC-C18(2)(250 mm×4.6 mm,5 µm)、Agilent XDB C18、Agilent Eclipse Plus C18(250 mm×4.6 mm,5 µm)、Synergi Hydro-RT C18共4根色谱柱对各核苷的影响,结果胞苷、尿苷、鸟苷的RSD依次为0.70%、0.57%、0.77%,表明色谱柱的更换对各成分无显著性影响,见表6。
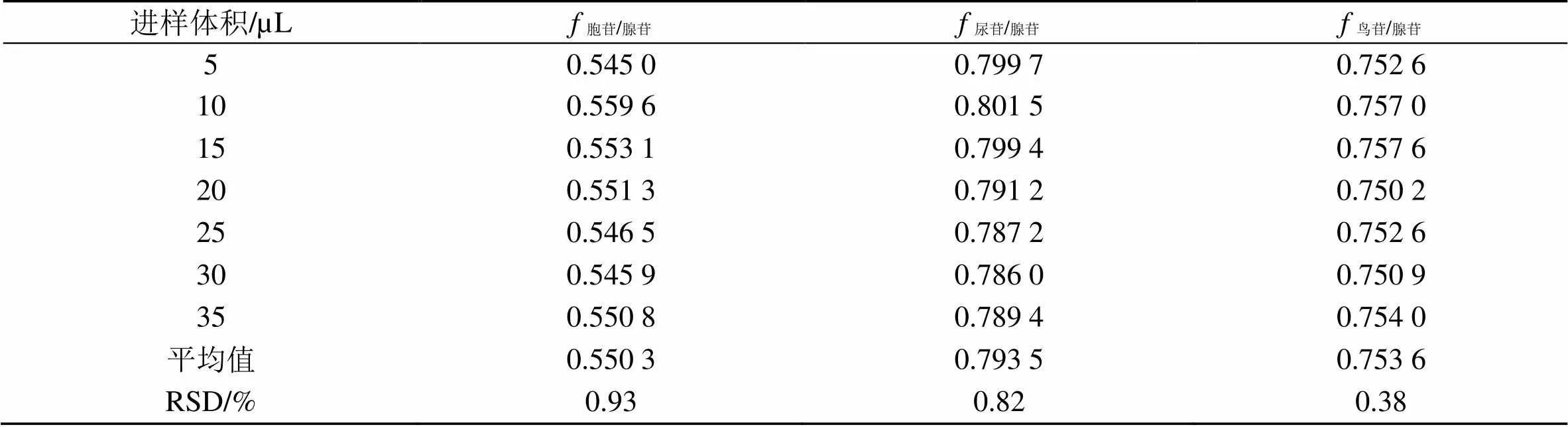
表5 3个待测成分的f值
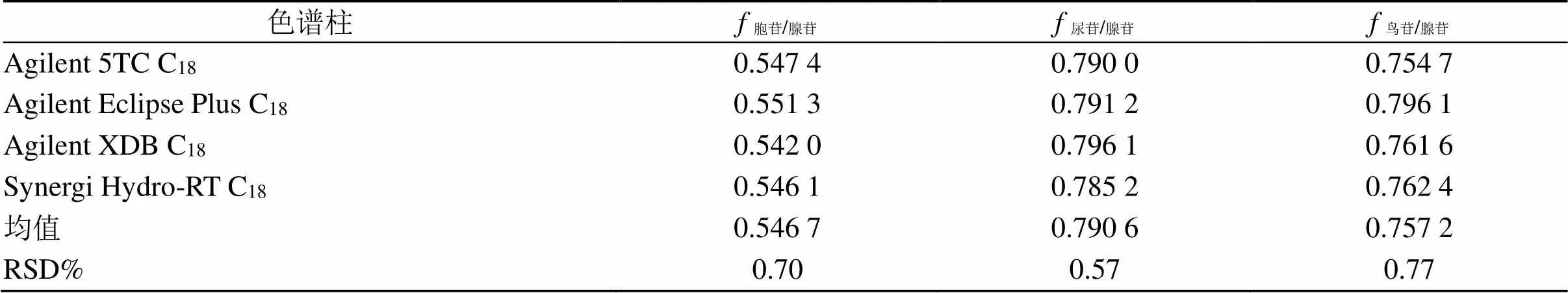
表6 不同色谱柱对f的影响
2.6.11 不同体积流量对的影响 实验采用皖仪3100高效液相色谱仪系统,Agilent Eclipse Plus C18色谱柱,考察不同体积流量(0.8、1.0、1.2 mL/min)对4个核苷值的影响,各成分之间值重复性良好,其RSD均小于3%,表明不同体积流量对各成分值无显著性影响,见表7。
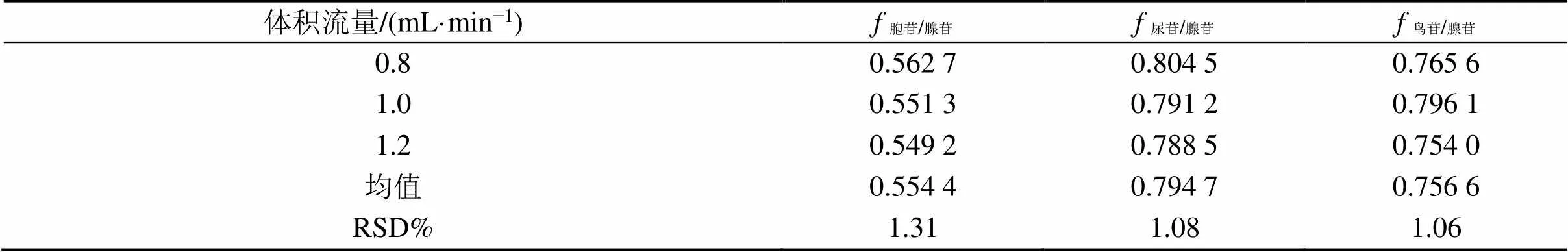
表7 不同体积流量对f值的影响
2.6.12 不同柱温对的影响 实验采用皖仪3100高效液相色谱仪系统,Agilent Eclipse Plus C18色谱柱,分别在不同柱温(25、30、35 ℃)条件下测定核苷的值,结果显示各成分之间的RSD均小于3%,表明柱温对各成分的值无显著性影响,见表8。

表8 不同柱温对f值的影响
2.6.13 不同仪器对的影响 实验分别采用皖仪3100,Agilent 1200高效液相色谱仪系统,Agilent Eclipse Plus C18色谱柱,考察不同仪器对薤白核苷值的影响,结果各成分值的RSD均小于5%,见表9。
2.6.14 待测成分色谱峰定位 色谱峰的准确定位是保证QAMS法应用的前题[22-23],为了仅在采用腺苷为对照品时,能够确认胞苷、尿苷、鸟苷色谱峰的位置,从而通过获得的值同时计算另外3个成分的含量,达到QAMS的目的,故取“2.2”项混合对照品溶液,考察了采用不同仪器(仪器1:皖仪3100,仪器2:Agilent 1200)、不同色谱柱(柱1:Agilent Eclipse Plus C18、柱2:Agilent 5 TC-C18(2)、柱3:Welch Ultimate XB-C18)和不同操作人员(A、B、C)时另外3个薤白核苷成分与腺苷之间的保留时间差和相对保留时间[22, 24]。考察结果表明,另外3个薤白核苷成分和内参物腺苷之间的保留时间差值和相对保留时间值波动较小,其RSD均小于5%(表10、11),因此保留时间差值法和相对保留时间法都可用于色谱峰定位。

表9 不同仪器对f值的影响
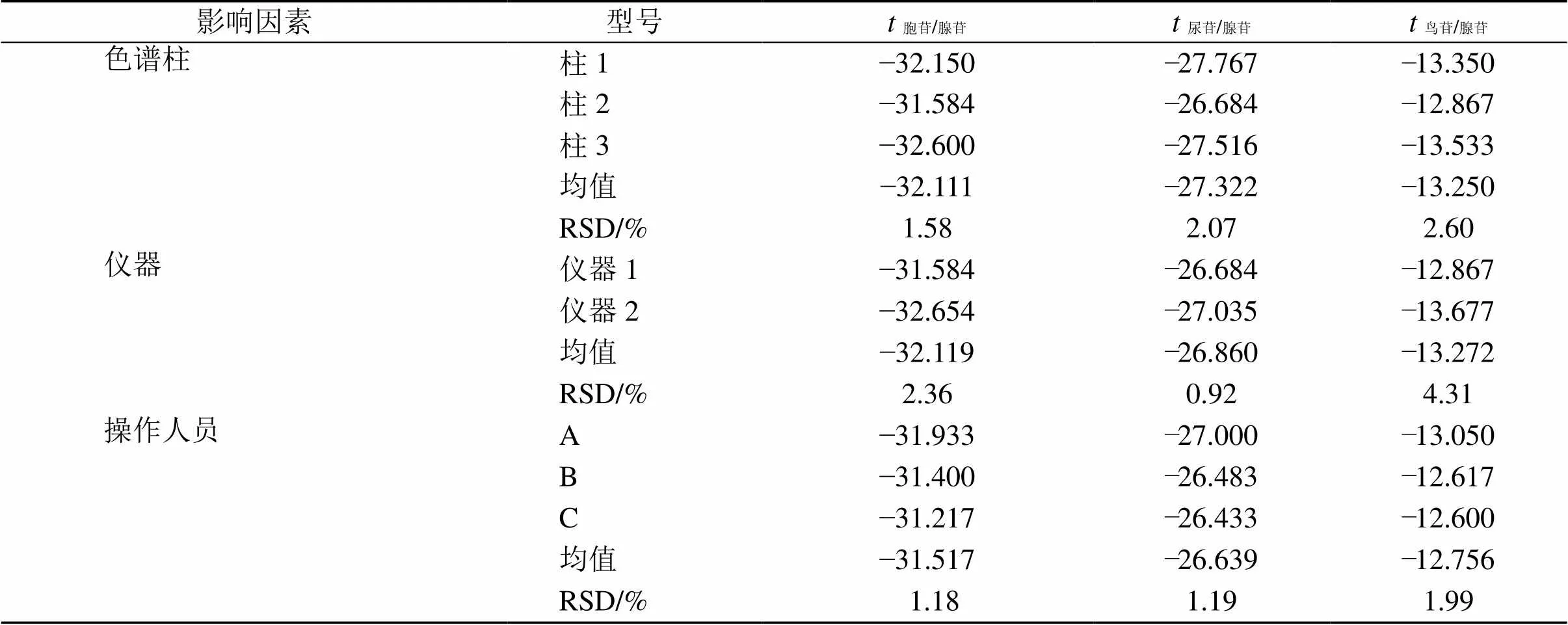
表10 保留时间差值
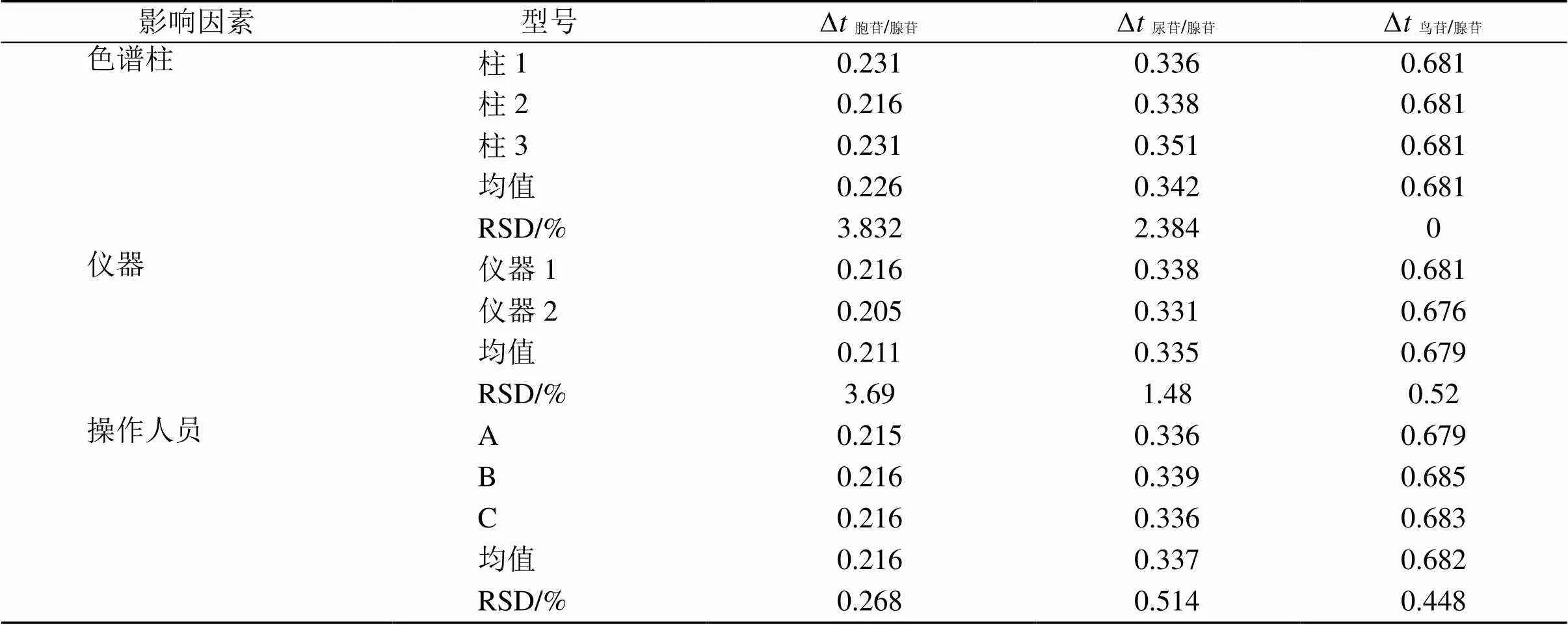
表11 相对保留时间
2.6.15 QAMS法与外标法测定结果比较 12批次薤白样品,采用所建立的HPLC方法,首先通过外标法(ESM)分别计算出薤白样品中胞苷、尿苷、鸟苷、腺苷的含量,然后以腺苷为内参物,并通过测得的,根据QAMS的公式定量计算[22]。
W=(W×A)/(×A)
W为待测成分量,A为待测成分峰面积,s为内参物量,A为内参物峰面积,为待测成分与参照物分别计算出其余3个成分的含量
将ESM实测值与QAMS计算值进行配对检验[25],结果值均>0.05,表明2种方法测定结果之间无显著差异,提示建立的QAMS法有较好的准确性和可行性,见表12。
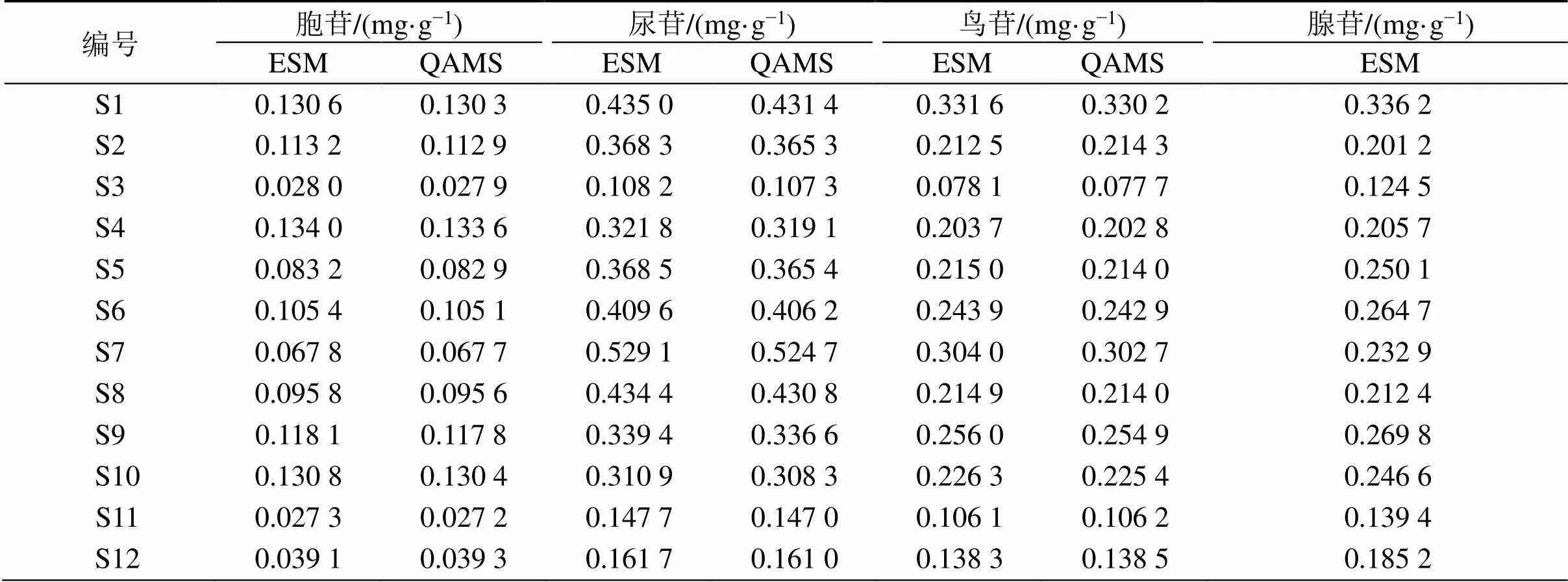
表12 ESM和QAMS测定12批薤白样品中4个核苷的含量
3 讨论
3.1 提取条件和色谱条件的优化
本研究对不同提取溶剂(10%甲醇、25%甲醇、10%乙醇和纯水),不同料液比(1∶50、2∶50、3∶50),不同提取方式时间(加热回流、超声),不同提取时间(20、30、40 min),不同流动相水相组成(纯水、0.1%甲酸、0.1%磷酸)进行考察。最终选定以10%甲醇作为提取溶剂,料液比1∶50,超声30 min钟作为样品的提取方法。考查了Agilent 5 TC-C18(2)色谱柱(250 mm×4.6 mm,5 µm),Welch Ultimate XB-C18色谱柱(250 mm×4.6 mm, 5 µm),Agilent Eclipse Plus C18色谱柱(250mm×4.6 mm,5 µm)色谱柱的分离效果。结果表明,以Agilent Eclipse Plus C18色谱柱分离效果最好。并分别考察了流动相为甲醇-水、甲醇-0.1%甲酸水、甲醇-0.1%磷酸水时供试品溶液HPLC色谱图中6个共有峰成分的分离状况,发现流动相水相为0.1%甲酸水时或者0.1%磷酸水时,谱图基线浮动大,峰形较差,因此选择甲醇-纯水为流动相。
3.2 QAMS法用于薤白多组分含量测定质量控制的合理性
根据QAMS法的指导原则,内标物应选择药材中的有效成分或指标成分,且应与待测成分为同类成分或母核相同,光谱特性基本一致[15],因腺苷为薤白治疗心绞痛、心肌梗塞主要有效成分[26]。且性质相对较稳定,峰形对称度、分离度均良好,因此本研究所建立的QAMS法选择以腺苷作为内参物,结合OPLS-DA分析筛选出的变量VIP值贡献大于1的有尿苷、鸟苷、腺苷,因此,分别以此4类核苷作为薤白多组分含量测定的质控成分,建立了内参物腺苷与待测成分胞苷、尿苷、鸟苷的,构建了能够适用于同时测量薤白多组分的QAMS法,同时以ESM法验证QAMS法的准确性。结果表明QAMS法和ESM法测定薤白中胞苷、尿苷、鸟苷、腺苷4种核苷成分准确度并无明显差异,因此可用QAMS法代替外标法对薤白中4核苷类成分进行含量测定,既降低了实验中对照品、仪器的投入成本,同时保证了检测的灵敏度和准确性,可更加快速准确地对薤白质量做出评价。但是从测量值结果来看,各批次薤白药材4种核苷类成分含量存在一定的批间差异,同时也表明了对于拥有多组分多靶点共同作用的中药质量评价应建立多指标检测的重要性。
综上所述,本研究建立了准确可靠的可鉴别和分析薤白的HPLC方法;并从所建立的特征图谱上指认了9个共有峰,采用SPSS、SIMCA、Origin软件对12批不同产地薤白饮片样品进行相似度分析、PCA、OPLS-DA分析。建立了内参物腺苷与待测成分胞苷、尿苷、腺苷的,通过对12批市售不同产地薤白饮片中4个核苷成分含量的测定,以传统ESM法测定结果验证QAMS测定结果的准确性,为薤白药材的全面质量评价提供了参考。
利益冲突 所有作者均声明不存在利益冲突
[1]中国药典[S]. 一部. 2020: 392.
[2]Ren Y L, Zheng W, Yu Z W,. Determination of fe, ca, mn, cr, ni and cu inby aas [J]., 2012, 3: 87-91.
[3]王荣, 白思慧, 王露露, 等. 薤白的化学成分和药理作用研究进展 [J]. 中国野生植物资源, 2021, 40(10): 73-82.
[4]王苗, 张荣榕, 马馨桐, 等. 中药薤白药食同源功效探析 [J]. 亚太传统医药, 2020, 16(6): 195-201.
[5]王彤. 薤白化学成分的研究 [D]. 长春: 吉林大学, 2017.
[6]杨依然. 薤化学成分与生物活性研究 [D]. 长春: 吉林大学, 2021.
[7]盛艳华, 李萌萌, 郭云龙, 等. 薤白化学成分及其提取分离研究进展 [J]. 特产研究, 2020, 42(5): 61-70.
[8]Baba M, Ohmura M, Kishi N,. Saponins isolated fromG. Don and antitumor-promoting activities of isoliquiritigenin and laxogenin from the same drug [J]., 2000, 23(5): 660-662.
[9]Okuyama T. Studies on the prevention of chemical carcinogens in natural resources (11): antitumor activities of Chinese drug Xiebai and the Kampo containing Xiebai [J]., 1995, 49(3): 261-265.
[10]谭中英, 张锦红, 刘瑀曦, 等. 薤白平喘作用有效部位的筛选研究 [J]. 中国现代中药, 2011, 13(8): 40-41.
[11]陈锡雄. 薤白抑菌作用的初步研究 [J]. 杭州师范学院学报: 自然科学版, 2004, 3(4): 337-340.
[12]高森, 王苹, 唐铖, 等. 基于HPLC指纹图谱、多指标成分含量测定及化学计量学的湿热痹片质量评价 [J]. 中草药, 2020, 51(21): 5454-5461.
[13]王智民, 高慧敏, 付雪涛, 等. “一测多评”法中药质量评价模式方法学研究 [J]. 中国中药杂志, 2006, 31(23): 1925-1928.
[14]Hong Y, Liao X Y, Chen Z L. Determination of bioactive components in the fruits ofBunge by HPLC-MS/MS and quality evaluation by principal components and hierarchical cluster analyses [J]., 2021, 11(4): 465-471.
[15]罗家敏, 高雯, 李萍. 指纹图谱结合一测多评法的栀子质量控制方法研究 [J]. 中草药, 2022, 53(11): 3480-3486.
[16]熊婧, 李慧勇, 李广生, 等. 化学计量学在中药色谱分析中的应用探讨 [J]. 药物分析杂志, 2021, 41(10): 1681-1689.
[17]Shen T, Yu H, Wang Y Z. Assessing geographical origin ofusing untargeted chromatographic fingerprint, data fusion and chemometrics [J]., 2019, 24(14): 2562.
[18]李志平, 张颖, 高雨秋, 等. 基于HPLC多指标成分定量控制结合化学计量学的益气通络颗粒质量研究 [J]. 中药材, 2022, 45(9): 2188-2194.
[19]Razali M T A, Zainal Z A, Maulidiani M,. Classification of raw stingless bee honeys by bee species origins using the NMR- and LC-MS-based metabolomics approach [J]., 2018, 23(9): 2160.
[20]罗祖良, 仇峰, 韦日伟, 等. 相对校正因子在中药多指标测定中的应用研究进展 [J]. 中草药, 2012, 43(7): 1448-1452.
[21]袁汉文, 吕梦颖, 罗江溢, 等. 基于特征图谱和一测多评法的黄柏质量控制研究 [J]. 中草药, 2022, 53(17): 5491-5496.
[22]黄远, 董福越, 李楚源, 等. 一测多评法测定板蓝根中6种化学成分的含量 [J]. 中草药, 2021, 52(3): 845-851.
[23]王智民, 钱忠直, 张启伟, 等. 一测多评法建立的技术指南 [J]. 中国中药杂志, 2011, 36(6): 657-658.
[24]徐文武, 谢涛, 吕东峰, 等. 一测多评法同时测定红参中11种人参皂苷的含量 [J]. 中草药, 2021, 52(7): 2099-2105.
[25]刘艳芬, 段芳, 张翘, 等. 基于HPLC-QAMS及化学计量学的利胆石颗粒质量评价研究 [J]. 中草药, 2022, 53(19): 6044-6053.
[26]赵书田, 刘理, 秦嫚嫚, 等. 薤白中皂苷类化合物种类及其药理作用的研究进展 [J]. 中成药, 2021, 44(11): 3596-3603.
Quality evaluation ofbased on fingerprint HPLC spectrum combined with chemometrics and quantitative analysis of multi-components with a single-marker
MENG Jun-hua1,2,3, LIU Yuan1,2,3, ZHAN Hui-hui1,2,3, TANG Hong1,2,3, CUI Pei-wu1,2,3
1. School of Pharmacy, Hunan University of Chinese Medicine, Changsha 410208, China 2. Tertiary Research Laboratory of Medicinal Properties and Efficacy of Traditional Chinese Medicines, National Administration of Traditional Chinese Medicine, Changsha 410208, China 3. Mycomedicine Research Lab, Hunan University of Chinese Medicine, Changsha 410208, China
To establish an analytical method used for quality control of Xiebai (AMB) employing HPLC characteristics spectrum combined with stoichiometry and quantitative analysis of multi-components with a single-marker methodHPLC was performed on Agilent 1200 HPLC system equipped with DAD detector and Agilent Eclipse Plus C18column (250 mm × 4.6mm, 5µm), using methanol-ultrapure water solution as mobile phase employing gradient elution procedure with the flow rate of 1.0 mL/min, column temperature of 30 ℃, detection wavelength of 261 nm, and injection volume of 20 μL. Cluster analysis, principal component analysis and orthogonal partial least squares discriminant analysis were used to identify chemical patterns of different batchesof AMB at a visualization analysis level. The QAMS method was also adopted to evaluate the main components contents including adenosine, cytidine, uridine, and guanosine inAMB samples with adenosine as the internal reference, and the relative correction factors of the internal reference and cytidine, uridine and guanosine were established subsequently. Finally, to confirm validity of QAMS method, the comparison of the contents data analyzed by QAMS method and external standard method (ESM) was also carried out.The established HPLC characteristics spectrum method can fully reflect the chemical composition of AMB. The analysis method showed specific, accurate and reliable characteristics and the relative correction factors have good repeatability. Moreover, the results of chemometric analysis were in accord with data calculated from methods mentioned above. In addition, three possible characteristic components were identified by OPLS-DA and there was no significant difference found between QAMS and ESM, which can provide a reference for quality evaluation of AMB.The established HPLC fingerprint spectrum method, stoichiometry method and multi-index components analytical method with QAMS can provide a reference for quality control and evaluation of AMB and other botanic drugs.
; HPLC fingerprint spectrum; chemometrics; adenosine; cytidine; uridine; guanosine; quantitative analysis of multi-components with a single marker; external standard method
R286.2
A
0253 - 2670(2023)21 - 7176 - 10
10.7501/j.issn.0253-2670.2023.21.026
2023-03-02
国家自然科学基金资助项目(81973211/C0033375);湖南省中医药科研计划项目[D2022139(A2022005-17)];湖南省大学生创新创业训练计划项目(湘教通[2022]174号-2918);湖南中医药大学研究生创新课题(校行研字[2022]20号-2022CX87);湖南中医药大学“十四五”重点学科-生物工程学科(校行发规字[2023]2号)
孟俊华,男,硕士研究生,研究方向为中药质量与药效分析。
通信作者:崔培梧,男,副教授,硕士生导师,研究方向为中药质量及药效分析。E-mail: cuipeiwu@126.com
[责任编辑 时圣明]

