白及内生真菌Ilyonectria sp.的化学成分及其生物活性研究
范寅仲,叶可,同舜尧,田淳,艾洪莲
(中南民族大学 药学院,武汉 430074)
中药白及为兰科植物白及Bletilla striata的干燥块茎[1].据文献报道,白及主要含螺环烷甾类、皂苷类、联苯类、菲类、蒽醌类等[2-5]化合物,具有收敛止血、消肿生肌的功效.临床实践中,白及常用于治疗咯血、呕血、外伤出血、疮疡肿毒、皮肤皴裂等疾病.
内生真菌普遍存在于植物组织内,对植物生长具有积极影响,在长期的协同进化过程中,与宿主植物形成了互惠共生关系,部分内生真菌可以分泌提高植物体抵抗力、增强植物体抗逆性的次生代谢产物[6].从植物内生真菌中分离得到的具有新颖结构与骨架的次级代谢产物已有大量报道,而且其次级代谢产物往往具有抗菌[7]、抗炎[8]、抗肿瘤[9]等生物活性.本文以一株分离自白及的优势内生真菌Ilyonectriasp.作为研究对象,对其固体发酵产物的化学成分进行研究,以期发现具有较好生物活性的次级代谢产物.
1 实验部分
1.1 实验仪器与材料
核磁共振波谱仪(AM600型,德国Bruker),旋转蒸发仪(SB-1300 型,美国ELELA),中压液相色谱(Puriflash 430 型,法国Interchim),半制备型高效液相色谱(Agilent 1260 型,美国),半制备高效液相色谱(1260型,美国Agilent).
正相柱色谱硅胶(80~100 目和200~300 目)、GF254 薄层色谱板(青岛海洋化工厂);Sephadex LH-20 凝胶材料(瑞典Amersham Bioscience 公司);反相柱色谱材料 Chromatorex(40-75µm)(日本富士);色谱柱为CHIRALCEL OD-H 手性色谱柱(250 mm×4.6 mm,5 µm)Agilent Zorbax 和SB-C18 柱(9.4 mm×150 mm,5 µm)Agilent Zorbax.
显色方法为紫外灯下波长254 nm 和365 nm 处观察荧光,香草醛显色及5%硫酸乙醇溶液显色剂加热显色.
1.2 菌种鉴定及发酵培养
从湖北省恩施州采集白及,并从其健康块茎中分离得到白及内生真菌.根据18S rDNA-seq 测序,在NCBI 数据库中进行对比,将其鉴定为Ilyonectriasp.,该菌株保存在中南民族大学药学院药用真菌与民族药研究组.
将白及内生真菌Ilyonectriasp.菌株接种至PDA琼脂培养基上,25 ℃恒温条件下培养3~5 d.然后将培养基切割成若干小块放入大米固体培养基中,在25 ℃条件下发酵30 d.大米固体培养基的配制方法为:50 g大米和50 mL水分装于500 mL培养瓶中,经120 ℃下高压灭菌30 min,共212瓶.
1.3 提取分离
菌丝与培养基于45 ℃低温烘干,粉碎后过80目筛,经有机溶剂(氯仿-甲醇,50∶50)30 L浸泡之后减压浓缩,重复3 次,用水溶解至5 L.同等体积的乙酸乙酯萃取5 次.乙酸乙酯萃取液减压浓缩后获得浸膏120 g.80~100 目正相硅胶柱层析,氯仿-甲醇(100∶0—0∶100,V/V)梯度洗脱,经薄层层析色谱(TLC)在酸性高锰酸钾溶液中显色,合并,将粗浸膏分为五个粗组分(A~E).
组分B 经中压液相色谱(甲醇-水,20∶80—100∶0,V/V)梯度洗脱,分离得到9 个组分B1~B9.组分B4(2.6 g)经硅胶柱色谱(200—300目正相硅胶)石油醚-丙酮体系(8∶1—0∶1,V/V)梯度洗脱,分离得到11 个亚组分B4-1~B4-11;组分B4-3(25.0 mg)经半制备型HPLC(乙腈-水,26∶74—35∶65,20 min,4 mL/min)分离,得到化合物11(1.7 mg,tR=12.1 min);组分B4-7(210.6 mg)经半制备型HPLC(乙腈-水,36∶64—38∶62,21 min,4 mL/min)分离,得到化合物9(24.5 mg,tR=14.1 min).组分B5(6.0 g)经正相硅胶柱色谱石油醚-乙酸乙酯体系(15∶1—0∶1,V/V)梯度洗脱分离得到6个亚组分B5-1~B5-6.组分C经中压液相色谱(甲醇-水,20∶80—100∶0,V/V)梯度洗脱,分离得到9 个亚组分C1~C9.组分C3(210.0 mg)经正相硅胶柱色谱石油醚-丙酮体系(10∶1-0∶1,V/V)梯度洗脱,分离得到7 个亚组分C3-1~C3-7;组分C3-1(51.0 mg)经半制备型HPLC(甲醇-水,26∶74—32∶68,20 min,4 mL/min)分离,得到化合物8(28.8 mg,tR=13.0 min).组分C4(0.9 g)经正相硅胶柱色谱石油醚-丙酮体系(10∶1—0∶1,V/V)梯度洗脱,分离得到9 个亚组分;组分C4-8(150.1 mg)经半制备型HPLC 分离(乙腈-水,16∶84—22∶78,20 min,4mL/min),得到化合物2(28.8 mg,tR=12.4 min).组分C5(1.1 g)经正相硅胶柱色谱(石油醚-丙酮,6∶1—0∶1,V/V)梯度洗脱,得到11 个亚组分C5-1~C5—11;组分C5-6(140.0 mg)经半制备型HPLC(乙腈-水,18∶82—23∶77,20 min,4 mL/min)分离得到化合物1(3.4 mg,tR=13.2 min);组分C5-11(184.2 mg)经半制备型HPLC(乙腈-水,24∶76—26∶74,20 min,4 mL/min)分离,得到化合物10(3.5 mg,tR=12.8 min).组分C6(1.0 g)经正相硅胶柱色谱氯仿-丙酮体系(8∶1—0∶1,V/V)梯度洗脱,得到8个亚组分C6-1~C6-6;组分C6-2(50.0 mg)经半制备型HPLC 乙腈-水,31∶69—33∶69,20 min,4 mL/min)分离,得到化合物3(2.9 mg,tR=12.0 min);组分C6-4(62.0 mg)经半制备型HPLC(乙腈-水,28∶72—33∶69,20 min,4 mL/min)分离,得到化合物4(4.4 mg,tR=14.0 min);组分C6-5(56.0 mg)经半制备型HPLC(乙腈-水,31∶69—35∶65,20 min,4 mL/min)分离,得到化合物5(1.9 mg,tR=12.5 min).由于化合物5 为外消旋体,利用高效液相色谱,以正己烷和异丙醇为流动相,通过色谱拆分法(流动相经0.45 µm 微孔膜过滤,进样量50 µL,正己烷:异丙醇=80∶20;色谱柱温度25 ℃;流速1 mL/min;205、220、254、280、365 nm紫外波长检测)得到化合物(±)-5.组分D经过中压液相色谱(甲醇-水,20∶80—100∶0,V/V)梯度洗脱,用薄层层析色谱检视,得到10个亚组分D1-D10,组分D8经过正相硅胶柱层析(石油醚-丙酮,10∶1—0∶1,V/V)和半制备型HPLC(乙腈-水,54:46,18 min,4 mL/min)分离得到化合物6(1.8 mg)和7(3.1 mg).
2 活性测定
2.1 抗炎活性检测
将用Lipopolysaccharide(LPS)诱导的RAW 264.7巨噬细胞接种在含有10%胎牛血清、100 U/mL青霉素和100 g/mL 链霉素的Dulbecco's 改良培养液中,于37 ℃下加入5% CO2的恒温培养箱中进行培养.培养12 h 后,用各种浓度的测试化合物(10~40 mM)处理2 h,然后在有无脂多糖(500 ng/mL)的情况下孵育24 h.除去培养基,在每个孔中加入100 µm/mL 3-(4,5)-dimethylthiahiazo(-z-y1)-3,5-di-phenytetrazoliumromide(MTT)溶液(0.5 mg/mL)随后将板在37 ℃下培养4 h,每个孔用150 µL DMSO 溶解晶体.最后记录酶标仪上570 nm 处的吸光度,细胞存活率为对照的百分比来表示.使用Griess 试剂盒收集细胞上清液,以测量上清液中NO 的产生.使用酶标仪在540 nm处测量吸光度.
2.2 抗菌活性测定
通过微量肉汤稀释法,检测化合物对大肠埃希菌Escherichia coli(ATCC 25922)和白色念珠菌Candida albicans(ATCC 10231)的抑制作用.将上述两个病原菌接种于PDB 液体培养基,恒温培养摇床过夜培养(37 ℃,200 r/min).化合物用DMSO溶解浓度为1 mg/mL,然后将超纯水分别调为16、32、64、128、256、512 µg/mL,并将DMSO 也对应地用超纯水调为同浓度溶液.
设置实验组为不同浓度100 µL化合物和100 µL菌液,按浓度由高到低的顺序加入孔中,3 复孔;阴性对照1 为200 µL MH 或PDB 培养基,2 复孔;阴性对照2 为100 µL 化合物+100 µL 培养基,2 复孔;阳性对照为100 µL氯霉素(大肠杆菌i)或氟康唑(白色念珠菌)和100 µL 菌液,2 复孔;空白对照为200 µL菌液,2 复孔.将96 孔板放入高通量生长曲线分析仪中震荡培养24 h,观察结果.观察化合物浓度为8、16、32、64、128、256和512 µg/mL 时的菌液生长情况.空白对照孔显示浑浊,阴性对照显示清亮,质控在规定范围内,以肉眼观察无细菌生长的最低浓度即为化合物的最小抑菌浓度(MIC)值.
3 结构鉴定
11种化合物结构见图1.
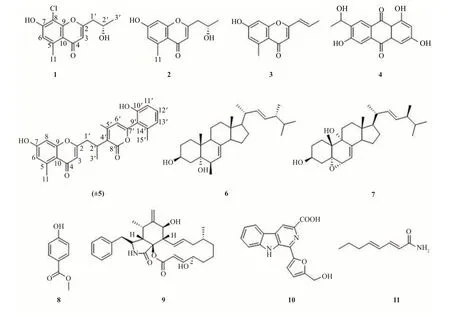
图1 化合物1~9的结构Fig.1 Chemical structures of compounds 1-9
化合物1:为白色粉末,通过(+)-HR-ESI-MS 高分辨质谱正离子模式,确定了其分子式为C13H12O4Cl(269.05725[M+H]+,计算值为269.05751),在m/z271.05429(计算值为271.05456)处的同位素峰验证了该化合物含有氯原子,得出该化合物的不饱和度为8.1H NMR(600 MHz,CD3OD):δH6.76(1H,s,H-6),6.12(1H,s,H-3),4.28(1H,m,H-2),2.80(1H,dd,J=14.5,5.0 Hz,H-1),2.72(1H,dd,J=14.5,7.9 Hz,H-1′),2.70(3H,s,H-11),1.31(3H,d,J=6.2 Hz,H-3′),13C NMR(150 MHz,CD3OD),δc181.6(C-4),167.2(C-2),159.0(C-7),156.5(C-9),141.2(C-5),117.4(C-6),116.6(C-10),112.8(C-3),106.9(C-8),66.2(C-2′),44.2(C-1′),23.5(C-3′),22.9(C-11).该化合物只有单个手性中心,通过与已知化合物对比比旋光度([α])来判断C-2ʹ的绝对构型.与7-hydroxy-2-(2'-hydroxypropyl)-5-methylchromone([α]25D+46)和(2'S*)-2-(2'-hydroxypropyl)-5-methyl-7,8-dihydroxy-chromone([α]27D+57)[10-11]两个相同骨架的已知化合物进行比较,化合物1 的比旋光度([α]25D+34.89)与它们一致,表明C-2'的绝对构型为S,进而确定了该化合物的绝对构型.并将其命名为(2'S)-2-(2'-hydroxypropyl)-5-methyl-7-dihydroxy-8-chlorochromone.
化合物2:分子式为C13H14O3,无色固体,1H NMR(600 MHz,CD3OD):δH 6.67(1H,m,H-8),6.62(1H,m,H-6),6.06(1H,s,H-3),4.18(1H,m,H-2′),2.71(3H,s,H-11),2.70(1H,dd,J=14.0,5.0 Hz,H-1a),2.65(1H,dd,J=14.0,7.9 Hz,H-1′b),1.27(3H,d,J=6.2 Hz,H-3′);13C NMR(150 MHz,CD3OD):δC182.0(C-4),167.1(C-2),163.1(C-7),161.4(C-9),143.7(C-5),118.0(C-6),115.8(C-10),112.5(C-3),101.7(C-8),66.4(C-2′),44.2(C-1′),23.5(C-3′),23.3(C-11).[α]27D+57,以上数据与文献[12]数据一致,故化合物2 被确定为2-(2'S-Hydroxypropyl)-5-methyl-7-hydroxychrom-one.
化合物3:分子式为C13H12O3,黄色油状,1H NMR(600 MHz,CD3OD):δH6.84(1H,m,H-2′),6.68(1H,m,H-8),6.62(1H,m,H-6),6.23(1H,m,H-1′),5.99(1H,d,J=4.5 Hz,H-3),2.71(3H,s,H-11),1.97(3H,d,J=6.9 Hz,H-3′);13C NMR(150 MHz,CD3OD):δC182.3(C-4),163.3(C-7),162.1(C-2),160.9(C-9),143.7(C-5),137.4(C-2′),124.7(C-1′),118.0(C-6),116.0(C-10),110.0(C-3),101.7(C-8),23.1(C-11),18.6(C-3′).以上数据和文献[13]数据一致,故化合物3被确定为clapone.
化合物4:分子式为C16H12O6,黄色固体,1H NMR(600 MHz,CD3OD):δH8.33(1H,s,H-8),7.49(1H,s,H-5),7.14(1H,m,H-4),6.54(1H,m,H-2),5.20(1H,q,J=6.4 Hz,H-11),1.47(3H,d,J=6.4 Hz,H-12);13C NMR(150 MHz,CD3OD):δC187.5(C-9),183.8(C-10),166.4(C-3),166.1(C-1),160.9(C-6),141.1(C-7),136.8(C-4a),135.4(C-3b),127.0(C-8),126.4(C-8a),113.4(C-5),110.9(C-8b),108.9(C-4),65.8(C-11),23.7(C-12).以上数据与文献[14]数据一致,故化合物4被确定为ZSU-H85 A.
化合物5:分子式为C25H22O7,白色粉末,1H NMR(600 MHz,CD3OD):δH7.11(1H,t,J=7.9 Hz,H-12′),6.71(1H,d,J=7.9 Hz,H-13′),6.69(1H,d,J=7.1 Hz,H-11′),6.65(1H,d,J=2.0 Hz,H-8),6.61(1H,s,H-6),6.11(1H,s,H-6′),5.97(1H,s,H-3),3.70(1H,m,H-2′),3.18(1H,dd,J=14.0,9.9 Hz,H-1′),2.88(1H,dd,J=14.0,6.1 Hz,H-1′),2.69(3H,s,H-11),2.10(3H,s,H-15′),1.39(3H,d,J=7.2 Hz,H-3′);13C NMR(150 MHz,CD3OD):δC182.1(C-4),169.2(C-2),169.1(C-7′),168.0(C-8′),163.0(C-7),161.5(C-9),159.2(C-5′),156.7(C-10′),143.5(C-5),139.6(C-14′),131.8(C-12′),122.3(C-13′),121.4(C-9′),117.9(C-6),115.7(C-10),114.2(C-11′),111.5(C-3),106.2(C-6′),105.5(C-4′),101.8(C-8),38.7(C-1′),29.4(C-2′),23.1(C-11),19.9(C-15′′),18.2(C-3′).该化合物只存在C-2′这一个手性中心,而不能通过ROESY 图谱确定其相对构型.化合物5 的旋光度([α]25D-1.3)接近于0,表明该化合物可能为外消旋体,并通过手性柱分析拆分的方式证实了其为一对外消旋体.通过手性制备后,得到了旋光值为[α]25D+71.55(c0.07,MeOH)的(+)-5 和[α]25D-72.56(c0.07,MeOH)的(-)-5.如图2 所示.并通过ECD 计算的方式,与实验数据相比较,确定了(+)-5 的C-2′的绝对构型为S,(-)-5 的C-2′的绝对构型为R.将其命名为(±)-Ilyonectriachromone.

图2 手性分析和制备化合物(±)-5的HPLC图谱Fig.2 HPLC chromatogram for chiral analysis and preparation of compound(±)-5
化合物6:分子式为C28H46O5,白色粉末,1H NMR(600 MHz,CD3OD):δH5.27(1H,m,H-7),5.23(2H,m,H-22,23),3.97(1H,m,H-3),3.54(1H,dt,J=5.2,2.0 Hz,H-6),1.06(3H,s,H-9),1.04(3H,d,J=6.6 Hz,H-21),0.94(3H,d,J=6.8 Hz,H-28),0.87(3H,d,J=6.8 Hz,H-27),0.85(3H,d,J=6.8 Hz,H-28),0.64(3H,s,H-18).13C NMR(150 MHz,CD3OD):δC143.7(C-8),137.0(C-22),133.2(C-23),119.0(C-7),76.9(C-5),74.2(C-6),68.3(C-3),57.3(C-17),55.9(C-14),44.7(C-13),44.3(C-9),44.3(C-24),41.8(C-20),40.7(C-4),40.5(C-12),38.1(C-10),34.3(C-25),33.9(C-2),31.7(C-1),29.1(C-16),24.0(C-15),23.0(C-11),21.6(C-21),20.4(C-17),20.0(C-26),18.9(C-19),18.2(C-28),12.8(C-18).以上数据与文献[15]数据一致,故化合物6 被确定为(22E,24R)-7,22-dien-3β,5α,6β-ergotriol.
化合物7:分子式为C28H44O3,白色粉末,1H NMR(600 MHz,CD3OD):δH5.33(1H,dd,J=5.2,2.4 Hz,H-7),5.23(1H,m,H-23),5.21(1H,m,H-22),3.99(1H,m,H-3),3.65(1H,dd,J=5.2,2.4 Hz,H-6),2.50(1H,m,H-14),2.20(1H,dt,J=13.8,4.0 Hz,H-1a),2.11(1H,dd,J=13.6,11.4 Hz,H-4a),2.05(1H,m,H-20),1.89(1H,m,H-11a),1.87(1H,m,H-2a),1.85(1H,m,H-24),1.82(1H,m,H-12a),1.79(1H,m,H-16a),1.64(1H,m,H-4b),1.61(1H,m,H-12b),1.59(1H,m,H-11b),1.56(1H,m,H-15a),1.52(1H,m,H-2b),1.49(1H,m,H-15b),1.47(1H,m,H-25),1.37(1H,m,H-17),1.36(1H,m,H-1b),1.35(1H,m,H-16b),1.12(3H,s,H-19),1.04(3H,d,J=6.6 Hz,H-21),0.95(3H,d,J=6.8 Hz,H-28),0.87(3H,d,J=6.8 Hz,H-26),0.85(3H,d,J=6.8 Hz,H-27),0.66(3H,s,H-18).13C NMR(150 MHz,CD3OD):δC143.8(C-8),136.9(C-22),133.3(C-23),121.0(C-7),78.9(C-5),76.0(C-9),73.6(C-6),68.1(C-3),57.3(C-17),51.8(C-14),44.8(C-13),44.3(C-24),41.8(C-20),41.4(C-10),40.7(C-4),36.5(C-12),34.3(C-25),31.6(C-2),29.2(C-16),29.1(C-11),28.2(C-1),24.0(C-15),22.2(C-19),21.6(C-21),20.4(C-26),20.0(C-27),18.2(C-18),12.2(C-18).以上数据和文献[16]数据一致.故化合物7被确定为(24S)-5α,6α-epoxyergosta-7,22-dien-3β,9α-diol.
化合物8:分子式为C9H10O3,黄色油状,1H NMR(600 MHz,CD3OD):δH7.07(2H,d,J=8.5 Hz,H-2,6),6.72(2H,d,J=8.5 Hz,H-3,5),3.65(3H,s,HOMe),3.52(3H,s,H-7).13C NMR(150 MHz,CD3OD):δC174.6(C-8),157.5(C-4),131.3(C-2,6),126.3(C-1),116.3(C-3,5),52.4(C-OMe),40.9(C-7).以上数据与文献[17]数据一致,故化合物8 被确定为p-hydroxyphenylacetic acid methyl ester.
化合物9:分子式为C29H37O5N,白色粉末,1H NMR(600 MHz,CD3OD):δH7.27(2H,t,J=7.4 Hz,H-3′,5′),7.18(1H,t,J=7.4 Hz,H-4′),7.14(2H,d,J=7.4 Hz,H-2′,6′),6.93(1H,dd,J=15.7,4.4 Hz,H-21),5.83(1H,ddd,J=15.0,9.9,1.6 Hz,H-13),5.78(1H,dd,J=15.7,1.8,H-22),5.28(H1,s,H-12a),5.23(1H,m,H-14),5.09(1H,s,H-12b),4.44(1H,m,H-20),3.80(1H,d,J=11.0 Hz,H-7),3.39(1H,m,H-8),3.37(1H,m,H-3),3.21(1H,m,H-5),2.85(1H,dd,J=5.3,2.7 Hz,H-4),2.80(2H,m,H-10),2.09(1H,m,H-19a),1.91(1H,m,H-15a),1.72(1H,m,H-17a),1.66(1H,m,H-19b),1.56(1H,m,H-15b),1.45(1H,m,H-18a),1.28(1H,m,H-18b),1.22(1H,m,H-16),0.87(3H,d,J=6.6 Hz,H-24),0.85(3H,d,J=6.8 Hz,H-11),0.57(1H,m,H-17b);13C NMR(150 MHz,CD3OD):δc173.9(C-1),166.4(C-23),154.7(C-21),151.3(C-6),138.2(C-1′),136.8(C-14),131.0(C-2′,6′),129.6(C-3′,5′),128.7(C-13),127.9(C-4′),119.5(C-22),114.3(C-12),85.4(C-9),71.4(C-7),71.1(C-20),54.7(C-3),49.8(C-8),49.0(C-4),44.0(C-10),43.2(C-19),36.5(C-17),35.4(C-15),34.5(C-16),32.8(C-5),21.4(C-18),20.7(C-24),14.1(C-11).以上数据与文献[18]数据一致,故化合物9被确定为cytochalasin B.
化合物10:分子式为C17H12O4N2,黄色粉末,1H NMR(600 MHz,DMSO-d6):δH11.57(1H,s,9-NH),8.81(1H,s,H-4),8.39(1H,d,J=7.8 Hz,H-5),7.81(1H,d,J=7.6 Hz,H-8),7.63(1H,t,J=7.6 Hz,H-7),7.42(1H,s,H-4′),7.33(1H,t,J=7.8 Hz,H-6),6.62(1H,s,H-3′),4.68(2H,s,H-2′);13C NMR(150 MHz,DMSO-d6):δC167.7(C-3),157.2(C-2′),151.1(C-5′),141.5(C-8a),132.1(C-1),131.7(C-9a),129.9(C-3),128.8(C-7),122.0(C-5),121.1(C-4a,4b),120.5(C-6),115.5(C-4),112.8(C-8),111.0(C-4′),109.2(C-3′),56.0(C-2′).以上数据与文献[19]数据一致,故化合物10被确定为Flazin.
化合物11:分子式为C8H13ON,白色晶体,1H NMR(600 MHz,CD3OD):δH7.21(1H,dd,J=15.3,10.7 Hz,H-3),6.24(1H,m,H-4),6.14(1H,dt,J=14.8,7.0 Hz,H-5),5.79(1H,d,J=15.3 Hz,H-2),2.17(2H,q,J=7.0 Hz,H-6),1.48(2H,m,H-7),0.94(3H,t,J=7.4 Hz,H-8);13C NMR(150 MHz,CD3OD):δc 171.9(C-1),146.1(C-3),144.9(C-5),130.0(C-4),121.6(C-2),36.0(C-6),23.1(C-7),14.0(C-8).以上数据和文献[20]数据一致,故化合物11被确定为2E,4E-octadienamide.
4 生物活性实验
对化合物1~11均做了抗炎和抗菌活性的测定,其中化合物9 表现出良好的抗炎活性,其IC50值为9.47 µmol/L,略高于阳性对照药pyrrolidinedithiocarbamate ammonium(IC50=23.08 µmol/L).
5 结语
本文从白及内生真菌中分离得到11 个单体化合物,包括5 个色原酮类化合物,1 个细胞松弛素类化合物,2 个甾体类和3 个其他类化合物,其中化合物1 和5 作为天然产物首次被报道.抗炎和抗菌活性测定结果表明,化合物9 有良好的抗炎活性,其IC50值为9.47 µmol/L.综上所述,该研究为进一步挖掘白及内生真菌发酵液中具有生物活性的次级代谢产物奠定良好的基础,对天然产物的开发具有重要的意义.

