鞣花酸调控Nrf2和NLRP3通路影响TGF-β所致AML-12细胞EMT的作用
邓旭坤,张甜甜,刘靖,雷霄,王绰,舒广文
(中南民族大学 药学院 &民族药学国家级实验教学示范中心,武汉 430074)
转化生长因子-β(TGF-β)是一组多功能的生长因子,是TGF-β 超基因家族中的一员[1],在调节细胞增殖、分化、免疫反应和伤口愈合等方面具有关键作用,例如在骨骼疾病、纤维化和癌症等疾病上[2].有研究表明TGF-β能引起肝细胞发生上皮-间质转化(epithelial mesenchymal transition,EMT)[3].EMT 指上皮细胞失去正常极性,细胞间紧密连接,细胞间骨架重排,上皮细胞松解、失去极性、变成排列松散的梭形细胞,获得纤维原细胞或间质细胞的过程[5].近年来,EMT 被认为是肝纤维化的机制之一[4].因此,寻找能缓解EMT 作用的药物在肝纤维化的治疗方面具有重要意义.
EA(ellagic acid,EA)是一种广泛存在于石榴、树莓、葡萄等水果中的天然多酚类化合物[6].EA 可以通过改善氧化、炎症等生化指标来治疗丙烯酰胺引起的肝毒性[7].EA 与顺铂联合使用可显著降低结肠癌小鼠肝脏过氧化损伤水平[8].EA 还能够通过抗氧化作用减轻铁过载诱导的小鼠肝毒性[9].以上研究结果显示,EA 有很好的抗氧化及抗炎作用.另一方面有研究发现,EA 对CC14诱导的小鼠急性肝损伤具有保护作用[10],对CC14诱导的小鼠肝纤维化的治疗效果也十分明显[11].然而,EA 对小鼠肝细胞内EMT 的影响目前还没有报道.因此,此次研究以AML12 细胞为实验对象,探究EA 对小鼠肝细胞EMT 作用的影响及其可能的机制,以期为EA 在肝纤维化治疗方面的应用提供依据.
1 材料与方法
1.1 材料与仪器
AML-12 细胞(武汉普诺赛);鞣花酸(纯度≥98%)(湖北巨胜);DMEM/F12 基础培养基、胎牛血清(武汉普诺赛);PBS缓冲液(塞维尔生物);转化生长因子β(TGF-β)(南京欧凯);胰蛋白酶(美国赛默飞);二甲基亚砜(DMSO)(湖北鑫红利);活性氧检测试剂盒、BCA蛋白浓度测定试剂盒(碧云天);NLRP3、ASC、Caspase-1、IL-1β、Lamin B(核纤层蛋白B)和β-Actin(β-肌动蛋白)抗体(碧云天);Nrf2、NQO-1、GCLM、HO-1、GCLC抗体(爱博泰克).
倒置显微镜(CX27,上海蔡康);细胞培养箱(MCO-15AC,日本三洋);全自动酶标仪(MuLTISKAN,深圳菲特立).
1.2 方法
1.2.1 细胞培养及给药
AML-12 细胞由实验室自传代储存.细胞贴壁生长在含有10%的胎牛血清、40 µg/mL 地塞米松、100 U/mL 青毒素、100 U/mL 链霉素、10 µg/mL 胰岛素的DMEM/F12培养基中,5% CO2、37 ℃培养.
EA 溶解于1%NaHCO3,配制成500 µmol/L 溶液作为母液备用,使用前加热溶解,并稀释成特定给药浓度.
取正处于对数生长期的AML12细胞接种于6孔板中,待细胞贴壁生长至70%时,除空白组外其余孔均加入TGF-β(5 ng/mL),TGF-β刺激24 h后,低剂量给药组和高剂量给药组分别加入EA 至终浓度为25 µmol/L和50 µmol/L,给药后继续培养24 h.
1.2.2 细胞活力检测
取对数生长期的AML12细胞接种于96孔板中,每孔细胞密度为1×105个,至37 ℃培养箱24 h,待细胞贴壁完全,分别加入浓度为0、12.5、25、50 µmol/L EA溶液孵育48 h.培养结束后加入10 µL MTT 溶液,继续培养4 h.培养结束弃培养基,每孔加入150 µL DMSO后转移至摇床上低速震荡10 min.震荡完毕使用酶标仪检测每孔在490 nm波长处的吸光度值.
1.2.3 活性氧检测
培养细胞给药24 h 后,弃原培养基,加入1 mL 10 µmol/L 的DCFH-DA 探针37 ℃温育30 min,随后除去探针,PBS 洗涤3 次,在荧光显微镜下观察并拍照.
1.2.4 细胞形态学观察
细胞给药培养满24 h 后,在倒置显微镜下观察AML-12细胞的形态并拍照记录.
1.2.5 蛋白免疫印迹检测(Western blot)
细胞给药24 h 后,弃原培养基,按说明书提取细胞总蛋白和核蛋白,并用BCA 蛋白浓度测定试剂盒测定所提取蛋白的蛋白浓度.以每泳道上样20µg 蛋白进行SDS-PAGE 电泳.电泳完毕将蛋白转移至PVDF 膜上,并用5%脱脂奶粉室温孵育1 h 进行封闭.封闭完全后孵育抗体,首先4 ℃孵育一抗过夜.次日回收一抗,TBST 洗涤三次后孵育二抗,二抗室温孵育1 h 后TBST 洗涤三次,显影.Image J 软件统计蛋白条带灰度值,以β-Actin作为内参对照计算各目的蛋白的相对表达水平.
1.2.6 免疫荧光检测
细胞给药24 h 后,弃原培养基,加入免疫染色固定液固定20 min,按照说明书进行荧光染色,在荧光显微镜下观察并拍照.
1.2.7 统计学分析
结果采用均值±标准差(Mean±SD)表示.统计学分析用SPSS19.0 作t检验分析,*P<0.05 指示拥有显著性差异,**P<0.01指示拥有极显著性差异.
2 结果与分析
2.1 EA对AML-12细胞活力的影响
MTT 法检测结果表明(图1),随着EA 给药浓度的增加,AML-12细胞活力基本不变.

图1 EA对AML-12细胞活力的影响Fig.1 The effect of EA on the viability of AML-12 cells
2.2 EA对TGF-β诱导的AML-12细胞形态的影响
如图2所示,空白组细胞呈大小均一、边缘清晰的规则多角形,模型组细胞呈梭型和不规则三角形,EA 给药浓度为25 µmol/L 时,AML-12 细胞部分恢复正常形态,成纤维化程度降低,EA 给药浓度为50 µmol/L 时,AML-12 细胞绝大多数恢复正常形态.当给予目前已知的缓解肝纤维化的药物水飞蓟素时[12],细胞可恢复至与空白组细胞无异,而给予1%NaHCO3溶液时,细胞与模型组细胞相近,呈梭型 和不规则三角形.

图2 EA、水飞蓟素以及1%NaHCO3对TGF-β诱导AML-12细胞形态的影响(200×)Fig.2 Effect of EA on TGF-β-induced AML-12 cell morphology(200×)
2.3 EA 对TGF-β 诱导的AML-12 细胞EMT 标志蛋白的影响
E-cadherin 和Vimentin 为EMT 标志蛋白,能反映细胞纤维化程度.结果如图3 所示,模型组和1%NaHCO3溶液给药组E-cadherin 表达显著减弱(P<0.01),而EA 给药组和水飞蓟素给药组有上升趋势(P<0.01);模型组和1%NaHCO3溶液给药组Vimentin 表达显著增强(P<0.01),而EA 给药组和水飞蓟素给药组则有所减弱(P<0.01).
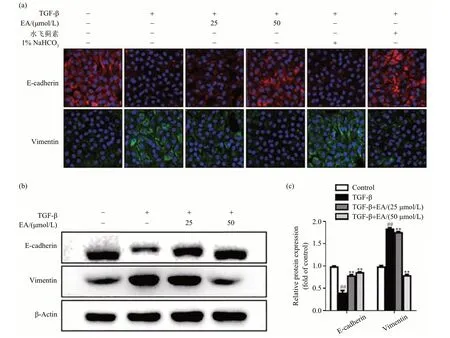
图3 AML-12细胞内EMT标志蛋白的表达水平Fig.3 The expression levels of EMT marker proteins in AML-12 cells
2.4 EA 对TGF-β 诱导的AML-12 细胞抗氧化能力的影响
EA 对TGF-β 诱导的AML-12 细胞产生ROS 的影响结果如图4 所示,TGF-β 会使细胞内ROS 增加,EA给药会减少细胞内ROS水平.
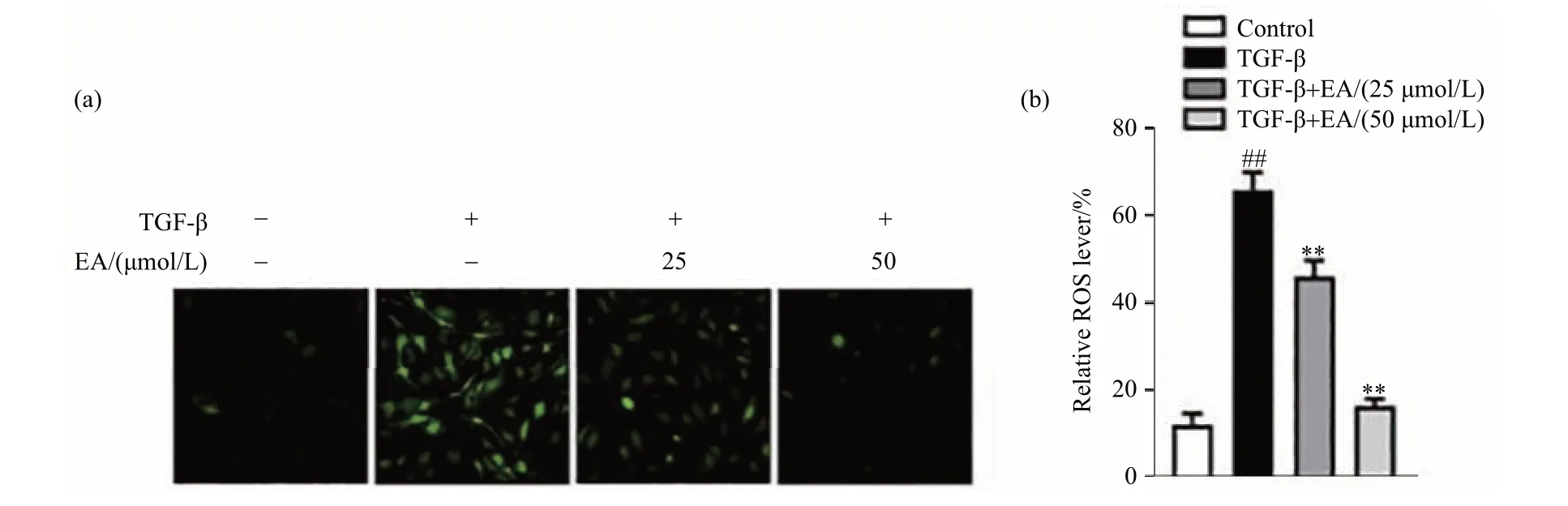
图4 活性氧荧光染色图(200×)Fig.4 Reactive oxygen fluorescence chart of reactive oxygen(200×)
2.5 EA 对TGF-β 诱导的AML-12 细胞抗氧化信号通路的影响
抗氧化信号通路与肝纤维化密切相关.Nrf2 及其下游抗氧化元件的表达结果如图5 所示.结果表明,与空白组相比模型组的Nrf2 表达量明显降低(P<0.01),同时Nrf2 下游的HO-1、NQO-1、GCLM、GCLC 抗氧化因子的表达也降低(P<0.01),EA 给药后Nrf2以及其相关蛋白的表达上升(P<0.01).

图5 AML-12细胞内抗氧化通路主要蛋白表达水平Fig.5 Analysis of the expression levels of major proteins of the antioxidant pathway in AML-12 cells
2.6 EA 对TGF-β 诱导的AML-12 细胞NLRP3 信号通路的影响
炎症信号通路与肝纤维化密切相关.NLRP3 炎症通路相关蛋白的表达水平结果如图6 所示,模型组NLRP3炎性小体组分和其下游IL-1β 蛋白的表达明显高于空白组(P<0.01),与模型组相比,EA 给药组(P<0.01)NLRP3、ASC、Caspase-1 和IL-1β 蛋白的表达水平显著下调.

图6 AML-12细胞内炎症通路主要蛋白表达水平Fig.6 Analysis of the expression levels of major proteins of inflammatory pathways
3 讨论
肝病是一类常见危害人类健康的疾病[13].近年来,由于生活方式的转变,我国各类肝脏疾病的发病率逐年上升.肝纤维化是多种慢性肝病的病理过程,是多种慢性肝损伤疾病发展中的关键环节,早期有效的干预可发生逆转,否则后期可发展为肝硬化、肝癌等[14].因此,预防或者缓解肝纤维化在保肝护肝方面显得尤为重要.
EA 是一种天然多酚二内酯,为鞣质的水解产物,具有明显的抗肝损伤、抗氧化、清除自由基、抑制细胞凋亡和抗肿瘤等作用[15].为探讨EA在体外对肝纤维化是否产生抑制作用,用EA 对TGF-β 诱导的AML-12 细胞产生的EMT 的影响来评估EA 在体外对小鼠肝纤维化的保护作用.结果显示,在0~50µmol/L 的剂量浓度范围内,EA 自身对细胞的存活率基本没有影响,表明在0~50 µmol/L 的剂量浓度范围内,EA 对AML-12 细胞没有明显的细胞毒性.在用TGF-β 对AML-12 细胞进行刺激后,细胞发生纤维化,形态由原本紧密排列的近圆形转变成边界模糊的不规则梭形,表明成功建立了AML-12 细胞的EMT 模型;EA 给药可使TGF-β 刺激的AML-12 纤维样细胞正常化,表明EA 可以缓解AML-12 细胞的纤维化.通过蛋白免疫印迹法和免疫荧光检测法发现,EA 给药后TGF-β 所致的AML-12 细胞中EMT 相关标志蛋白E-cadherin 的表达水平显著上调,Vimentin 表达显著下调,这进一步表明EA可以抑制AML-12 细胞内的EMT.TGF-β 会使细胞内ROS 增加,EA 则能降低细胞内ROS 水平.在关于通路的研究中,TGF-β 能使Nrf2 及下游抗氧化因子HO-1、NQO-1、GCLM、GCLC 的表达降低,同时使NLRP3 炎性小体组分和其下游IL-1β 的表达增强,而EA 给药能上调Nrf2 以及其相关蛋白的表达同时下调NLRP3及其下游相关因子的表达.
TGF-β刺激小鼠肝细胞会造成细胞内ROS的积累,而细胞内ROS 过多则会促进EMT 的发生[16].肝细胞中可以表达NLRP3 炎症小体相关的蛋白[17],而NLRP3 通路激活时则会促进肝脏发生纤维化,当肝脏出现炎症时会增加促纤维化细胞因子和生长因子(TNF-α、TGF-β、CTGF)的表达,而IL-1β则能直接促进肝脏纤维化[18].当细胞受到刺激,比如细胞内ROS 积累过量时,NLRP3 相关通路可被激活,促进白细胞介素(IL-1β)的成熟,从而导致炎症反应的发生[19-20].激活Nrf2 信号通路,其下游转录因子可以通过一系列的基因表达来启动细胞的抗氧化能力[21],消除细胞内ROS,从而抑制炎症的发生,从而起到抑制肝脏纤维化的目的.有研究表明激活Nrf2 信号通路确实可以缓解肝脏纤维化[22-23].
综上所述,EA 能抑制TGF-β 诱导的AML-12 细胞内EMT.进一步研究结果显示,EA 能降低细胞内ROS 水平,上调Nrf2 信号通路水平,抑制NLRP3 炎症小体各组分的表达,降低细胞内IL-1β 水平.实验结果表明,EA 能抑制TGF-β 诱导的AML-12 细胞内EMT,其机制可能与调控抗氧化及炎症相关信号通路有关.

