泸州市与广州市龙眼核不同极性部位体外抗氧化活性的比较研究
陈永钧,代良敏,代良萍,张 春,王 燕
(1.西南医科大学附属医院药学部,四川泸州 646000;2.西南医科大学药学院,四川泸州 646000;3.广东医科大学附属医院药学部,广东湛江 524001)
龙眼(Dimocarpus longanLour.)为无患子科龙眼属植物龙眼的果实,营养丰富并具有壮阳益气、补益心脾、抗衰老、免疫调节和促进智力发育等功效[1-3],属于药食同源的滋补佳品,同时也是中国重要的经济作物。龙眼核为龙眼的种仁,约占果实干重的75%,其性味涩、平,气微,味淡而微苦,具有行气散结、止血、止泻、燥湿等功效,临床上主治疝气、瘰疬、创伤出血、腋臭、疥癣、湿疮等病症[4,5]。龙眼核成分众多,其中多糖、生物碱、黄酮类和多酚类等多种活性物质为其良好的抗氧化、抑菌、降糖、降脂、抗癌等生物活性奠定了基础[6-13]。
四川省泸州市是中国晚熟龙眼的主产区之一,截至2020 年底,泸州市龙眼种植面积已达2.05 万hm2,产量达15 万t,占全省种植面积和年产量的90%以上[2,14-16]。尽管龙眼的产量高但其利用率很低,其主要被加工成龙眼干、桂圆肉、罐头、果汁、酒类等产品,而加工过程产生的大量龙眼核则被当作废弃物处理,造成环境污染和资源浪费[17-20]。目前鲜见泸州市和广州市龙眼核抗氧化活性比较研究的报道。因此,鉴于龙眼核的药用价值以及抗氧化作用是众多生理、病理现象研究的基础,本研究以泸州市和广州市两主产区的龙眼核为试验对象进行抗氧化活性的比较研究,以期为充分利用龙眼核的药用资源和推动当地龙眼核相关产品的深度开发提供依据。
1 材料
1.1 药材
龙眼核购于广州市荔湾区(广州荔湾)、泸州市江阳区张坝桂圆林(泸州张坝)、泸州市黄舣镇(泸州黄舣)3 个产地,均为干燥龙眼果实,去除果皮和假种皮后获得种子,干燥,备用。
1.2 试剂
维生素C(VC)、过硫酸钾、磷酸氢二钾、正丁醇、无水乙醇、二甲基亚砜(DMSO),成都金山化学试剂有限公司;1,1-二苯基-2-三硝基苯肼(DPPH),成都润泽本土化工有限公司;2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS),上海阿拉丁试剂有限公司;磷酸二氢钠,成都市科龙化工试剂厂;石油醚、乙酸乙酯,成都市科隆化学品有限公司。
1.3 仪器
电子分析天平(ME204 型),梅特勒-托利多仪器(上海)有限公司;电热鼓风干燥箱(GZX-9140MBE 型),上海博迅实业有限公司;高速多功能粉碎机(800Y 型),武义海纳电器有限公司;数显恒温水浴锅(HH-1 型),江苏省金坛市荣华仪器有限公司;超声波清洗器(SB-100D 型),宁波新芝生物科技股份有限公司;旋转蒸发仪(YRE-2010Z 型),巩义市予华仪器有限责任公司;酶标仪(Multiskan GO型),赛默飞世尔科技有限公司。
2 方法
2.1 龙眼核粗提物的制备
将龙眼核置于60 ℃烘干至恒重后粉碎,过30 目筛,装袋。称取龙眼核粉末100 g,置于2 L 的蒸馏烧瓶中,每次加入0.5 L无水乙醇,于70 ℃回流提取1 h,重复提取3 次。过滤并合并滤液,用旋转蒸发仪减压浓缩。经干燥后称量,得到粗提物的干膏重量。
2.2 硅胶拌样
按1∶2 的质量比称取龙眼核粗提物与硅胶粉末,于龙眼核粗提物中加入适量无水乙醇溶解,再将其滴加到盛有硅胶粉末的器皿中,充分搅拌均匀后于70 ℃水浴上挥干溶剂,最后将其置于真空干燥器中减压干燥30 h,即得样品硅胶粉。
2.3 龙眼核不同极性部位的提取
取适量“2.2”中所得样品硅胶粉,装入1 L 的蒸馏烧瓶中,每次加入0.5 L 石油醚进行萃取,重复萃取3 次直至滤液接近无色或呈浅黄色。然后向蒸馏烧瓶中依次加入等量乙酸乙酯、正丁醇、无水乙醇和水进行萃取,过滤并合并滤液,滤液经减压浓缩、干燥后得不同极性部位干浸膏,称量备用[13]。
2.4 龙眼核不同极性部位的抗氧化活性评价
2.4.1 DPPH 法
1)DPPH 溶液的配制。精密称取DPPH 2 mg 溶于50 mL 无水乙醇中,超声溶解。于4 ℃条件下避光保存并在3.5 h 内用毕[21,22]。
2)样品溶液的配制。分别精密称取石油醚、乙酸乙酯、正丁醇、无水乙醇和水提部位的各产地干浸膏3 mg,加适量无水乙醇溶解并稀释成浓度为0.30、0.26、0.22、0.18、0.14、0.12、0.08、0.04 mg/mL 的系列溶液[23]。
3)VC 溶液的配制。精密称取VC 3 mg,加无水乙醇溶解并稀释成浓度为0.30、0.26、0.22、0.18、0.14、0.12、0.08、0.04 mg/mL 的VC 对照液,备用[24]。
4)试验利用96 孔板进行测定。将试验分为10组,包括8 个样品组、1 个空白组和1 个对照组,每组设置3 个复孔。加样方法如下,样品组:100 μL 各浓度样品溶液+100 μL DPPH 溶液;空白组:100 μL 0.3 mg/mL 的样品溶液+100 μL 无水乙醇;对照组:100 μL 无水乙醇+100 μL DPPH 溶液。避光操作,混匀反应30 min,以无水乙醇作参比,于517 nm 波长处分别测得吸光度As、Ao和A。以VC 对照液作阳性参照,按式(1)计算样品的抗氧化能力[25-27]。
式中,As为样品组溶液吸光度;Ao为空白组溶液吸光度;A为对照组溶液吸光度。
2.4.2 ABTS 法
1)PBS 缓冲液的配制。准确称取7.16 g 磷酸氢二钠定容至100 mL,得甲溶液;准确称取3.12 g 磷酸二氢钠定容至100 mL,得乙溶液,取81 mL 甲溶液及19 mL 乙溶液混合均匀,即得pH 7.4 的PBS 缓冲溶液[28,29]。
2)ABTS 工作液的配制。精密称取ABTS(2,2′-联氮-双-3-乙基苯并噻唑啉)粉末30 mg 溶于8 mL去离子水中,另取8.8 mg 的过硫酸钾溶于15 mL 去离子水中,两者混合避光反应14~16 h,稀释后避光备用[30]。
3)样品溶液的配制。分别精密称取石油醚、乙酸乙酯、正丁醇、无水乙醇和水提部位的干浸膏0.2 mg,溶解于10 mL 的DMSO 中,再依次稀释至适宜浓度。石油醚、乙酸乙酯和正丁醇提取部位的浓度梯度为0.040、0.036、0.032、0.028、0.024、0.020、0.016 mg/mL,无水乙醇和水提部位的浓度梯度为0.100、0.090、0.080、0.070、0.060、0.050、0.040 mg/mL。
4)试验利用96 孔板进行测定。将试验分为9组,包括7 个样品组、1 个空白组和1 个对照组,每组设3 个复孔。加样方法如下,样品组:50 μL 样品液+150 μL ABTS 工作液;空白组:50 μL PBS 缓冲液+150 μL ABTS工作液;对照组:50 μL浓度为2.0 mg/mL的样品液+150 μL 去离子水,混匀反应30 min 后,于734 nm 处分别测吸光度Aj、Ai、A。以PBS 缓冲液为对照,按式(2)计算样品的抗氧化能力[31]。
式中,Aj为样品组溶液吸光度;Ai为对照组溶液吸光度;A为空白组溶液吸光度。
2.4.3 数据处理 各产地的龙眼核均按相同的方法进行操作,各试验重复3 次,试验数据用¯x±s表示。采用SPSS 17.0 软件进行单因素方差分析与样本均值间差异的显著性比较。
3 结果与分析
3.1 龙眼核干膏重量
各产地龙眼核经不同极性的溶剂提取,所得干燥浸膏的质量如表1 所示。各极性部位干膏质量的大小除泸州张坝产区表现为正丁醇>乙酸乙酯>无水乙醇>石油醚>去离子水外,其余两地表现为正丁醇>乙酸乙酯>无水乙醇>去离子水>石油醚,3 个产地较为一致。

表1 各极性部位干膏质量(n=3) (单位:g)
3.2 DPPH 法测定龙眼核不同极性提取物的抗氧化作用
由图1 可知,以VC 作为阳性对照,各产地龙眼核的不同极性部位均表现出一定程度的DPPH 自由基的清除能力,且在0.04~0.30 mg/mL 的浓度范围内,DPPH 自由基清除率均随着浓度的增加逐渐上升并趋于平衡。不同产地的龙眼核,其极性部位清除DPPH 自由基的能力亦有所差异。
广州市荔湾龙眼核各极性部位的DPPH 自由基清除水平大小表现为乙酸乙酯>水>正丁醇≈无水乙醇>石油醚。其中,乙酸乙酯部位的清除能力最强,其IC50为0.021 mg/mL(表2),当浓度为0.18 mg/mL时,其清除率可达91.9%。相反,石油醚部位的清除能力最弱,当浓度为0.30 mg/mL 时,清除率仅为21.9%。泸州张坝龙眼核各极性部位DPPH 自由基清除率高低表现为乙酸乙酯>石油醚≈无水乙醇≈正丁醇>水。其中,乙酸乙酯部位的清除能力依然最强,其IC50为0.022 mg/mL(表2),当浓度为0.14 mg/mL时,其清除率可达90.7%。此外,水部位的清除能力最弱,但当浓度为0.30 mg/mL时,清除率亦可达85.5%。

表2 DPPH 法测得龙眼核不同极性部位的IC50(单位:mg/mL)
泸州黄舣龙眼核各极性部位DPPH 自由基清除率高低表现为水>乙酸乙酯>石油醚>正丁醇>无水乙醇。其中,水部位的清除能力最强,其IC50为0.029 mg/mL(表2),当浓度为0.112 5 mg/mL 时,其清除率可达93.2%。此外,无水乙醇部位的清除能力最弱,但当浓度为0.30 mg/mL时,清除率可达92.6%。
由表2 可以看出,泸州张坝龙眼核在石油醚、正丁醇和无水乙醇提取部位的抗氧化活性强于广州荔湾产区。各产地龙眼核乙酸乙酯提取部位均有较好的抗氧化活性,泸州张坝与广州荔湾的结果相近。
3.3 ABTS+·法测定龙眼核不同极性提取物的抗氧化作用
由图2 可以看出,除石油醚部位外,其余极性部位在相应的浓度范围内对ABTS+自由基的清除率均随着浓度的增加呈上升趋势。此外。还可以看出,不同产地的龙眼核各极性部位清除ABTS+自由基的能力同样有差异。

图2 龙眼核不同极性部位的ABTS+自由基清除率
广州荔湾龙眼核各极性部位的ABTS+自由基清除率高低表现为石油醚>乙酸乙酯>正丁醇>水>无水乙醇(图2A、图2B)。其中,石油醚部位的清除能力最强,在其浓度范围内ABTS+自由基清除率最低可达89.84%,而无水乙醇部位的清除能力最弱,当浓度为0.04 mg/mL 时,清除率仅为17.56%,其IC50为0.068 mg/mL(表3)。
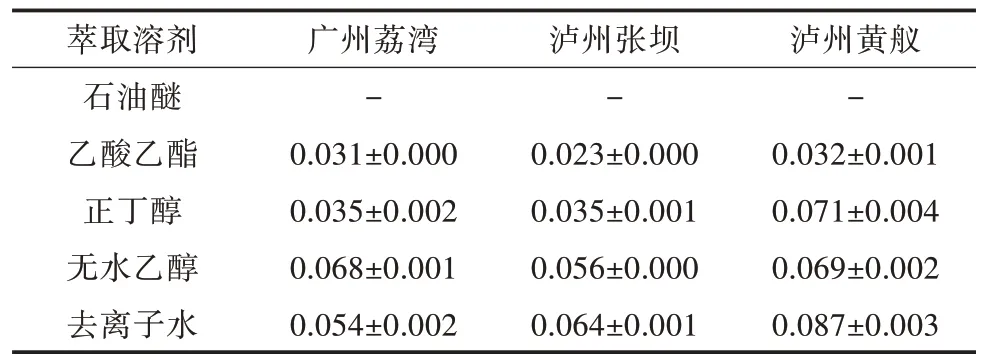
表3 ABTS+·法测得龙眼核不同极性部位的IC50(单位:mg/mL)
泸州张坝龙眼核各极性部位ABTS+自由基清除率高低表现为石油醚>乙酸乙酯>正丁醇>无水乙醇>水(图2C、图2D)。泸州张坝龙眼核石油醚部位的清除能力最强,在其浓度范围内ABTS+自由基清除率最低可达93.51%,而水部位的清除能力最弱,当浓度为0.040 mg/mL 时,几乎无抗氧化作用。
泸州黄舣龙眼核各极性部位ABTS+自由基清除率高低顺序同张坝龙眼核,即石油醚>乙酸乙酯>正丁醇>无水乙醇>水(图2E、图2F)。其中,石油醚部位的清除能力虽最强,但其最高清除率未超过65%,其余极性部位的清除率则更低。
整体而言,泸州张坝和广州荔湾产地的龙眼核清除ABTS+自由基的能力高于泸州黄舣,且各产地龙眼核中石油醚部位的清除能力最强、乙酸乙酯部位次之。
4 讨论
试验采用5 种不同极性的溶剂对3 个主产地龙眼核的醇提物进行萃取,结果发现,其中2 个主产地干膏质量的大小均表现为正丁醇>乙酸乙酯>无水乙醇>水>石油醚,推测其原因可能与溶剂极性不同所溶解成分的总量不同有关,上述5 种溶剂中正丁醇极性较适中,其溶解成分的总量最多,随着溶剂极性的增大或减小能够溶解的成分总量有所减少,故而石油醚和去离子水的干膏质量最小。
本试验通过DPPH 法和ABTS+·法,对比考察了3 个产地的龙眼核不同极性部位的体外抗氧化作用。从整体上看,①不同产地间的比较:张坝的龙眼核清除DPPH 自由基的能力在石油醚、正丁醇和无水乙醇提取部位强于广州荔湾产区。张坝和荔湾两地龙眼核清除ABTS+自由基的能力则整体高于黄舣,其原因极可能与不同产地龙眼核中抗氧化活性成分的种类和含量不同有关,从而进一步导致不同产地间和同一产地内龙眼核不同极性部位的抗氧化作用不同。②不同极性部位间的比较:各极性部位中以乙酸乙酯部位清除DPPH 自由基的能力最强,而石油醚部位清除ABTS+自由基的能力则最强、乙酸乙酯部位次之,总体而言乙酸乙酯部位的抗氧化活性非常突出,该结果与文献报道[21,32]相一致,该文献指出龙眼核中的酚类抗氧化物质主要为小分子化合物,极性较小,易溶于乙酸乙酯有机溶剂,导致乙酸乙酯部分总酚含量最高。③不同自由基间的比较:同产地、同极性部位对2 种自由基表现出不同的清除能力,总体表现为对ABTS+自由基的清除能力强于对DPPH 自由基的清除能力,这可能与龙眼核抗氧化活性成分对不同自由基的敏感性及作用机理差异有关[21]。
5 小结
本研究结果表明,泸州张坝产地的龙眼核在体外抗氧化能力方面具有独特优势,虽拥有丰富的资源,但其药用价值并未得到充分利用,本研究结果可为当地龙眼核有效物质的考察和相关药物的开发奠定试验基础。

