基于网络药理学及分子对接探讨灵芝药理机制
陈姎玲,潘小芳,徐 浩,陈 睿,霍丽妮,梁 燕
(1.广西中医药大学药学院,南宁 530200;2.广西医科大学药学院,南宁 530021)
灵芝(Ganoderma lucidum)始载于《神农本草经》,别称瑞草、仙草、赤芝等,在中国存在两千多年的药用历史,其中紫芝和赤芝的子实体被《中华人民共和国药典(一部)》收录药用。灵芝是灵芝科灵芝属药食同源真菌,其味甘,性平,归心、肺、肝、肾经,具有止咳、平喘、补气、安神等功效[1,2],从古至今一直被用作促进身体健康、永葆青春活力、延年益寿的良药。现代科学研究发现灵芝具有抗氧化、抗衰老、抗病毒、抗肿瘤、保肝护肝和调节免疫等药理作用[3-5],其化学成分主要包含多糖类、三萜类、甾醇、蛋白质、氨基酸、核苷类等活性成分[6],目前已被广泛用于药品、保健品以及化妆品等领域[7]。由于传统中药化学成分较为复杂,且常具有多靶点协同作用的特点,难以从整体对其药理机制以及构效关系进行系统研究。近年来,从多成分、多靶点的角度出发,利用大数据系统深度挖掘和揭示中药的药理作用机制逐渐成为一种新趋势。
网络药理学(Network pharmacology)是由Hopkins[8]首次提出概念,其基于系统生物学及药理学范畴,通过构建化合物与基因、蛋白靶点和疾病等之间的相互作用网络,从整体性和系统性角度分析中药活性成分及相关药理机制[9,10]。网络药理学注重药物、靶点、疾病三者之间互相协同、互相作用,在一定程度上可以解决中药及复方研究中多成分、多靶点、协同作用特点带来的难题。因此,本研究借助网络药理学方法并结合分子对接技术,检索灵芝中的关键活性成分并对其相关靶点及信号通路进行预测分析,全面系统地对灵芝的主要活性成分及药理作用机制进行分析与挖掘,为科学研究活性成分、开发标准化功能性食品提供参考依据。
1 材料与仪器
1.1 网络平台
系统药理学数据库与分析平台(TCMSP)、Swiss target prediction(http://www.swisstargetprediction.ch/)平台、DAVID 6.8 数据库(https://david.ncifcrf.gov/)、Cytoscape 3.7.1 软件、RCSB 平台(https://www.rcsb.org/)、SYBYL2.0 软件。
1.2 方法
1.2.1 化学成分收集与活性成分筛选 通过重要系统药理学数据库与分析平台,检索灵芝所含的化学成分,共得到灵芝的化学成分242 个,再以口服生物利用度(Oral bioavailability,OB)≥40% 及类药性(drug-like,DL)≥0.18%为限制条件,筛选出灵芝的有效活性成分,这些成分可作为预测灵芝作用靶点的物质基础。
1.2.2 潜在作用靶点的收集 将筛选得到灵芝的活性成分以SMILE 格式逐个导入Swiss target prediction(http://www.swisstargetprediction.ch/)平台,将研究对象设为“Homo sapiens”,预测并整理相关化合物的潜在作用靶点,这些靶点将用于进一步构建靶点-生物通路间的相互作用网络。
1.2.3 GO 基因注释及KEGG 富集分析 运用DAVID 6.8 数据库(https://david.ncifcrf.gov/)对上述靶点蛋白进行基因本体(Gene ontology,GO)功能注释和京都基因与基因百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析。输入靶点信息后限定靶基因名称列表为“Human”,收集并整理数据,得到靶点在基因功能的富集情况和相关作用通路。
1.2.4 网络图谱构建与分析 使用Cytoscape 3.7.1软件将筛选得到的活性成分和靶点建立模型;根据DAVID 数据库中的分析结果,构建灵芝的活性成分-靶点-作用通路(Compound-Target-Pathways,CT-P)网络图。基于网络度(Degree)和介数(Betweenness)设置网络图节点的大小及颜色,以边连接活性成分与靶点以及靶点与通路间的作用关系,最终得到灵芝的活性成分、潜在的蛋白靶点以及通路的关系图谱。
1.2.5 分子对接验证 通过RCSB 平台(https://www.rcsb.org/)筛选并下载关键靶点蛋白,利用SYBYL 2.0 软件对配体小分子进行处理并构建关键蛋白的活性口袋,将活性成分和靶蛋白进行分子对接,得到对接后的对接得分(Total score),以预测二者的结合性能,进一步验证本研究结果的准确性。
2 结果与分析
2.1 活性成分的筛选
通过TCMSP 对灵芝化学成分进行筛选,共获得16 个活性成分,主要包括1 个多糖类化合物、8 个三萜类化合物及7 个甾体类化合物,分别为灵芝多糖B(MOL011172)、环氧灵芝醇B(MOL011172)、灵芝醛B(MOL011171)、Ganoderic aldehyde A(MOL011229)、灵芝酮醇(MOL011244)、赤芝醛A(MOL011266)、赤芝醛B(MOL011267)、赤芝醛C(MOL011268)、胆甾-7,22-二烯-3β-醇(MOL011137)、麦角甾-4,7,22-三烯-3,6-二酮(MOL011159)、(5R,10S,13R,14R,17R)-17-[(E,2R)-7-hydroxy-6-methylhept-5-en-2-yl]-4,4,10,13,14-pentamethyl-1,2,5,6,12,15,16,17-octahydrocyclopenta[a]phenanthren-3-one(MOL011251)、麦角甾-4,7,22-三烯-3,6-二酮(MOL011160)、麦角甾-7,22-二烯-3β-亚油酸酯(MOL011165)、麦角甾-7,9(11),22-三烯-3β,5α,6α-三醇(MOL011168)、过氧麦角甾醇(MOL011169)、麦角甾-7,22-二烯-3β-醇(MOL000282),它们均表现出较高的口服生物利用度和类药性,所有化合物OB均在40%以上,大部分化合物的DL在0.80%以上(表1)。灵芝能有效治疗急性肠炎、乳腺炎、肝炎等炎性疾病,多糖和三萜类化合物是灵芝抗炎的主要活性物质[11]。此外,灵芝中的三萜类化合物具有抗肿瘤、保肝护肝、降血脂和抗病毒等多种药理功效[12]。灵芝多糖还能改善胰岛细胞功能,抑制机体胰岛素抵抗[13],还能促进免疫细胞增殖随后增强机体免疫力[14],并在调节抗氧化功能方面存在重要作用[15]。林志彬[16]研究表明灵芝总甾醇以及灵芝多糖均可对抗缺氧再氧化过程对体外培养神经元的损伤,从而保护神经元的活性,由此表明,灵芝丰富的药理活性可能与这些三萜类、甾体类及多糖类成分有关。

表1 灵芝的活性成分
2.2 活性成分靶点筛选及成分-靶点模型构建
将筛选获得的16 个活性成分导入Swiss targetprediction 网站,预测出人源基因的相关蛋白靶点总数为240 个,包括63 个不同的蛋白靶点。运用Cytoscape 3.7.1 软件将筛选的16 个活性成分连接上述靶点,绘制得到成分-靶点(C-T)网络(图1),共包含79 个节点(16 个活性成分和63 个潜在靶点);左侧节点代表活性成分,右侧节点为靶点,活性成分与靶点的相互作用关系以线连接。在网络中,节点的网络度和介数值与节点的重要性呈正相关,节点的大小由其网络度决定,网络度越大,节点越大(表2),度数大的靶标蛋白可能是灵芝活性成分的核心靶点。

图1 活性成分-靶点网络
由图1、表2 可以看出,不同的化合物均对应不同靶点,其中,雄激素受体(Androgen receptor,AR)是灵芝中16 个活性成分的共有靶标;类固醇生成相关靶点CYP17A1、CYP19A1 均对应了灵芝的12 个活性成分;此外,有10 个活性成分均与重组人酪氨酰胺DNA 磷酸二酯酶1(TDP1)、重组人微管相关蛋白(MAPT)、肝X 受体(Liver X receptors,LXRs)(NR1H2、NR1H3)、糖皮质激素受体(NR3C1)和盐皮质激素受体(NR3C2)等靶点相关。其中,AR 属于核受体超家族中的类固醇受体,主要存在于靶细胞的核内,张子彦等[17]报道表明AR 的变异与前列腺癌有关,还具有刺激骨髓造血的功能,广泛用于再生性障碍性贫血的治疗。类固醇生成相关蛋白CYP17A1 和CYP19A1,是细胞色素P450(CYP)的2个亚型,CYP17A1 和CYP19A1 的基因多态性与恶性肿瘤的发生发展密切相关[18-20]。NRIH2 和NRIH3是肝X 受体2 种同源亚型,LXRs 参与机体胆固醇代谢和转运、脂肪形成、糖原异生和炎症等多种生理活动的调节,与心血管疾病如动脉粥样硬化、高血压、心肌肥厚、心肌纤维化等的发生发展密切相关[21]。此外,有研究证明LXRs 可通过调控一系列信号转导通路抑制癌细胞增殖、侵袭、诱导凋亡等,进而影响前列腺癌、乳腺癌、肝癌、黑色素瘤、白血病等多种恶性肿瘤的发生发展[22]。NR3C1 及NR3C2 基因多态性与心血管疾病以及一些癌症有关。TDP1 是一种关键酶,可通过水解30 个磷酸酪氨酸键来修复与拓扑异构酶I(Topoisomerase I,TOPO-I)相关的DNA断裂,因而TDP1 抑制剂常用来治疗肿瘤[23]。MAPT基因是最早被发现与额颞叶痴呆有关的致病基因[24]。通过对灵芝中的活性成分相关靶点的分析,灵芝中的灵芝多糖、三萜类及甾体类等活性成分发挥药理作用可能与这些核心靶点有关。
2.3 GO 和KEGG 富集分析
DAVID 为线上生物信息学分析数据库,帮助识别并获取大量的基因或蛋白质功能等信息[25]。为了阐明灵芝的药理作用机制,将上述得到的63 个潜在靶点导入DAVID 数据库,进行GO 基因功能注释分析和KEGG 通路富集分析,经GO 注释分析,共映射到116 个GO term,包括69 个生物过程(Biological process,BP)、16 个细胞组分(Cellular component,CC)和31 个分子功能(Molecular function,MF)。选择P<0.01,挑选出BP、CC、MF 共3 个部分最显著富集的15 个GO term,如图2 所示。其中,灵芝发挥药理活性的生物过程与腺苷酸环化酶抑制G 蛋白偶联乙酰胆碱受体信号通路(Adenylate cyclase-inhibiting G-protein coupled acetylcholine receptor signaling pathway)密切相关,而在细胞组分中与细胞连接(Cell junction)相关性最大,在分子功能中与蛋白激酶C 活性(Protein kinase cactivity)联系紧密。通过KEGG 富集分析结果,灵芝的活性成分潜在的63 个药效靶点共参与48 条信号通路,据此推测灵芝可通过多个靶点、不同生物通路协同发挥药效。根据所得通路P大小,得到最显著富集的通路15 条(图3),其中包括Steroid hormone biosynthesis(类固醇激素生物合成)、Vascular smooth muscle contraction(血管平滑肌收缩)、Calcium signaling pathway(钙信号通路)、Cholinergic synapse(胆碱能突触)、Pancreatic secretion(胰腺分泌)、Inflammatory mediator regulation of TRP channels(炎症介质对TRP 通道的调节)、Insulin resistance(胰岛素抵抗)、Aldosterone-regulated sodium reabsorption(醛固酮调节钠重吸收)、Endocrine and other factor-regulated calcium reabsorption(内分泌等因素调节钙再吸收)、Retrograde endocannabinoid signaling(逆行神经信号)等信号通路。以上分析结果进一步确定了与灵芝活性成分相关的作用通路,为其药理作用机制的进一步研究提供了参考方向。

图2 GO 富集分析(P<0.01)

图3 KEGG 通路富集分析
2.4 活性成分-靶点-通路(C-T-P)网络构建
根据KEGG 通路富集分析结果,利用Cytoscape软件中“Merge”工具建立灵芝“活性成分-靶点蛋白-通路”(C-T-P)网络模型,从而更直观地观察三者之间的作用关系。如图4 所示,16 个活性成分(方形内圆节点)共对应到37 个潜在作用靶点(方形外圆节点),涉及相关信号通路15 条(V 形节点),节点的网络度越大,节点越大,颜色越亮。根据C-T-P网络模型可知,灵芝的活性成分可作用在多个靶点,对应多条通路,其中网络中连接度排名前5 的活性成分为 MOL011169、MOL011229、MOL011266、MOL011171、MOL011157,连接度排名前8 的通路为Calcium signaling pathway(钙信号通路)、Cholinergic synapse(胆碱能突触)、Vascular smooth muscle contraction(血管平滑肌收缩)、Steroid hormone biosynthesis(甾类激素生物合成)、Neuroactive ligand-receptor interaction(神经活动配体-受体相互作用)、Insulin resistance(胰岛素抵抗)、Inflammatory mediator regulation of TRP channels(炎症介质对TRP 通道的调节)、Pancreatic secretion(胰腺分泌)。其中,钙信号通路中重要因子发生差异表达与阿尔茨海默病密切相关[26],血管平滑肌的收缩在多种血管病变的发生发展中发挥重要作用[27]。胰岛素抵抗与糖尿病有关,炎症介质对TRP 通道的调节涉及炎症相关疾病,甾类激素生物合成可调控许多至关重要的生长发育过程,神经活动配体-受体的相互作用与老年痴呆等神经类疾病有关,这些通路与灵芝具备的抗肿瘤、抗糖尿病、抗衰老和调节免疫等药理作用相关。
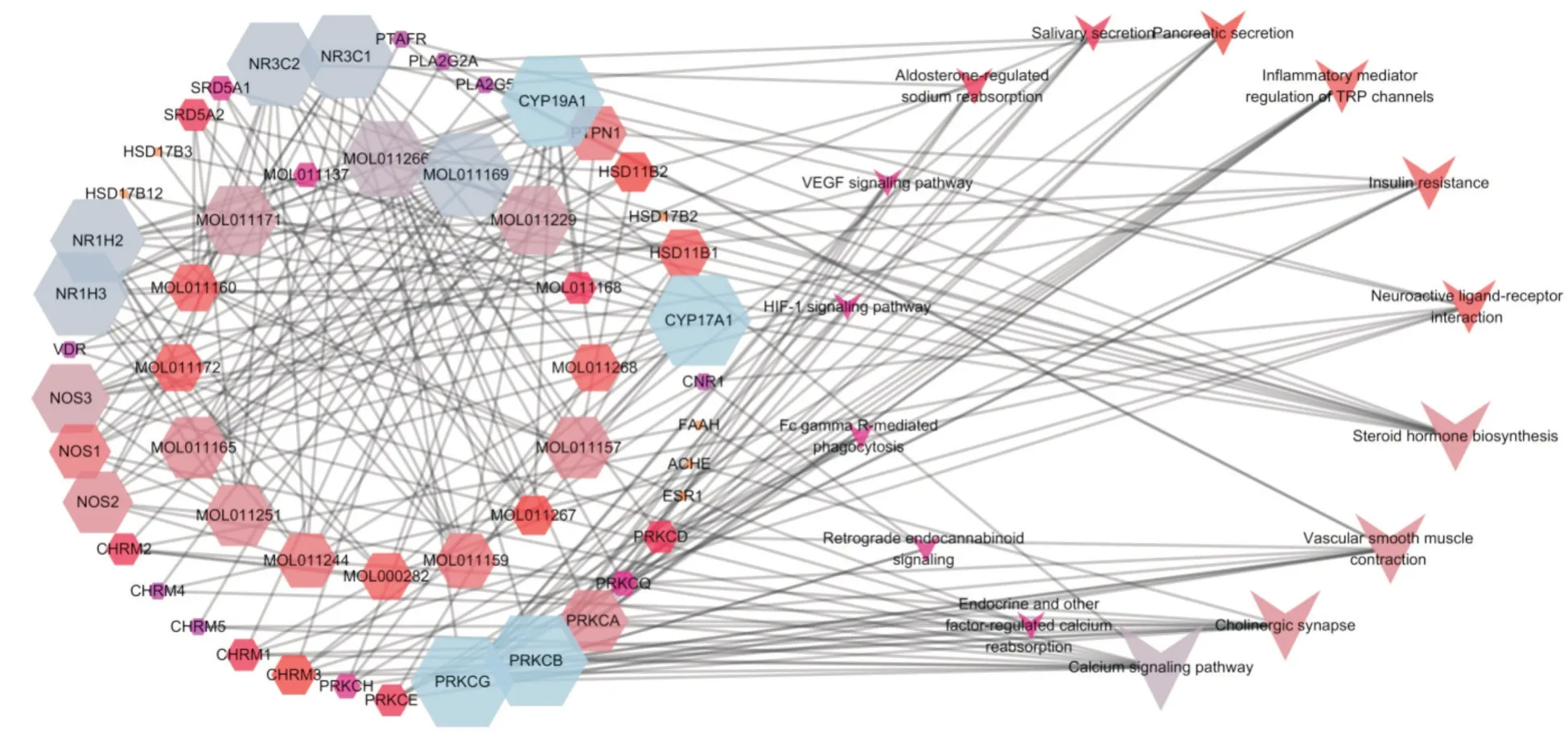
图4 活性成分-作用靶点-通路(C-T-P)的网络
2.5 分子对接验证
在药物设计领域,常利用计算机模拟结合及化学参数的运算技术实现受体-配体间的对接,进而预测出小分子化合物和大分子蛋白靶点的亲和能力及结合方式[28]。通过分子对接对GO 和KEGG 富集结果进行分析验证,用Surflex-Dock 对接得分结果评价配体和受体的结合能力,分数越高,则两者结合稳定性越好。当对接得分高于4.25 分时,说明灵芝活性成分与靶点拥有一定的结合能力;当对接得分高于5.00 分时,说明灵芝的活性成分与靶点的结合活性较好;当对接得分高于7 分时,灵芝的活性成分与蛋白靶点具有强烈的结合能力[28]。分子对接结果(表3)表明,灵芝中60%以上的活性成分与其核心靶点能够相互作用,且具有较好的结合活性,说明利用网络药理学方法预测结果的准确性较好。其中,麦角甾-7,22-二烯-3β-亚油酸酯与其关键靶点CYP17A1、HSD17B2、HSD11B1、HSD11B2、PTPM、PLA2G2A 等具有较高的结合能力,特别是与靶点HSD17B2的结合能力最高,其对接得分达12.169 7分。

图5 麦角甾-7,22-二烯-3β-醇亚油酸酯与HSD17B2 的分子对接
为进一步研究灵芝活性成分与潜在蛋白靶点的作用方式,以得分最高的化合物麦角甾-7,22-二烯-3β-亚油酸酯为代表,采用Ligplot 工具对其与靶点蛋白HSD17B2 的结合模式进行分析。对接结果(图5)表明,化合物整个甾体母核嵌入在活性口袋中,与Arg258、Leu262、Met47、Gly186、Pro187、Ser142、Lys159、Asn90、Thr140、Phe192、Gly92、Tyr155、Phe 226、Tyr218、Leu149、His221、Phe259、Val 225、Glu282 等多个氨基酸残基形成了强烈的疏水作用,因而麦角甾-7,22-二烯-3β-醇亚油酸酯与HSD17B2 形成的复合物稳定性较好,这也是该化合物与靶点HSD17B2 具备较好结合能力的原因。
3 小结
本研究利用网络药理学方法,通过构建C-T-P网络,考察灵芝在不同信号通路中的调节效应,以期揭示其分子可能的作用机制。研究结果表明,灵芝中三萜类、甾体类及多糖类成分是其发挥药效的物质基础,它们主要作用于CYP17A1、CYP19A1、NR1H2、NRIH3、PRKCG、PRKCB、HSD17B2、NO1、NO2、NO3、HSD17B12、HSD11B1、HSD11B2 等37 个关键靶点,参与血管平滑肌收缩、类固醇激素生物合成途径、胰岛素抵抗等15 个相关通路,这些靶点或通路与抗肿瘤、降糖、抗高血压等多种药理活性相关。本研究为促进传统药物灵芝的多维药理机制研究及其在食品领域的进一步研究开发奠定了良好基础。

