基于UiO-66-NH2与适配体之间荧光共振能量转移检测大米中的镉离子
程 静,齐珍丽,许 宙,丁 利,程云辉,陈茂龙
(长沙理工大学食品与生物工程学院,湖南 长沙 410114)
现代工业的迅速发展,引发了一系列的环境问题,包括大气污染、土壤污染和水源污染等。污染因素种类众多,其中重金属镉污染具有隐蔽性、长期性和累积性等特性[1],毒害效应短期难以察觉,但是通过食物链累积,即使浓度很低,它也能导致人体各种健康问题。如镉中毒会损害心血管和免疫系统,导致癌症、糖尿病、肾衰竭、肝功能衰竭,以及心脏病等致命疾病[2]。我国是世界第二大水稻粮食种植国,产量占国内粮食总产量的1/3以上,湖南省是人均大米消费量最高的省份[3]。研究发现水稻、小麦等粮食作物对镉有一定的富集能力,其中水稻更容易富集镉[4],对食用者的身体健康产生较严重危害。因此,必须开展对大米中重金属镉的检测研究,这对预防镉离子(Cd2+)的伤害具有积极意义。
Cd2+常用的传统检测方法有原子光谱法、电感耦合等离子体质谱法、冷蒸汽原子荧光光谱法和阳极溶出伏安法等,这些都是非常灵敏有效的检测方法,但价格昂贵且速度慢[5-6]。传统的检测方法已经无法满足社会的日常检测需求。本研究的目的是要创建一种更加简便、灵敏、准确、特异性强并方便实践应用的Cd2+实时传感分析方法,对满足当今日益增长的生产生活需要有较大意义。
近年来,荧光生物传感器由于其方便快捷、灵敏度高、选择性好等优点[7],引起了科学家的极大兴趣。本研究在此基础上开发一种以金属有机框架(metal-organic frameworks,MOFs)为荧光猝灭剂的新型荧光生物传感器。MOFs由于其多孔骨架结构[8]、可调节孔径[9]、比表面积大和良好的化学稳定性[10-11],在生物传感器[12]、生物医学[13]、电催化[14]、能量存储和转化[15]等领域得到了广泛的应用。特别是当它们与适配体功能化结合时,MOFs可用于构建高性能的生物传感器,应用范围从医疗诊断[16]、食品安全检测[17]到环境监测[18]。MOFs的均匀晶体结构、高比表面积及可调的孔结构,允许多种DNA、RNA和适配体附着或修饰,从而构建基于MOFs作为能量受体的荧光共振能量转移传感器。
本实验将MOFs中水稳定分散的UiO-66-NH2作为荧光猝灭剂,利用其较大的比表面积和孔隙率,通过荧光共振能量转移猝灭荧光标记的适配体,再利用Cd2+与适配体的特异性相互作用,恢复荧光,以此构建一款Cd2+荧光传感器,方法原理如图1所示。此方法构建的Cd2+荧光生物传感器具有简便易行、灵敏度较高、特异性强的优点。

图1 UiO-66-NH2/适配体生物传感器检测Cd2+的原理图Fig.1 Schematic diagram of UiO-66-NH2/aptamer biosensor for detecting Cd2+
1 材料与方法
1.1 材料与试剂
氨基对苯二甲酸、N,N-二甲基甲酰胺、乙酸、无水乙醇、九水合硝酸铝、六水合氯化镁、四水合乙酸钴、四水合乙酸镍、四水合硝酸镉、氯化钠、氯化钾、溴化钾国药集团化学试剂有限公司;四氯化锆 北京百灵威科技有限公司;二水合氯化钙、四水合氯化亚铁、三水合乙酸铅、五水合硫酸铜 西陇化工股份有限公司;六水合三氯化铁 上海阿拉丁生化科技股份有限公司;所有化学试剂均为分析纯。
荧光基团修饰的适配体 生工生物工程(上海)股份有限公司。适配体序列[19]:5’-6-FAM-CTC AGG ACG ACGGGT TCA CAG TCC GTT GTC-3’。
1.2 仪器与设备
Nicolet 670傅里叶变换红外光谱仪 美国Thermo公司;F96PRO荧光分光光度计 上海棱光技术有限公司;Rigaku Smartlab 9粉末X射线衍射(powder X-ray diffraction,PXRD)仪 日本理学株式会社;Quanta 400 FEG高分辨热场发射扫描电子显微镜 美国FEI公司;Zetasizer nano激光粒度仪 英国Malvern公司。
1.3 方法
1.3.1 材料的制备
根据文献[20]的方法合成UiO-66-NH2;根据文献[21]的方法合成ZIF-8。
MIL-101合成根据文献[22]方法,并进行一定修改。将Cr(NO3)3·9H2O、对苯二甲酸、HF、超纯水混匀并超声15 min,最后均溶于100 mL反应釜中,于220 ℃烘箱中反应12 h。冷却离心(6000 r/min,8 min),并且用超纯水、乙醇洗涤,70 ℃真空干燥过夜,得到浅绿色的粉末。
适配体溶液母液的配制:适配体开盖前先离心(4000 r/min,30~60 s),每吸光度的引物加33 μL的Tris-HCl(pH 7.42)缓冲液配制成100 μmol/L贮存液,混匀后-20 ℃冷藏待用。
1.3.2 检测条件的优化
在完整的检测体系下,适配体浓度分别设置为0.1、0.2、0.3 μmol/L和0.4 μmol/L,根据荧光强度选择合适的适配体浓度。并且在不加入目标物Cd2+的条件下,UiO-66-NH2的终质量浓度分别设置为0.01、0.02、0.04、0.06、0.08、0.10、0.20、0.40、0.60、0.80 mg/mL和1.0 mg/mL,通过测定518 nm波长处荧光的猝灭强度,以确定最适UiO-66-NH2浓度。根据已报道文献将所使用的NaCl浓度设置区间在80~150 mmol/L之间,考察在不同浓度下荧光恢复强度。设置不同的孵育温度(4、15、25、37 ℃)和孵育时间(10、20、40、60、80、100、120 min),以探究目标物在不同温度和不同时间下与适配体结合后荧光恢复情况。
1.3.3 检测方法的建立
通过Cd2+适配体和UiO-66-NH2纳米颗粒通过配位结合制备UiO-66-NH2纳米颗粒Cd2+传感器。适配体溶液稀释至2.0 μmol/L,贮存在4 ℃的冰箱以待后续使用,将100 µL浓度为2.0 μmol/L的Cd2+适配体添加到质量浓度为0.2 mg/mL的UiO-66-NH2纳米颗粒中,混合均匀,并在室温下孵育0.5 h。然后将混合物离心(2000 r/min、1 min)以从混合物中除去未结合的适配体,最后将UiO-66-NH2/适配体传感器分散在缓冲液中。
配制不同浓度的Cd2+标准溶液(pH 7.4),并储存在4 ℃冰箱中。加入100 µL 2.0 mg/mL UiO-66-NH2溶液,加入100 µL不同浓度的Cd2+适配体标准液,加入700 µL Tris-HCl(pH 7.42)缓冲溶液后混匀,25 ℃孵育100 min后,然后测定样品的荧光强度(适配体终浓度200 nmol/L,UiO-66-NH2终质量浓度0.2 mg/mL)。
荧光检测条件为微量石英比色皿,激发波长480 nm,发射波长500~700 nm,扫描速率1000 nm/min,狭缝宽度10 nm。
1.3.4 实际样品检测
水样的前处理:取自来水水样,采集完后用0.22 μmol/L的水系滤膜过滤,然后用火焰原子吸收光谱测其Cd2+含量,用1%硝酸溶液酸化,置于干净的容量瓶中,4 ℃冰箱冷藏待用。
大米样品的前处理:镉测定参考GB 5009.15-2014《食品中镉的测定》。
加标样的制备:向25.0 mL处理后的自来水和大米样中分别加入Cd2+标准溶液,得到终浓度为50、500 nmol/L的Cd2+待检测样品。
2 结果与分析
2.1 材料的筛选
首先选择3 种不同金属中心构成的MOFs,通过测定UiO-66-NH2、MIL-101(Cr)、ZIF-8三款材料的粒径和电荷性质。如图2所示,最终选择粒径适宜、带正电荷数值更大的UiO-66-NH2开展后续检测研究。

图2 MIL-101(Cr)、ZIF-8、UiO-66-NH2的总粒径(a)和总电位(b)图Fig.2 Total particle size (a) and total potential (b) of MIL-101(Cr),ZIF-8,and UiO-66-NH2
2.2 材料的结构表征
通过红外光谱(图3a)可以确定金属与配体已经完全配位,对比已报道的文献[23],—NH2特征振动峰群出现在3471 cm-1和3350 cm-1,在1656、1579 cm-1显示羧基与Zr的配位,说明UiO-66-NH2材料的合成成功。如图3b所示,考察UiO-66-NH2的孔径大小和BET比表面积(约为513 m²/g)。为观察UiO-66-NH2的形貌,通过扫描电镜对样品进行观察(图3c)表明,UiO-66-NH2具有较好的八面体结构,结合PXRD图可以说明UiO-66-NH2的成功合成。UiO-66-NH2单晶模拟的PXRD峰形与实际合成的PXRD峰形(图3d),主要的衍射峰位置都保持一致且较尖锐,表明材料合成成功且结晶性好。

图3 UiO-66-NH2的红外光谱图(a)、N2吸附等温线图(77 K)(b)、扫描电镜图(c)和PXRD图(d)Fig.3 IR spectrum (a),N2 adsorption isotherm (77 K) (b),scanning electron micrograph (c) and power X-ray diffraction pattern (d) of UiO-66-NH2
2.3 传感体系的构建
由于6-FAM标记的荧光适配体带负电荷,为验证适配体成功吸附在UiO-66-NH2上,通过测定混合体系以及UiO-66-NH2的粒径和电位变化(图4),发现UiO-66-NH2与适配体在缓冲溶液中结合后,适配体的负电荷会与UiO-66-NH2的正电荷相互抵消,电位从8.56 mV降低至1.01 mV,粒径从332 nm增加至377 nm。水合粒径增大及电位变小说明适配体已经成功吸附至UiO-66-NH2上,表明UiO-66-NH2/适配体传感体系构建成功。

图4 UiO-66-NH2和UiO-66-NH2/适配体的粒径(a)和电位(b)变化图Fig.4 Changes in particle size (a) and potential (b) of UiO-66-NH2 and UiO-66-NH2/aptamer
2.4 检测条件的优化
在利用荧光标记适配体与UiO-66-NH2构建传感器时,根据其实验原理,发现UiO-66-NH2浓度、适配体浓度、盐浓度等对荧光强度都有较大的影响。因此对反应条件进行优化,以确定获得最佳检测性能。主要包括适配体浓度、UiO-66-NH2质量浓度、盐浓度、孵育温度与时间。
2.4.1 适配体浓度的优化
因此本研究测定100、200、300 nmol/L和400 nmol/L浓度下适配体的荧光强度,如图5所示,随着浓度的增加,荧光强度也随之增强。虽然荧光强度越高,越符合检测条件,但是过高的荧光则会减弱低浓度Cd2+的荧光恢复水平,且需要用的适配体量就会随之增大,成本就会增加。因此,选择200 nmol/L作为适配体最终浓度。

图5 不同浓度下的适配体荧光光谱图Fig.5 Fluorescence spectra of aptamers at different concentrations
2.4.2 UiO-66-NH2质量浓度的优化
MOFs作为检测体系的荧光猝灭剂,UiO-66-NH2质量浓度的选择也有着至关重要的作用。如图6所示,UiO-66-NH2质量浓度越大,猝灭荧光适配体的效果越强。因此可以确定在518 nm波长处荧光基本消失时为最适UiO-66-NH2质量浓度,所以选择0.2 mg/mL为UiO-66-NH2最终质量浓度。

图6 不同质量浓度UiO-66-NH2猝灭适配体荧光光谱(a)和荧光强度变化(b)图Fig.6 Fluorescence spectra (a) and fluorescence intensity change (b) of UiO-66-NH2-quenching aptamer at different concentrations
2.4.3 NaCl浓度的优化
Na+可以中和适配体的电荷,减少其静电斥力[24]。因此,NaCl的加入有利于适配体与Cd2+之间形成特定的空间结构[25]。本实验研究传感体系中的离子强度与荧光强度之间的关系。如图7所示,传感体系的荧光强度在100 mmol/L时出现最高值。随着NaCl浓度的增加,荧光强度下降,说明Na+浓度过高会阻碍Cd2+与适配体的结合,不利于荧光的恢复。因此,选择含有100 mmol/L的NaCl Tris-HCl开展后续实验。

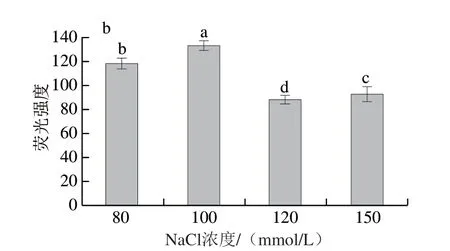
图7 不同浓度NaCl孵育条件下传感体系的荧光光谱(a)和荧光强度变化(b)图Fig.7 Fluorescence spectra (a) and fluorescence intensity change (b) ofthe sensor system under different concentrations of NaCl
2.4.4 孵育温度的优化
温度不同会影响适配体与目标物Cd2+的结合,进而影响传感体系中荧光的恢复值[26],如图8所示,考察在4、15、25 ℃和37 ℃条件下的荧光恢复强度,发现在25 ℃的荧光恢复最好,4 ℃荧光强度恢复最差。主要原因在于25 ℃适配体与目标物Cd2+的结合效果最好,这区别于已经报道的相关文献[27-28],可能原因在于UiO-66-NH2本身具有一定的孔径和吸附能力,温度越高,吸附能力越强。因此选择25 ℃作为最后的孵育温度。

图8 不同温度孵育条件下传感体系的荧光光谱(a)和荧光强度变化(b)图Fig.8 Fluorescence spectra (a) and fluorescence intensity change (b) of the sensor system at different incubation temperatures
2.4.5 孵育时间的优化
孵育时间是特定空间结构形成寡核苷酸适配体和帽子之间的主要影响因素[29]。如图9所示,荧光强度随着孵育时间10~100 min的增加而增强,然后100~120 min趋于平稳。结果表明100 min作为最终孵育时间,荧光恢复效果最好。

图9 不同孵育时间下传感体系的荧光光谱(a)和荧光强度变化(b)图Fig.9 Fluorescence spectra (a) and fluorescence intensity change (b) of the sensor system at different incubation times
2.5 传感体系对Cd2+检测的性能分析
记录不同浓度Cd2+的荧光发射光谱,结果如图10所示,传感体系的荧光强度随着Cd2+浓度的增加而逐渐增大。在10~10000 nmol/L范围内,传感体系的荧光强度与Cd2+浓度呈良好的线性关系,相关系数R2=0.977。该方法所得检出限为:
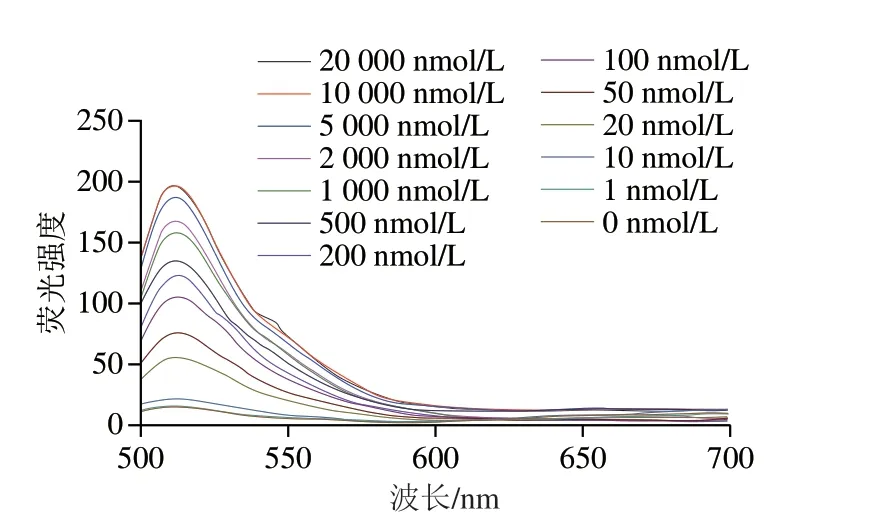
图10 加入不同浓度Cd2+后的荧光光谱图Fig.10 Fluorescence spectra of the sensor at different Cd2+ concentrations
式中:Y为518 nm波长处的荧光强度;X为Cd2+浓度;Sb为测定20 次空白实验后的方差;K为式(1)中斜率;LOD为检出限,计算得为0.107 nmol/L。由于重金属Cd2+的特性与严重危害力,与其他生物小分子相比,Cd2+与适配体结合的作用力相对更弱。对比已经报道的荧光传感器,线性范围较大,检出限较低,具有一定的优势(表1)。

表1 Cd2+检测方法的比较Table 1 Comparison of this method with other methods for detecting cadmium ion
2.6 金属离子检测特异性分析
由于实际检测中往往是多种金属离子共同存在,对于离子探测材料来说,其探测的抗干扰性也会受到影响,为了排除其他离子对检测的影响,本实验考察在其他金属离子作用下,传感体系的选择能力。如图11所示,在Al3+、Ca2+、Co2+、Cu2+、Fe2+、K+、Mg2+、Na+、Ni2+、Pb2+、Zn2+和Fe3+存在的情况下,传感体系的荧光基本无变化,表明该传感体系对Cd2+具有较好的选择特异性。
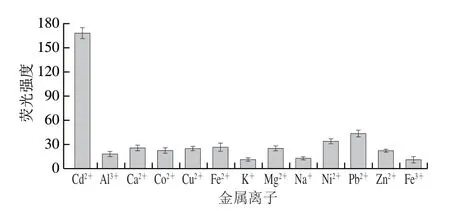
图11 荧光检测Cd2+选择性实验Fig.11 Selectivity for fluorescence detection of Cd2+
2.7 实际样品中Cd2+的检测
为验证本研究方法的实用性,通过对自来水和大米样品中分别添加50 nmol/L和500 nmol/L的Cd2+标准溶液,进行加标回收实验,通过计算统计得到的结果如表2所示。大米样品中加标回收率略高于水样,可能是由于实际的样品中大米中的Cd2+不仅存在于表面也存在于大米颗粒内部[34]。加标回收率在91.14%~107.98%之间。结果证明,本研究构建的荧光传感器可以用作实际样品中Cd2+的检测。
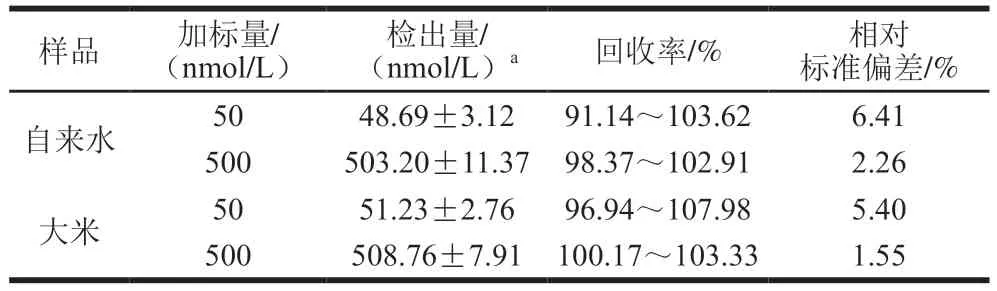
表2 传感体系对实际样品中Cd2+的检测Table 2 Results of detection of Cd2+ in actual samples by the sensor system
3 结论
本实验利用UiO-66-NH2材料与Cd2+适配体构建了一款Cd2+荧光生物传感器,最优条件下,在0.01~10 μmol/L范围内,传感体系的荧光强度与Cd2+浓度呈良好的线性关系;该生物传感器对Cd2+具有良好的选择特异性,并能对实际样品水和大米中的Cd2+有较好的检出能力。本方法较经济、简便易行,为重金属Cd2+的检测提供了新方法。更重要的意义在于通过更换适配体序列即可方便构建出其他重金属离子的检测方法,值得扩展研究。

