4 种真菌发酵对三七叶化学成分及药理活性的影响
杨金梅,李云嵌,何霞红,王振兴,*
(1.西南林业大学 西南山地森林资源保育与利用教育部重点实验室,云南 昆明 650224;2.西南林业大学林学院,云南 昆明 650224;3.西南林业大学生命科学学院,云南 昆明 650224)
三七(Panax notoginseng)为我国传统名贵植物,为五加科(Araliaceae)人参属,主要分布于我国云南文山、广西、广东、福建等地[1]。三七的叶、果以及根茎均可药用,其味甘、微苦,性温,现代药理研究表明,三七具有镇痛、抗炎、保肝利胆、抗心律失常、抗血栓等作用[2]。三七叶是云南当地特色食品,具有与根部相似的药用价值。研究表明三七叶富含皂苷、总黄酮、多酚、多糖等活性成分[3],具有活血化瘀、止痛消炎、促进消化等多种功能活性[4-6]。但是目前对于三七叶的开发利用较少,只有三七叶茶、粉等产品,造成严重的资源浪费,因此迫切需要加大对三七叶的开发利用。
利用食用真菌或细菌发酵是对植物基食品进行增效加工的有效手段之一,在发酵过程中,微生物发酵可作用于植物中多糖、蛋白质等成分[7],促进有效成分的释放,同时将难于吸收的大分子代谢成小分子[8],增加植物有效成分的含量[9],或者可将低活性有效成分转化为高活性有效成分,具有无污染、酶活性高、转化率高、成本低、周期短、可以实现工业化等优点[10]。目前已有利用食用微生物进行发酵三七叶的相关研究,如张媛媛等[11]通过凝结芽孢杆菌发酵三七叶茶,发现发酵可以提高三七叶的总皂苷含量,提高其1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基和2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)阳离子自由基清除能力。陈红惠等[12]发现经黑曲霉发酵后的三七叶茶具有较好的抗氧化能力。Yang Min等[13]发现酿酒酵母和枯草芽孢杆菌共发酵三七叶后,其皂苷、酚酸、黄酮类化合物等活性物质含量显著增加,并表现出良好的抗氧化活性。此外,益生菌发酵对三七叶中主要活性成分皂苷具有一定的转化作用,如Li Fei等[14]利用真菌Cordyceps sinensis和Ascomycotasp.将常见人参皂苷Rb1转化为稀有人参皂苷Rg3和CK。Liu Chunying等[15]发现黑曲霉能将原人参二醇型皂苷Rb1、Rb2、Rc和Rd转化为稀有人参皂苷CK。相对细菌而言,真菌对皂苷的转化时间更短,转化率更高,其产物中功能性较强的人参皂苷Rg3、Rg2和CK含量更高[16]。但这些研究主要是利用单一菌株或者复合菌株对三七叶进行发酵,有必要针对不同菌株对三七叶的发酵性能进行比较,从而筛选出适合三七叶发酵的优质菌株。
米根霉(Rhizopusoryzae)、粗糙脉孢菌(Neurosporo crassa)、红曲霉(Monascus)和鲁氏毛霉(Mucor rouxianus)是食品领域常用的4 种真菌,其中米根霉具有发达的淀粉和蛋白酶系,是药和酒曲中的优势菌种,在我国传统发酵中十分重要[17];粗糙脉孢菌高产纤维素酶、漆酶和多种消化酶,适合于发酵含纤维素较高的木本植物[18];红曲霉在我国已有1000多年的食品发酵历史,其能利用多种糖类和酸类、有机氮等,生成多种蛋白酶、淀粉酶等初级代谢产物和红曲色素、抗菌素等次生代谢产物[19];鲁氏毛霉是一种接合菌纲真菌,主要用于食品发酵,其分解纤维素的能力较强[20]。考虑到三七叶含有丰富的多糖、蛋白、纤维等成分[21],本研究选用上述4 种真菌对三七叶进行发酵,研究其化学成分和功能活性的变化,筛选出对三七叶功能活性增效最明显的菌株,并分析其发酵过程中的代谢物变化,以探讨其发酵机制。旨在为三七叶发酵食品的菌株选择提供参考,并为三七叶的开发利用提供理论基础。
1 材料与方法
1.1 材料与试剂
三七叶,2021年11月采收于云南省昆明市寻甸县羊街镇丰乐林下三七种植基地,经西南林业大学植物学教研室戚建华副教授鉴定为三七的叶子,真空冷冻干燥,粉碎并过40目筛,-20 ℃保存。叶片椭圆形或倒卵形,长约5~9 cm,宽约2~5 cm。粗糙脉孢菌经本实验室从发酵豆腐渣中分离纯化所得;米根霉(CICC 3037)、红曲霉(CDMCC 3.438)、鲁氏毛霉(CICC 40933)购自广东省微生物菌种保藏中心。
没食子酸、D(+)-无水葡萄糖、阿卡波糖、ABTS、对硝基苯基-α-D-吡喃葡萄糖苷(4-nitrophenyl-α-Dglucopyranoside,PNPG)、水溶性VE(Trolox)、三七总皂苷 上海源叶生物科技有限公司;芦丁、2,4,6-三(2-吡啶基)三嗪(2,4,6-tripyridin-2-yl-1,3,5-triazine,TPTZ)上海阿拉丁生化科技股份有限公司;DPPH西格玛奥德里奇(上海)贸易有限公司;α-葡萄糖苷酶(700000 U/mL)北京索莱宝科技有限公司;乙腈、甲醇、甲酸(均为色谱级)美国Millipore公司;氨水(色谱级)德国Merck公司;其余试剂均为国产分析纯。
1.2 仪器与设备
FD-304箱式真空冷冻干燥机 济南骏德仪器有限公司;XINYI-IID超声波粉碎机、SB-400DTY超声波清洗机 宁波新艺超声设备有限公司;BSA224S电子天平赛多利斯科学仪器(北京)有限公司;Infinite F50酶标仪帝肯贸易有限公司(上海);Nexera X2 LC-30AD超高效液相色谱系统 日本岛津公司;Q Exactive plus质谱仪美国赛默飞世尔科技公司;Concentrator plus真空离心浓缩仪 艾本德中国有限公司。
1.3 方法
1.3.1 菌种活化与培养
将米根霉、粗糙脉孢菌、红曲霉和鲁氏毛霉分别接种于马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基上,25 ℃恒温培养[22]。待菌种长满平板后,用打孔器打取已活化好的菌种并接种到PDA液体培养基中,得到浓度为1×105个/mL的菌悬液[23]。
1.3.2 样品及发酵液制备
取4 g三七叶粉末,加100 mL蒸馏水,121 ℃高压蒸汽灭菌15 min,冷却至室温后,接种4 mL浓度为1×105个/mL的菌悬液,于28 ℃、150 r/min摇床中培养10 d,每隔24 h等体积取样一次,取样后置于4 ℃冰箱中停止发酵,并将所有样品保存在-20 ℃冰箱备用[13]。在不含菌种的三七叶溶液中取样,作为空白对照,即为第0天发酵液。随后,加入无水乙醇使发酵液中乙醇的体积分数为80%,然后置于50 ℃水浴超声(160 W,40 kHz)提取2 h,离心后取上清液置于-20 ℃冰箱[24]。
1.3.3 总皂苷含量测定
采用香草醛-高氯酸-冰乙酸法[25]测定。40 μL样品溶液,于80 ℃恒温水浴锅中蒸干溶剂后加入20 μL 5%香草醛-冰乙酸溶液和80 μL高氯酸,60 ℃水浴15 min,冰浴5 min后加入200 μL冰乙酸停止反应,在540 nm波长处测定吸光度。在同等条件下测定质量浓度分别为50、100、150、200、250、300 µg/mL三七总皂苷溶液的吸光度,绘制标准曲线,得到公式Y=1.7768X+0.0586(R2=0.995),根据公式计算总皂苷含量。
1.3.4 总多糖含量测定
采用苯酚-硫酸法[26]测定总多糖含量。50 µL样品溶液,加入50 µL 5%苯酚溶液,随后缓慢加入250 µL浓硫酸,40 ℃水浴恒温10 min,冷却至室温,于490 nm波长处测定吸光度。在同等条件下测定质量浓度分别为20、40、60、80、100、150、200 µg/mL的D(+)-无水葡萄糖溶液的吸光度,绘制标准曲线,得到公式Y=4.818X+0.2156(R2=0.9915),根据公式计算总多糖含量。
1.3.5 总酚和总黄酮含量测定
采用福林-酚法[27]测定总酚含量。取50 µL样品溶液,加入125 µL 0.1 mol/L福林-酚溶液,最后加入100 µL 75 g/L碳酸钠溶液,避光反应30 min后,于765 nm波长处测定吸光度,以100 µL蒸馏水代替碳酸钠溶液作对照组。同等条件下测定没食子酸质量浓度为10、20、40、60、80、100 µg/mL时的吸光度,并绘制没食子酸标准曲线,得到公式Y=0.009X+0.0365(R2=0.9978),根据公式计算总酚含量。
采用NaNO2-Al(NO3)3-NaOH法[28]测定总黄酮含量。取40 µL样品溶液,加入20 µL 50 g/L亚硝酸钠溶液,室温反应6 min,加入20 µL 100 g/L硝酸铝溶液,室温反应6 min,加入140 µL 40 g/L氢氧化钠溶液,室温反应15 min后,于510 nm波长处测定吸光度。80%乙醇溶液代替相应的试剂为对照组。同等条件下测定芦丁质量浓度为20、40、60、80、100 µg/mL时的吸光度,并绘制芦丁标准曲线,得到公式Y=0.0013X-0.0103(R2=0.9921),根据公式计算总黄酮含量。
1.3.6 体外抗氧化活性测定
1.3.61 DPPH自由基清除能力
参照Xiao Yecheng等[29]的方法测定不同发酵液的DPPH自由基清除活性,并作适当修改。适宜浓度100 µL样品溶液,加入100 µL DPPH自由基溶液,混匀,室温避光反应30 min,于517 nm波长处测定吸光度,其中,以80%乙醇溶液代替DPPH自由基溶液作为对照组。VC和2,6-二叔丁基-4-甲基苯酚(butylated hydroxytoluene,BHT)为阳性对照。以Trolox为标准品,绘制标准曲线,得到公式Y=-0.0197X+0.8968(R2=0.9906),计算样品的Trolox当量,结果以其与第0天发酵液DPPH自由基清除能力的比值表示(相对能力/%)。
1.3.62 ABTS阳离子自由基清除能力
参照Tao Liang等[30]的方法,并作适当修改。将7 mmol/L ABTS和140 mmol/L过硫酸钾溶液混合,室温避光反应12~16 h,制得ABTS阳离子自由基储备液,后稀释至其吸光度在734 nm波长处为0.7±0.2,可得ABTS阳离子自由基工作液。取50 µL适宜浓度的样品溶液于酶标板中,加入200 µL ABTS阳离子自由基工作液,室温避光反应6 min后于734 nm波长处测吸光度。VC和BHT为阳性对照。其中,以80%乙醇溶液代替ABTS阳离子自由基溶液作为对照组。以Trolox为标准品,得到公式Y=-0.0089X+0.7406(R2=0.9933),根据公式计算,计算样品的Trolox当量,结果以其与第0天发酵液ABTS阳离子自由基清除能力的比值表示(相对能力/%)。
1.3.63 铁离子还原能力
参照Xu Xiaoyan等[31]的方法测定样品的铁离子还原能力(ferric ion reducing antioxidant power,FRAP)。分别配制30 mmol/L pH 3.6的乙酸缓冲溶液、10 mmol/L TPTZ工作液及20 mmol/L的FeCl3溶液,将3 种溶液以体积比10∶1∶1混匀即得到FRAP工作液。取50 μL样品溶液于酶标板中,加入250 μL FRAP工作液,37 ℃水浴恒温10 min后在593 nm波长处测定吸光度。其中,80%乙醇溶液代替FRAP工作液作为对照组。同等条件下测定硫酸亚铁的吸光度,绘制标准曲线,得到公式Y=0.0056X+0.0206(R2=0.9929),根据公式计算,结果以其与第0天发酵液相应FRAP的比值表示(相对能力/%)。
1.3.7α-葡萄糖苷酶抑制能力测定
参照Amirah等[32]的方法,略修改。50 µL样品溶液中加入25 µL 0.2 U/mLα-葡萄糖苷酶溶液(磷酸缓冲液配制),37 °C水浴恒温10 min,后加入50 µL 5 mmol/L PNPG溶液,37 ℃下水浴恒温15 min后,加入100 µL 0.2 mol/L碳酸钠溶液终止反应,并在405 nm波长处测定吸光度(A)。其中,以蒸馏水代替α-葡萄糖苷酶溶液作为对照组(A0),以80%乙醇溶液代替样品溶液作为空白对照(A1)。以阿卡波糖为阳性对照。按下式计算α-葡萄糖苷酶抑制率:
1.3.8 代谢组学分析
米根霉、粗糙脉孢菌、红曲霉和鲁氏毛霉发酵后,综合比较三七叶化学成分和体外抗氧化活性及抑制α-葡萄糖苷酶能力的变化情况,并筛选得到对功能活性增效最强的菌株,对该菌株发酵后的代谢物做进一步分析。
代谢物提取[33]:样品置于4 ℃解冻后吸取3 mL液体样品于离心管中,冻干后加入1 mL甲醇-水溶液(4∶1,V/V)混匀,冰浴超声30 min,于-20 ℃静置2 h,然后于4 ℃、16000×g离心20 min,取上清液。将上清液在高速真空浓缩离心机中挥干,加入100 μL甲醇-水溶液(1∶1,V/V)复溶,4 ℃、20000×g离心20 min,取上清液用于质谱分析,同时从每个样品中取等体积样品,混匀制备QC样品,以验证系统的稳定性和可重复性。
超高效液相色谱条件[34]:Waters ACQUITY UPLC®HSS T3色谱柱(2.1 mm×100 mm,1.8 µm);柱温40 ℃;流速0.3 mL/min;进样量4 μL。整个分析过程样品一直置于4 ℃自动进样器中。梯度洗脱程序如表1所示。

表1 梯度洗脱过程Table 1 Gradient elution procedure
质谱条件[35]:样品采用电喷雾电离(electrospray ionization,ESI)进行正离子和负离子模式检测。喷雾电压正离子模式为3800 V,负离子模式为3200 V;离子传输管温度为320 ℃;母离子扫描范围为m/z7~1050。
数据处理:原始数据采用MSDIAL软件进行峰对齐、保留时间校正和提取峰面积。代谢物结构鉴定采用精确质量数匹配(质量偏差<0.02‰)和二级谱图匹配(质量偏差<0.02 Da)的方式,检索HMDB、MassBank等公共数据库及自建数据库。对提取得到的数据,删除组内缺失值>50%的离子峰;对正负离子数据分别进行总峰面积归一化,整合正负离子峰并应用R软件进行模式识别,数据经Unit variance scaling预处理后,进行后续数据分析。
1.4 统计分析
所有实验3 次重复,使用Origin 2018和SPSS进行数据统计、分析、绘图。P<0.05,差异显著。利用OmicStudio云平台(https://www.omicstudio.cn/tool)和欧易集团云平台(https://cloud.oebiotech.cn/task/)进行热图、火山图、相关性以及主成分分析(principal component analysis,PCA)。
2 结果与分析
2.1 发酵对总皂苷含量的影响
由图1可知,不同菌株对三七叶总皂苷的影响存在显著差异,其中随着发酵时间的延长,米根霉、粗糙脉孢菌和鲁氏毛霉发酵的三七叶皂苷含量均呈现先降低后升高然后又降低的趋势,而红曲霉则是先降低后升高。除米根霉外的3 种真菌发酵后的总皂苷含量均低于未发酵样品,原因可能是由于皂苷发酵过程中转化成了稀有人参皂苷,导致总皂苷含量降低[36]。陈红惠等[12]同样发现黑曲霉发酵可使三七叶中皂苷含量先增加后下降,原因是极性较低的稀有皂苷含量有所增加。闫炳雄等[37]报道了黑曲霉可以高效地转化三七药材中的皂苷类成分,且伴有几种稀有人参皂苷和三七皂苷的生成。而米根霉发酵4 d后,其总皂苷含量从未发酵的170.19 mg/g增加到187.31 mg/g,原因可能是三七叶木质部细胞的细胞壁被米根霉产生的某些纤维素酶水解,提高了皂苷提取率[38]。

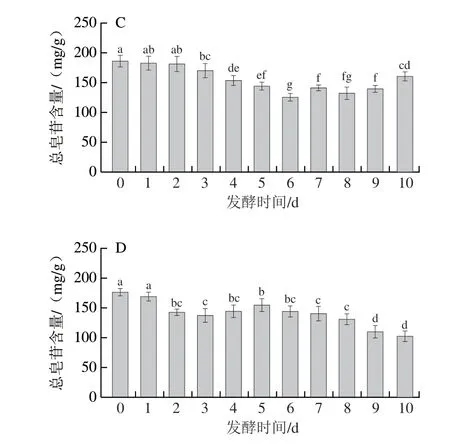
图1 真菌发酵对总皂苷含量的影响Fig.1 Effect of fungal fermentation on total saponin content
2.2 发酵对总多糖含量的影响
如图2所示,随着发酵时间的延长,4 种真菌发酵后的总多糖含量均明显降低,其原因可能是微生物在生长过程中,需要不断地消耗多糖等营养物质[36]。进入发酵后期,菌种活力下降,减少了对糖类的利用[39]。与梅玉立等[40]研究结果一致。

图2 真菌发酵对多糖含量的影响Fig.2 Effect of fungal fermentation on polysaccharide content
2.3 发酵对总酚和总黄酮含量的影响
由图3可知,米根霉、粗糙脉孢菌和红曲菌在发酵7~10 d后使三七叶的总酚含量分别提高40.4%、17.66%、8.1%;而鲁氏毛霉发酵却使三七叶总酚含量显著下降。经研究发现,不同菌种、发酵时间和发酵方式会造成发酵前后总酚含量的不同[41-42]。张媛媛等[11]研究发现三七叶茶经凝结芽孢杆菌发酵后,其醇提物的总酚和总黄酮含量显著降低。陈红惠等[12]研究发现三七叶发酵茶经黑曲霉发酵后,其多酚含量显著降低,黄酮含量在发酵第15天达到最大值。
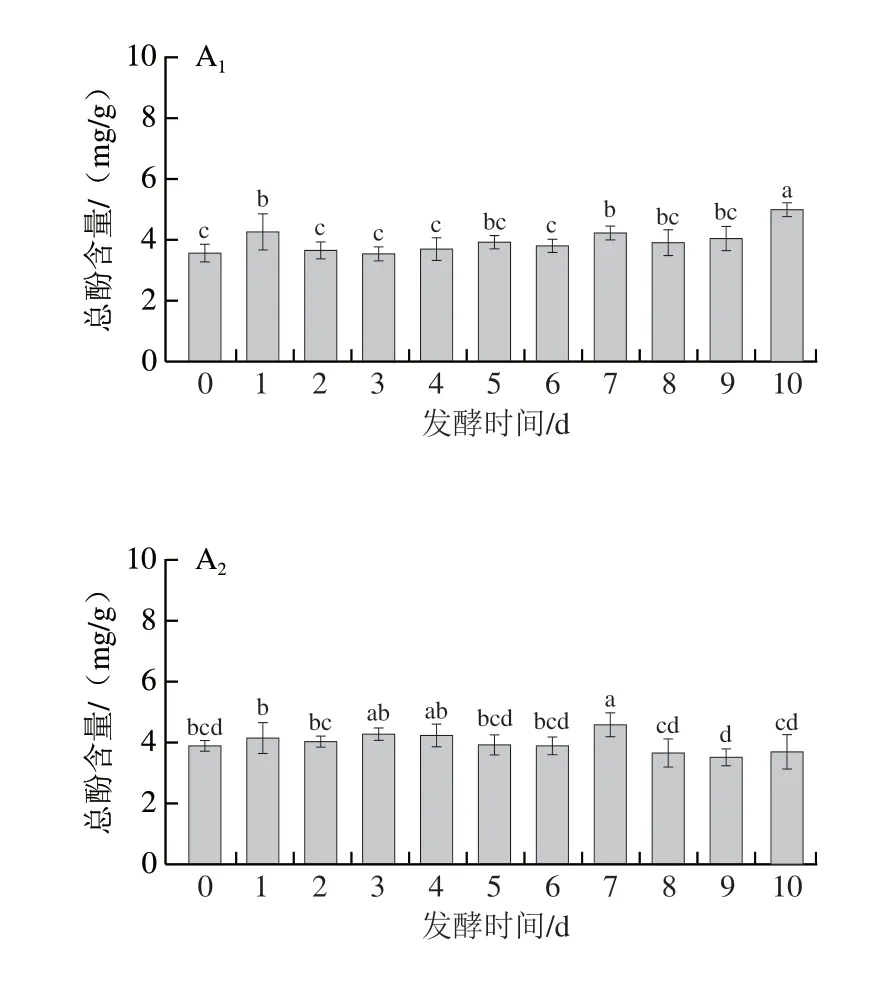
此外,米根霉和鲁氏毛霉在发酵1~2 d后使三七叶的总黄酮含量分别提高8.66%和17.11%;而粗糙脉孢菌和红曲霉发酵后,三七叶的总黄酮含量显著降低。米根霉和鲁氏毛霉发酵三七叶后其总黄酮的含量显著升高,原因可能是米根霉和鲁氏毛霉在发酵过程中产生的水解酶降低了淀粉、纤维等高分子对活性成分的包裹作用,有利于黄酮类物质的溶出[43]。粗糙脉孢菌和红曲霉发酵三七叶后其总黄酮的含量显著降低,这与发酵过程中三七叶的某些黄酮类成分转化有关。
2.4 发酵对体外抗氧化活性的影响
考虑到抗氧化机制的复杂性,采用DPPH自由基和ABTS阳离子自由基清除能力以及FRAP综合评价其体外抗氧化活性。如图4所示,米根霉、粗糙脉孢菌、红曲霉发酵后,三七叶的DPPH自由基、ABTS阳离子自由基清除能力以及FRAP呈先降后升的趋势,而鲁氏毛霉发酵后,三七叶的DPPH自由基、ABTS阳离子自由基清除能力以及FRAP呈先降后平缓的趋势。4 种真菌发酵3~5 d均可显著增强三七叶的抗氧化活性,但不同菌株之间作用不一。对增效作用进行分析比较,发现红曲霉发酵3~10 d后,三七叶的DPPH自由基、ABTS阳离子自由基清除能力以及FRAP分别提高14.30%、29.46%、18.40%,显著高于其他菌株。其中,三七叶的DPPH自由基清除能力和FRAP在红曲霉发酵3 d后效果显著,ABTS阳离子自由基清除能力在红曲霉发酵3 d后提高5.13%,但显著低于发酵10 d后。真菌发酵可以增强抗氧化活性,与凌阿静等[44]研究结果相似。

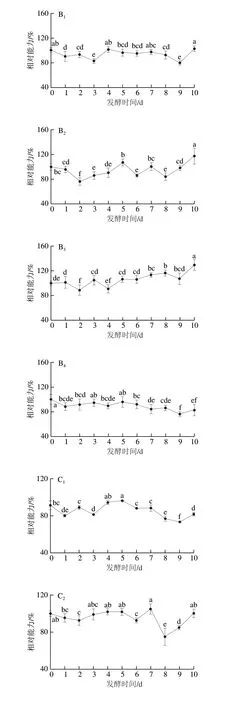
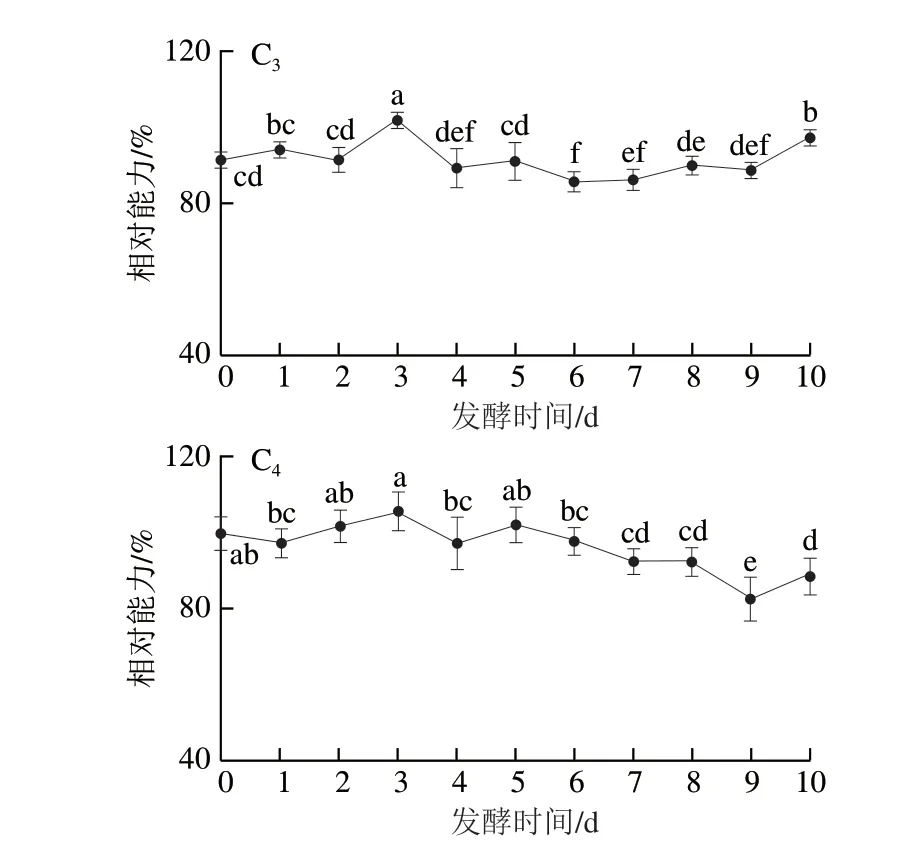
图4 真菌发酵对抗氧化活性的影响Fig.4 Effect of fungal fermentation on antioxidant activity of P. notoginseng leaves
2.5 发酵对α-葡萄糖苷酶抑制活性的影响
由图5可知,4 种真菌在发酵前期均降低了三七叶对α-葡萄糖苷酶抑制活性,但随着发酵时间的延长,对α-葡萄糖苷酶抑制活性有所增强。米根霉、粗糙脉孢菌和鲁氏毛霉发酵后,三七叶对α-葡萄糖苷酶抑制活性影响不明显,而红曲霉发酵6 d后,三七叶对α-葡萄糖苷酶的抑制活性提高16.03%,明显高于其他菌株。这与王丹等[45]的研究结果一致,红曲霉发酵可以提高α-葡萄糖苷酶抑制活性。因此,红曲霉是增强α-葡萄糖苷酶抑制活性较合适的菌株。

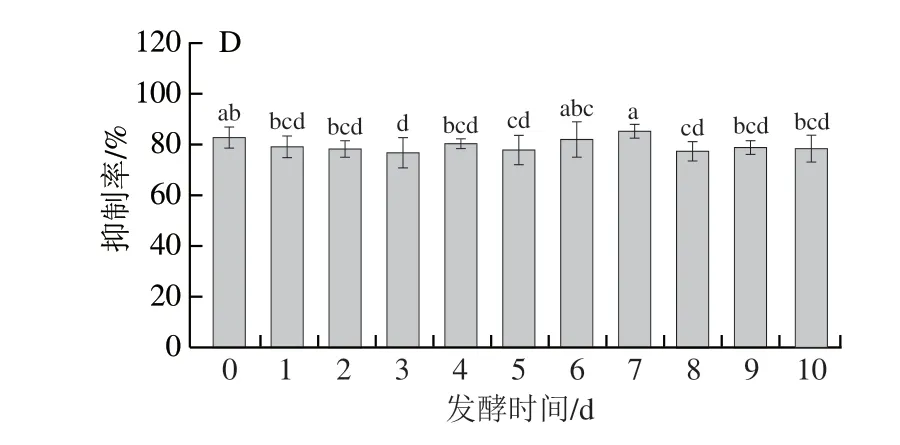
图5 真菌发酵对抑制α-葡萄糖苷酶活性的影响Fig.5 Effect of fungal fermentation on α-glucosidase inhibitory activity
2.6 代谢组学分析
基于前面的实验结果,红曲霉发酵对三七叶的功能活性增效最好,因此采用非靶向代谢组学分析红曲霉发酵3 d后三七叶中代谢物的变化。
2.6.1 代谢物分类
从三七叶中共鉴定出573 种代谢物,其中正离子模式下检测到380 种,负离子模式下193 种,如图6所示。其中,颜色代表分类,面积代表分类中代谢物的相对比例。三七叶中的代谢物在超类水平上主要包括脂质和类脂分子、有机酸及其衍生物、有机杂环化合物;在类水平上主要包括羧酸及其衍生物、有机氧化合物、丙烯醇脂质;在亚类水平上以氨基酸、肽和类似物为主。

图6 正(A)、负(B)离子模式下的代谢物分类Fig.6 Classification of metabolites identified in positive (A) and negative (B) ion modes
2.6.2 代谢物的相关分析
根据代谢物的主成分分析(principal component analysis,PCA),如图7A所示,三七叶和发酵三七叶在正、负离子模式下分布距离较远,表明发酵前后的代谢物种类和含量有显著差异。正负离子模式下样品点集中,表明样品重复性好。根据P<0.05和|log2倍数变化(fold change,FC)|≥1.5构建火山图,如图7B所示,正离子模式下代谢物有380 种,其中28 种显著上调,63 种显著下调;负离子模式下代谢物有193 种,其中显著上调的有24 种,显著下调的有46 种。综上,正负离子模式下上调的代谢物均明显少于下调的代谢物。
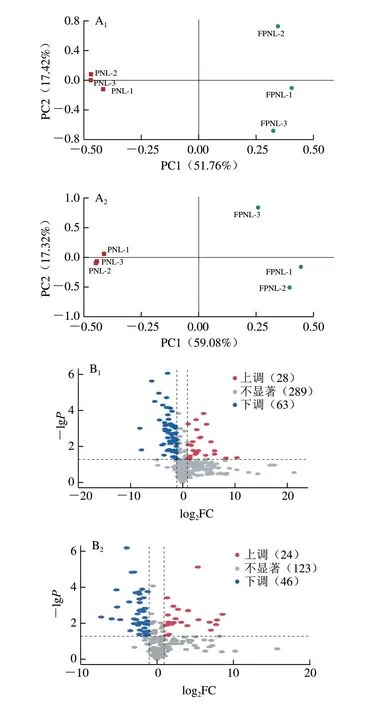
图7 代谢物的相关分析Fig.7 Correlation analysis among metabolites
根据正交偏最小二乘判别分析获得的投影中变量重要性(variable importance in projection,VIP)值,选择VIP值排在前50的差异代谢物绘制聚类热图,如图7C所示。结果发现发酵前后变化的代谢物主要集中在氨基酸、生物碱、碳水化合物、脂类、酚类、类黄酮以及一些萜类化合物等。在发酵过程中,三七叶中的蛋白质发生部分水解,促进氨基酸形成;而氨基酸能与可溶性糖等产生反应,生成新物质;同时三七叶中的黄酮苷也可以被降解成黄酮苷元和糖体。总之,三七叶在发酵过程中发生复杂的代谢反应,也是发酵后三七叶化学成分变化的原因。
2.6.3 差异代谢物与功能活性的相关性分析
将功能活性与代谢物之间进行Spearman相关性分析,如图8所示。在正、负离子模式下,只有少量代谢物与DPPH自由基、ABTS阳离子自由基清除能力、FRAP和α-葡萄糖苷酶抑制活性显著相关,这些代谢物所属类别较多,这意味着发挥功能活性是各种代谢物协同作用的结果,而不是单一作用。

图8 功能活性与代谢物的相关性Fig.8 Correlation between functional activity and metabolites
2.6.4 皂苷类化合物分析
由于皂苷被认为是三七中最主要的活性成分之一,因此针对代谢物中的皂苷类化合物进行分析。红曲霉发酵三七叶发酵前后代谢物中的皂苷类化合物如表2所示,共鉴定到21 种皂苷类化合物,其中正离子模式下10 种,负离子模式下11 种,并发现其中9 种皂苷类化合物经发酵后含量发生了显著变化。由图9可知,人参皂苷F2显著上调,其余皂苷显著下调。其中,人参皂苷F2是由杨秀伟等[46]从人参茎叶中鉴定出来的稀有皂苷。研究表明,稀有人参皂苷具有较好的药理活性,如人参皂苷C-K具有抗结直肠癌、抗炎作用[47];人参皂苷F2是原人参二醇型皂苷如Rb1、Rb2、Rc和Rd等失去若干糖而代谢降解形成的次级皂苷之一[48-49],被证明具有抗氧化、降脂等生物活性[50]。稀有人参皂苷因含量低而受到限制,利用生物转化法对普通人参单体皂苷进行结构修饰是获得稀有人参皂苷的重要途径[51]。陈旸等[52]发现植物乳杆菌发酵人参后,人参Rd含量显著提高,Rd作为稀有人参皂苷转化过程中的中间产物,其作用极为重要。而依据上述总皂苷含量实验结果,推测出三七叶在发酵过程中同样存在着皂苷类物质的转化。

图9 9 种皂苷类化合物含量的变化Fig.9 Changes in contents of nine saponins
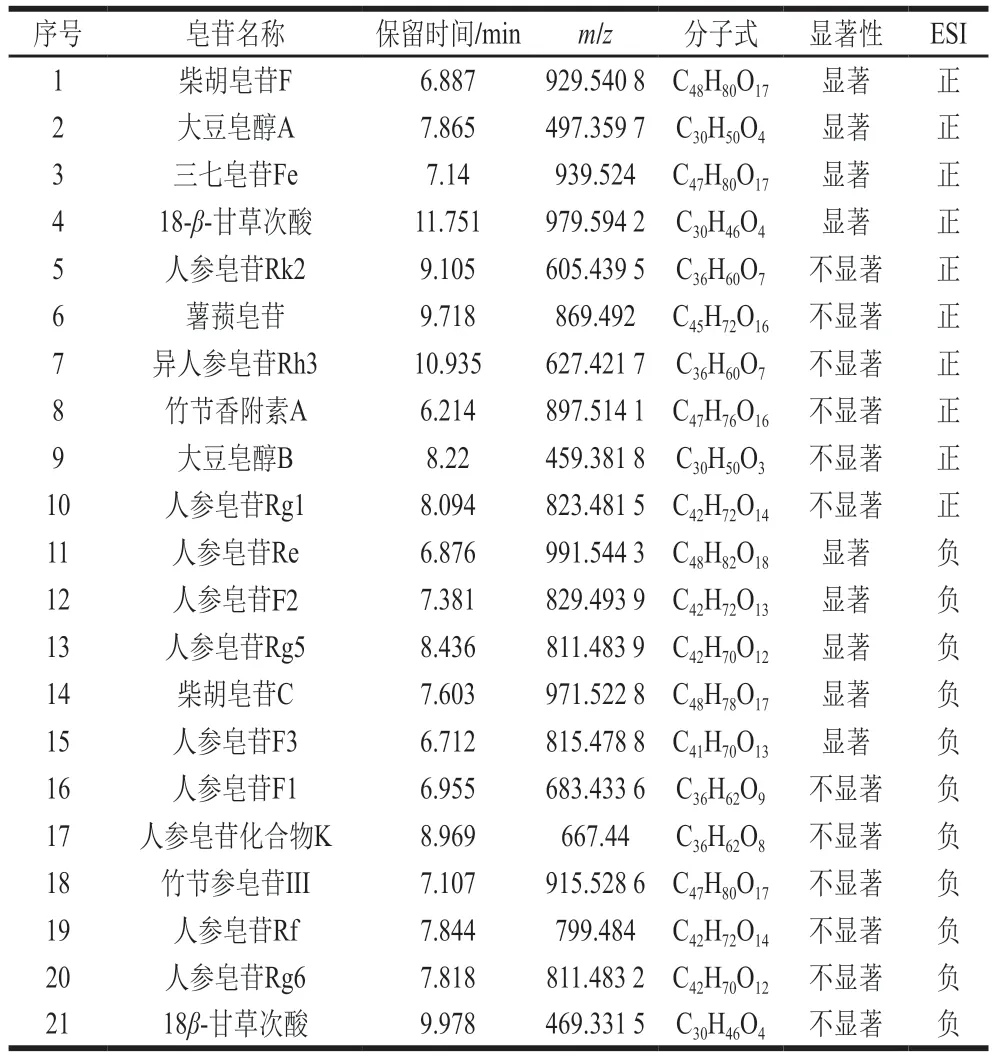
表2 三七叶发酵前后代谢物中的皂苷类化合物Table 2 Saponins in metabolites of raw and fermented P. notoginseng leaves
2.6.5 京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)代谢通路分析
对差异代谢物参与的通路进行KEGG富集分析,结果如图10所示。图中C(细胞过程)、E(环境信息处理)、G(遗传信息处理)、H(人类疾病)、M(新陈代谢)、O(生物体系统),圆圈大小表示注释到该通路中的差异代谢物数量,圆圈颜色越蓝越显著。由于本实验研究三七叶在发酵过程中的代谢物变化,因而针对M(新陈代谢)进行分析。嘌呤代谢、嘧啶代谢、类黄酮生物合成、辅助因子的生物合成等是红曲霉在发酵三七叶过程中最可能的代谢通路,其富集到的差异代谢物数量分别为5、4、4 个和6 个。其中,嘧啶代谢往往与氨基酸代谢紧密联系,如5-甲基胞嘧啶和胸腺嘧啶会参与缬氨酸、亮氨酸和异亮氨酸降解;辅助因子是碳代谢与能量代谢的中心代谢物,对氨基酸代谢、脂类代谢、植物次生代谢等有重要作用。
3 结论
真菌发酵对三七叶中的皂苷、多糖、总酚和总黄酮含量有较大的影响,其中皂苷和多糖含量在发酵后显著降低,而总酚与总黄酮含量在不同真菌中差异较大,原因可能是三七叶中皂苷和多糖含量较高,而总酚和总黄酮含量较低。真菌发酵对三七叶的功能活性有一定的影响,4 种真菌的抗氧化活性在发酵3~5 d后明显增强,其中红曲霉发酵3 d后,三七叶的DPPH自由基和ABTS阳离子自由基清除能力和FRAP分别提高14.30%、5.13%、18.40%;相比其他真菌,其增效作用更显著。此外,随着发酵时间的延长,发酵对α-葡萄糖苷酶抑制活性有所增强,其中红曲霉发酵6 d后增强16.03%,在4 种真菌发酵中增效作用最大。通过上述结果可得,红曲霉发酵3 d后,对三七叶的抗氧化活性和α-葡萄糖苷酶抑制活性的增效作用较显著,因此选择红曲霉作为本研究中最适宜发酵三七叶的菌株。有趣的是,三七叶中含有丰富的纤维,但本研究选用的分解纤维素能力较强的两株菌株(粗糙脉孢菌、鲁氏毛霉菌)并非是对三七叶功能活性增效最明显的菌株,原因可能是三七叶除了富含纤维外,也含有丰富的多糖、蛋白质、维生素、矿物质、氨基酸等营养成分,而这些营养成分可以被真菌所利用,产生具有各种功能活性的次生代谢产物。
进一步的非靶向代谢组学分析揭示了三七叶在发酵过程中代谢物的变化,发酵后上调的代谢物明显少于下调的代谢物,主要集中在氨基酸、生物碱、碳水化合物、脂类、酚类、类黄酮以及萜类化合物等,这些代谢物可能作为三七叶发酵的底物,被逐渐氧化消耗,意味着这些代谢物可能参与三七叶发酵的过程。对其中的21 种皂苷类化合物进行进一步分析,发现其中只有人参皂苷 F2显著上调,另有8 种皂苷显著下调。且只有少量代谢物与DPPH自由基和ABTS阳离子自由基清除能力、FRAP和α-葡萄糖苷酶抑制活性显著相关。通过KEGG富集分析发现嘌呤代谢、嘧啶代谢、类黄酮生物合成、辅助因子的生物合成等是红曲霉在发酵三七叶过程中最可能的代谢通路,这解释了红曲霉发酵三七叶后功能活性发生变化的原因,揭示了其代谢途径。本研究基于代谢组学技术研究了发酵过程中的差异代谢物以及皂苷类化合物的变化情况,并初步推测了其可能的代谢途径。然而,由于发酵过程复杂,对其代谢机制的研究仍需深入探讨。此外,本研究是在同样的条件下利用不同真菌对三七叶进行发酵,在今后的研究中可对不同菌株的发酵条件进行优化,以提高菌株的发酵能力。同时进一步对三七叶中皂苷的发酵转化进行深入研究,为三七稀有皂苷的生物转化机制提供思路。以期为三七叶的开发利用提供理论依据。

