不同窖龄及位置浓香型白酒窖泥微生物群落多样性与理化因子的比较分析
肖 琴,何 平,周瑞平,刘 超,袁思棋,*,赵金松,3,*
(1.四川轻化工大学生物工程学院,四川 宜宾 644000;2.叙府酒业股份有限公司,四川 宜宾 644000;3.四川省酒业集团有限责任公司,四川 成都 610000)
中国白酒是世界著名蒸馏酒,由于其酿造工艺、制曲技术、生产地理环境等的不同,形成了以浓香型、米香型、酱香型、清香型为四大基本香型,衍生出多种其他香型的白酒体系[1]。其中浓香型白酒以其独特的发酵过程和典型的风味特征如窖香浓郁、入口绵甜、回味悠长等优点深受广大消费群众喜爱[2]。长期生产实践表明窖泥质量是影响浓香型白酒风味和品质的重要因素之一,窖泥作为我国白酒酿造过程中特有的环境样品,是一种高含水量、高腐殖质与低含氧量的特殊性土壤[3],窖泥作为微生物的主要载体,其质量优劣在很大程度上取决于其微生物群落组成及物种多样性。在白酒发酵过程中,糟醅、窖泥与窖泥微生物形成一个复合有机整体,其间不断进行着复杂的生物化学反应,产酒的同时并形成酒体风味成分。20世纪60年代起研究者们开始重视窖泥中的微生物,1964年轻工部茅台试点组在茅台窖池底部的窖泥中发现了产丁酸和己酸的梭状芽孢杆菌,最终证明了己酸乙酯的确是窖底香味成分,并对浓香型白酒发展起到了促进作用[4]。由此拉开了窖泥微生物研究的序幕。此后,各酒厂、科研单位以及高校纷纷对浓香型白酒窖泥中的微生物种类、数量等进行了大量研究,发表了许多研究成果,同时也取得了很大的突破。
长期的酿酒生产实践和科研研究结果表明,不同窖龄的窖池生产的白酒品质存在差异,白酒的酒质与窖池窖龄具有显著相关性[5]。不同位置窖泥所处的地下深度不同、环境不同,如窖底泥长时间被黄水浸泡,趋于厌氧环境,而部分窖壁与空气接触时间更多一些,在封窖后才处于厌氧状态[6],故其已知有关质量指标才存差异,且微生物多样性也存差异。因此,本研究以宜宾某酒厂的浓香型白酒窖泥为研究对象,对其5、10、20 a窖龄上层、中层和底层位置的窖泥进行了微生物群落结构分析,初步揭示窖泥微生物多样性及窖泥理化性质差异与相关性,为窖泥质量多维度评估及提高白酒生产质量提供参考和启发。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
窖泥样品取自宜宾叙府酒业5、10、20 a,每个年份随机取窖池3 个作为平行样。每个窖龄窖池分别从窖池壁上层、中层和底层进行无菌取样(图1)。上层样从离窖口20 cm的四面池壁中心点取样混合,分别标记为S5(S5_1~S5_3)、S10(S10_1~S10-3)、S20(S20_1~S20_3),中层样从四个池壁面的中心点取样混合,分别标记为Z5(Z5_1~Z5_3)、Z10(Z10_1~Z10_3)、Z20(Z20_1~Z20_3),底层样从窖池底的4 个角和中心点取样混合,分别标记为D5(D5_1~D5_3)、D10(D10_1~D10_3)、D20(D20_1~D20_3)。样品用无菌袋密封后,放置于-80 ℃贮存,待用。
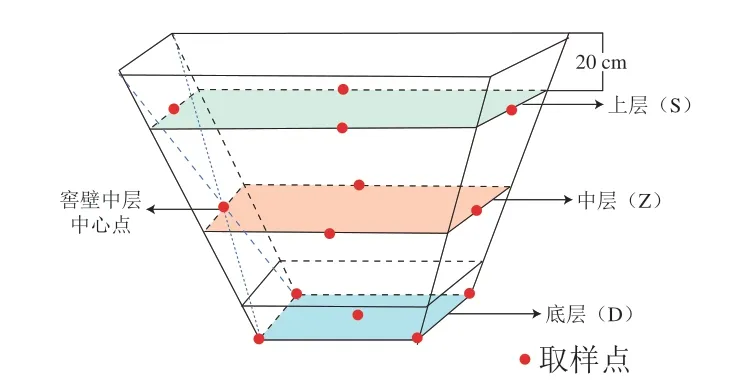
图1 窖泥的取样位置Fig.1 Sampling locations of PM
1.1.2 试剂
氢氧化钠、酒石酸钠钾、钼酸铵(均为分析纯)天津市大陆化学试剂厂;氯化铵(优级纯)天津市科密欧化学试剂有限公司;氯化亚锡、磷酸二氢钾、氟化铵(均为分析纯)上海麦克林生化科技公司;盐酸(分析纯)成都市科隆化学品有限公司;碘化汞(分析纯)上海阿拉丁生化科技股份有限公司;碘化钾(分析纯)广东光华科技股份有限公司;DNeasy®PowerSoil®Pro Kit DNA抽提试剂盒 美国QIAGEN公司。
1.2 仪器与设备
快速水分测定仪、电子分析天平 美国奥豪斯公司;紫外-可见分光光度计、旋涡混匀器 上海元析仪器有限公司;Illumina MiSeq高通量测序平台 美国Illumina公司;NanoDrop 2000 DNA浓度测定仪 美国Thermo Scientific公司;Centrifuge 5424离心机 德国Eppendorf公司。
1.3 方法
1.3.1 窖泥理化指标的测定
水分含量的测定:使用快速水分测定仪;氨态氮、有效磷的测定:参照沈怡方[7]方法;pH值的测定:参考辜杨等[8]方法。
1.3.2 样品总DNA提取
本实验采用DNeasy®PowerSoil®Pro Kit DNA提取试剂盒提取样品中的总DNA,提取步骤参考试剂盒说明方法。
1.3.3 聚合酶链式反应扩增与测序
使用1%琼脂糖凝胶电泳检测提取的基因组DNA质量,使用NanoDrop2000测定DNA浓度和纯度,所有样品均满足测序要求,并于-80 ℃保存。将合格的DNA委托上海美吉生物公司进行Illumina MiSeq高通量测序。
细菌和古菌采用通用引物515FmodF/806RmodR(5’-GTGYCAGCMGCCGCGGTAA-3’/5’-GGACTACNVGGG TWTCTAAT-3’),扩增微生物16S RNA基因的V4可变区。
真菌引物ITS1F/ITS2R(5’-CTTGGTCATTTAGA GGAAGTAA-3’/5’-GCTGCGTTCTTCATCGATGC-3’),扩增ITS1区。
扩增程序:95 ℃预变性3 min,35 个循环(真核27 个循环)(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s),再72 ℃稳定延伸10 min,最后10 ℃保存直至反应结束。扩增体系参照向港兴等[9]方法。
1.4 数据处理
微生物群落结构分析基于上海美吉生信云平台进行绘制稀释曲线和堆积柱状图等;理化指标等利用IBM SPSS Statistics 27和Excel 2019进行数据处理及分析。
2 结果与分析
2.1 测序及稀释曲线分析
本研究采用Illumina MiSeq平台对窖泥样品的微生物群落进行测序分析,优化后共得到1409227 条有效原核微生物序列和1289888 条有效真菌序列。利用各样本在不同测序深度时的Shannon指数构建稀释曲线(图2),结果显示随着测序深度的增加,曲线趋于平稳,表明测序量充足,测序数据合理。
图2 高通量测序中原核生物(a)和真菌(b)的稀释曲线Fig.2 Rarefaction curves of prokaryotes (a) and fungi (b) obtained by high-throughput sequencing
2.2 不同窖龄及位置的窖泥微生物群落结构α多样性分析
用降噪后的序列进行α多样性分析,得到原核微生物和真核微生物的多样性指数(表1、2),覆盖率均在99.9%以上,说明测序结果能覆盖所有样品中的微生物群落,具有较好的代表性,能真实反映样品里物种的多样性及丰度。从总体上看,所有样品中原核微生物的物种多样性和丰富度普遍高于真菌物种。
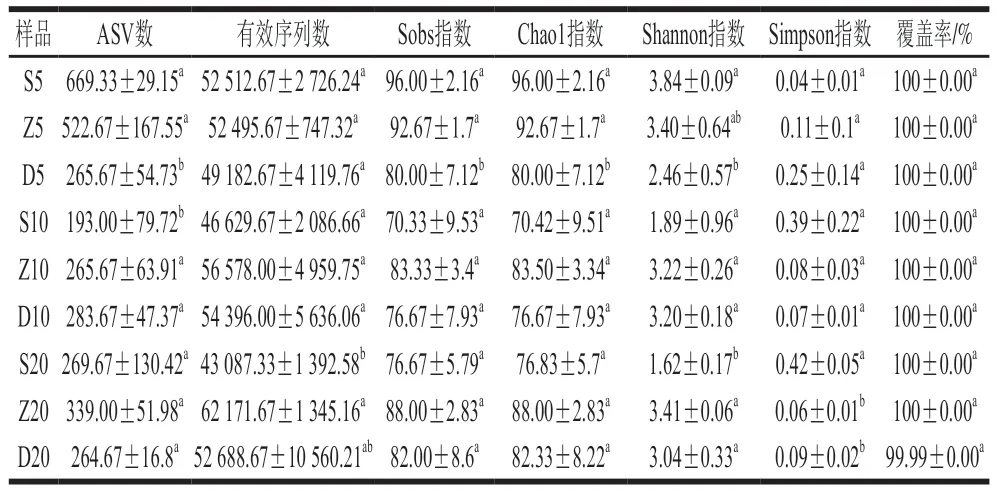
表1 不同窖龄及位置窖泥中原核微生物菌群的α多样性分析Table 1 α-Diversity analysis of prokaryotic microflora in PM at different ages and locations of cellars
由表1可知,5 a窖泥原核微生物的多样性(Chao1、Shannon指数)总体上均高于10 a和20 a,可能是酒厂对年轻窖池进行菌液喷洒养护不断驯化窖泥,或者是年份低的窖泥微生物尚在适应酿酒环境的过程,处在不断驯化过程,含有很多无用的酿酒微生物;同年份的窖泥,上层的Simpson指数高于中层和底层,说明中层和底层窖中的微生物群落分布更均匀;同年份中层窖泥的微生物多样性高于上层和底层,同一位置的窖泥微生物多样性随着窖龄的增加,总体呈现下降趋势,与邓杰等[10]的研究结果基本一致,可能是随着时间的增长,长时间的窖泥驯化和微生物动态变化、群落更替等,微生物逐渐适应窖泥微环境而形成优势群体,最终形成比较稳定的窖泥微生物生态系统,即微环境中逐渐富集了更多有利于酿酒的原核微生物。
由表2可知,与原核微生物一样,5 a窖泥中的真核微生物多样性总体上高于10 a和20 a。总体上同一窖龄的上层和中层窖泥真菌多样性与丰富度(Sobs、Chao1和Shannon指数)均高于底层窖泥,与王春艳等[11]的研究结果一致。可能是窖壁中氧气含量高,而窖底长时间处于密封发酵,且常被黄水浸泡,处于厌氧环境,不利于好氧型真菌的生活,导致窖底窖泥真菌群落多样性和丰度较低。随着年份增加,真菌多样性呈现总体下降趋势,但其分布更加均匀。

表2 不同窖龄及位置窖泥中真菌菌群的α多样性Table 2 α-Diversity of fungal flora in PM at different ages and locations of cellars
2.3 不同窖龄及位置窖泥微生物物种组成分析
2.3.1 基于门水平的窖泥微生物菌群结构分析
根据得到ASV在门分类水平的物种分类信息,分析样品ASV在门分类水平的群落结构(图3)。所有样品中共检测到由古菌和细菌构成的37 个门,其中32 个细菌门、5 个古菌门。共5个优势菌门(相对丰度≥1%),分别为厚壁菌门(Firmicutes)(69.59%)、广古菌门(Euryarchaeota)(17.69%)、拟杆菌门(Bacteroidota)(4.35%)、Halobacterota(4.25%)、互养菌门(Synergistota)(1.28%)。Firmicutes是样品中的绝对优势菌群,与Chen Li等[12]的研究结论基本一致,其在所有样本中相对含量为25.15%~96.91%,且其在同一年份的不同位置中上层相对丰度最高,在5 a和10 a窖泥中层的Firmicutes含量都高于底层,而20 a窖泥中其含量在底层中略高于中层。这些变化趋势与任海伟等[13]的结果略微不同。Firmicutes菌群是窖泥产香生酸的关键微生物菌群,窖泥的质量常用其丰度评价[14]。由此说明该酒厂的窖泥质量整体水平较为优质,但是5 a窖泥中Firmicutes类微生物较低(大于20%),原因可能是在不断的窖池养护中对窖泥微生物有一定影响,或者是5 a窖泥窖龄较短,微生物还处在不断驯化过程;Euryarchaeota的变化趋势则跟Firmicutes相反,其在同一年份的不同位置中,从上层到底层逐渐升高,在同一位置的不同窖龄窖泥中,随着窖龄的增加含量逐渐减少,在所有样品中的相对丰度变化范围为1.43%~49.07%;Bacteroidota在不同年份的底层窖泥中含量较高,在D5含量达到了最高值16.11%。Cloacimonadota仅在不同窖龄的中层和底层出现,其相对丰度为0.39%~1.09%。Proteobacteria仅在S5、Z5中检测出,占比分别为1.84%、1.32%,与Tao Yong等[15]研究认为Proteobacteria是新窖的优势菌门一致。
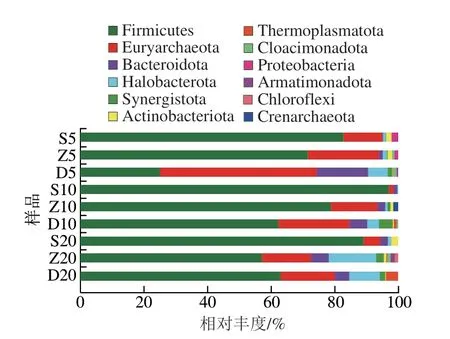
图3 不同窖龄及位置窖泥原核微生物门水平相对丰度Fig.3 Relative abundance of prokaryotic microbiota at phylum level in PM at different ages and locations of cellars
样品真菌中共检测出12 个门,其中子囊菌门(Ascomycota)(64.35%)、担子菌门(Basidiomycota)(32.24%)、罗兹菌门(Rozellomycota)(19.74%)为优势菌门(图4)。由图4可知,Ascomycota在5 a和10 a窖泥中不同位置中都占绝对优势,而在20 a窖泥中,Basidiomycota占绝对优势,S20、Z20、D20中Basidiomycota相对丰度分别为59.67%、56.06%、72.91%。同一位置不同窖龄窖泥中,随着窖龄的增长,Ascomycota相对丰度逐渐降低,如S5、S10、S20中其相对丰度分别为86.46%、78.61%、39.68%。Basidiomycota相对丰度逐渐升高,其在20 a窖龄窖泥中成为优势菌群。随着窖龄的增加,Ascomycota占主导的优势菌群逐渐演变为Basidiomycota占主导的优势菌群。Rozellomycota在D5和D10中检测出且占优势(15.17%、1.18%)。以上真菌类优势菌群在孟静雅等[16]的研究中也有所报道。
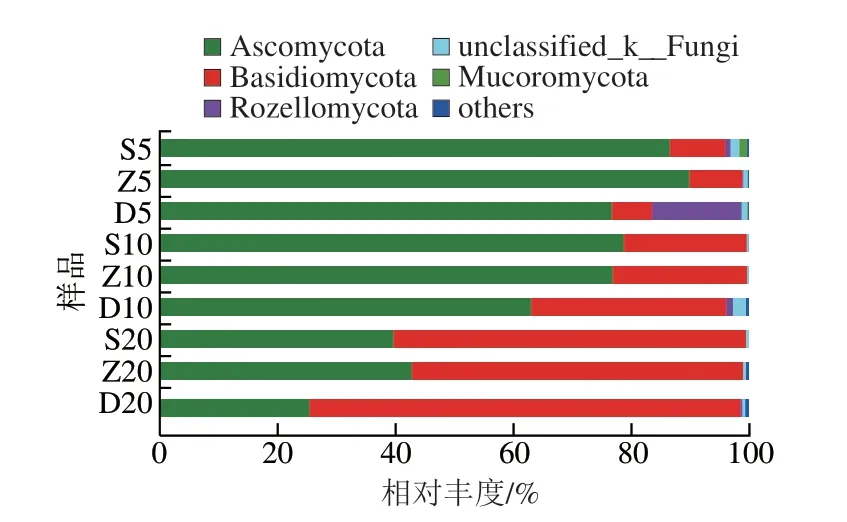
图4 不同窖龄及位置窖泥真菌门水平相对丰度Fig.4 Relative abundance of fungi at phylum level in PM at different ages and locations of cellars
2.3.2 基于属水平的窖泥微生物菌群结构分析
根据得到ASV在属分类水平的物种分类信息,分析样品ASV在属分类水平的原核微生物群落结构,共得到629 个属,其中优势菌属(相对丰度≥1%)共15 个,其余未知菌和非优势菌属归为others,其相对丰度如图5所示。在全部样品中,相对丰度排前6的原核生物群落包括乳酸杆菌属(Lactobacillus)(20.57%)、甲烷杆菌属(Methanobacterium)(11.63%)、梭菌属-12(Clostridium_sensu_stricto_12)(9.57%)、己酸菌属(Caproiciproducens)(7.34%)、甲烷短杆菌属(Methanobrevibacter)(6.06%)、氢孢菌属(Hydrogenispora)(5.29%)。
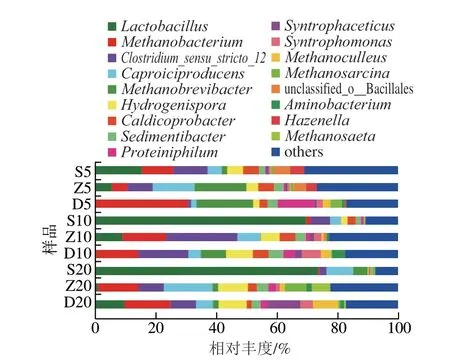
图5 不同窖龄及位置窖泥原核微生物属水平相对丰度Fig.5 Relative abundance of prokaryotic microbiota at genus level in PM at different ages and locations of cellars
由图5可知,在5 a上层窖龄窖泥细菌类微生物未知菌类丰度比其他窖龄窖泥更加丰富;10、20 a上层窖泥中Lactobacillus均占绝对优势,随着年份的增长其丰度也在增加,分别为69.76%、73.72%。在总体上,在同一年份中,Lactobacillus相对含量随着窖池深度的增加而减少,与Wang Chuandong等[17]报道的结果相同。研究表明,随着窖泥质量的提高,窖泥中的Lactobacillus含量会降低[18],而本研究中窖龄长的上层窖泥中其含量很高,可能是因为老窖池在长期的使用过程窖泥脱落,后窖泥的养护过程中重新增补了新窖泥;Caproiciproducens是优势菌属,在3 个窖龄窖泥中层含量较高,在Z20中相对丰度高达16.05%,其产生的己酸等对Lactobacillus有抑制作用,导致Caproiciproducens相对含量高的样品Lactobacillus相对含量就低[19-20]。Clostridium_sensu_stricto_12含量随着窖泥位置的下移逐渐增加,随着窖龄的增加而增加,此类菌可形成浓香型白酒中具有代表性的香气成分;Hazenella为5 a窖龄窖泥中的特有优势菌属,其在上、中、下层的相对丰度分别是4.68%、3.54%、0.43%,而在黄莹娜等[21]研究中Hazenellas特有存在23 a的窖泥中。甲烷丝菌属(Methanosaeta)仅在20 a的中层和底层中检出,推测此菌在浓香型窖泥老熟过程有着积极作用;Methanobacterium在不同年份的底层占比较高,在D5样品中相对丰度最高为30.36%,甲烷菌与己酸菌共生有利于产出浓香型白酒主体香己酸乙酯的前体物质己酸[22]。沉积菌属(Sedimentibacter)在全部样品中均检测出,且在窖龄较长的10 a和20 a中占比较高,相关研究表明其在老窖泥中常作为优势菌存在,其能与甲烷菌共生,且有降解氨基酸生成乙酸、氨态氮等小分子的能力[23]。本研究发现的Lactobacillus、Sedimentibacter、Caproiciproducens等优势菌属也广泛存在于其他地区的窖泥中[24-26]。除前述6 个优势菌属外,其他的优势菌属,如Aminobacterium、Syntrophomonas也在很多文章中被报道过,且在窖龄长、质量高的窖泥中这类菌的含量较多[27]。
本研究原核生物类群注释结果显示,窖池内的不同位置的原核生物类群各绝对优势物种有显著差异,各微生物类群的含量有显著差异,且不同窖龄的窖泥中可能出现稀有菌群。由此可见,不同窖龄和位置对窖泥的原核生物类群物种分布有着不同程度的影响。
根据得到ASV在属分类水平的物种分类信息,分析样品ASV在属分类水平的真核微生物群落结构,共得到282 个属,其中优势菌属(相对丰度≥1%)共15 个,其余未知菌和非优势菌属归为others,其相对丰度如图6所示。属水平的微生物群落及其相对丰度分别为未分类双足囊菌科(unclassified_f__Dipodascaceae)(21.0%)、未分类曲霉科(unclassified_f__Aspergillaceae)(15.43%)、Apiotrichum(13.21%)、嗜热真菌属(Thermomyces(10.07%)、Cryptococcus_f__Tremellaceae(7.93%)、Trichosporon(6.77%)、Cutaneotrichosporon(3.31%)、嗜热子囊菌属(Thermoascus)(3.11%)、红曲霉(Monascus)(2.22%)、unclassified_p__Rozellomycota(1.92%)、Debaryomyces(1.91%)、Botrytis(1.67%)等,各组的注释度分别为S5(88.34%)、Z5(90.81%)、D20(91.14%)、S10(87.79%)、Z10(89.39%)、D10(94.76%)、S20(94.38%)、Z20(91.41%)、D20(92.76%)。对各样品的注释度比较可知,总体来说,每年份底层窖泥的注释度较高则未知真菌少,而每年份上层的注释度较低其已知真菌少,与孟静雅等[16]的研究结果基本相同。各组样品相比较,unclassified_f__Dipodascaceae在各年份中随着窖泥空间位置的下移,其相对丰度也降低,全部样品中其丰度在S10中达到了最高值51.87%;不同年份的组成差异较大,有些菌类仅在某几个样品中检出,如Monascus仅在5 a的上、中、下层中检测出,其相对含量分别为8.45%、7.12%、4.42%,红曲霉能突出己酸乙酯的主体香,使得酒体丰满协调[28];Botrytis仅在D5和D10中检测出,其丰度分别为1.94%和13.09%;Saccharomyces在5 a和10 a窖泥中均未检出,在20 a窖泥中检出,但在上层和中层窖泥中含量都很低(小于1%),而在底层含量则高达5.49%。
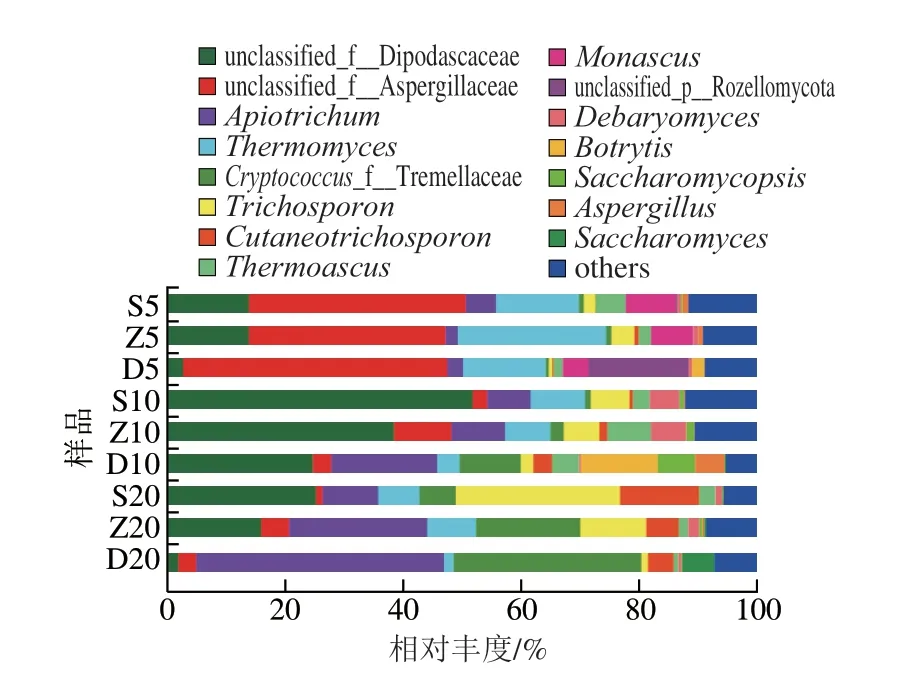
图6 不同窖龄及位置窖泥真核微生物属水平相对丰度Fig.6 Relative abundance of eukaryotic microbiota at genus level in PM at different ages and locations of cellars
由图6可知,不同窖龄的绝对优势菌群不同,5 a窖泥的优势菌群是unclassified_f__Aspergillaceae,10 a是未分类双足囊菌科(unclassified_f__Dipodascaceae),20 a是Apiotrichum。窖泥中的真菌主要由酵母菌和霉菌组成,研究表明酵母类真菌在白酒发酵过程中对乙醇、有机酸和多类酯产生有重要作用[29]。孟雅静等[16]研究得出新老窖泥的真菌组成差异并不明显,而本研究结果表明,不同窖龄的窖泥优势真菌存在明显差异,且不同的窖龄可能会出现个别稀有物种。窖池内的不同位置各绝对优势物种没有显著差异,但各物种的含量有些许差异,且不同位置可能出现稀有菌群。由此可见,窖池窖龄及窖泥所在空间位置环境均可在一定程度上影响真菌群落结构分布和演替规律。
2.4 不同窖龄及位置窖泥差异微生物分析
为进一步分析不同分组窖泥微生物的差异,利用线性判别分析效应量(linear discriminant analysis effect size,LEfSe)分析组间的差异微生物,并输出线性判别分析(linear discriminant analysis,LDA)柱状图,LDA柱状图展现了各组中具有显著差异的微生物,柱长度代表差异物种的影响值大小。如图7所示,在属水平全部组别共检测出12 种(LDA>4)差异原核微生物,其中S5中的差异物种为unclassified_o__Bacillales、Hazenella;D5中的差异物种为嗜蛋白菌属(Proteiniphilum)、Petrimonas;D10中的差异物种为Aminobacterium、Syntrophomonas;S20中的差异物种为Lactobacillus;Z20中的差异物种为norank_f__norank_o__Proteinivoracales、Caproiciproducens;D20中的差异物种为RumEn_M2、Syntrophaceticus、Methanoculleus。
由图8可知,全部样品中检测出的差异真菌物种共15 种(LDA>2)。Z5中的差异微生物为曲霉目(Eurotiales);D5中的差异微生物为Aspergillaceae、Basidiomycota、unclassified_f__Aspergillaceae;S10中的差异微生物为双足囊菌属(Dipodascus);S20中的差异微生物为Cutaneotrichosporon、丝孢酵母目(Trichosporonales)、Trichosporonaceae;D20中差异微生物为Tremellales、Apiotrichum、Cryptococcus_f__Tremellaceae、Tremellaceae、Tremellomycetes、Tremellaceae。
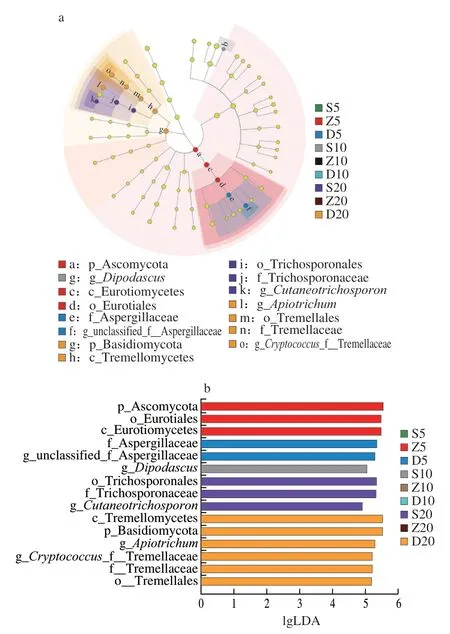
图8 真菌LEfSe多级物种层级树图(a)和LDA柱形图(b)Fig.8 LEfSe multi-level species hierarchical tree (a) and LDA plot (b) of fungi
样品间的差异微生物分析结果表明,原核差异微生物在个别窖泥样品中独特存在,如5 a窖泥中的Hazenella,而10 a和20 a窖泥样品中,某些差异微生物相对含量较低,如Aminobacterium、Syntrophomonas、Methanoculleus等,也有含量相对高差异微生物,如Lactobacillus。以上差异微生物的代谢产物对白酒的风味物质的来源和代谢途径有重要作用。真菌差异微生物也是白酒酿造过程中有重要作用为生物类群,如Aspergillaceae、unclassified_f__Aspergillaceae等。由此可以推测,不同窖龄的窖泥有其差异原核和真核微生物存在,在酿酒过程中产生的代谢物也有所差异,从而影响窖泥质量,进而生产的白酒原酒质量有所差异。
2.5 不同窖龄及位置窖泥理化指标的差异
理化指标在一定程度上能较好反映出窖泥的质量,也是目前评价窖泥质量优劣的重要指标。利用SPSS软件采用单因素方差分析,比较了样品中的理化指标差异。由表3可知,同一年份的窖泥随着窖池深度的增加(位置从上至下),水分含量先升高后降低,总体上,年份越久,水分含量越高;全部样品中窖泥都偏酸性,pH值变化范围为3.66~5.20,5 a份的窖泥pH值总体比10、20 a的老窖泥高,10、20 a不同位置窖泥pH值无显著差异,而S5和Z5具有显著差异;pH值和氨态氮的变化趋势相同,10 a和20 a窖泥其值都随着位置从上至下先增加后降低,而5 a窖泥随着窖泥位置从上至下,其pH值和氨态氮值逐步增大,可能是窖龄较低,窖泥还处在发展阶段。总体上,氨态氮含量随着窖泥窖龄的增加逐步增加,氨态氮含量在Z20时达到了最大值26.24 mg/100 g,微生物的自身生长繁殖、蛋白质和酶类等合成需要氨态氮,氨态氮含量对窖泥微环境维持和酒质提升有非常重要的作用。有效磷含量在同一年份不同位置窖泥中,随着窖泥空间位置从上至下逐步升高,且均具有显著差异(P<0.05),对于同一位置不同年份的窖泥,随着其窖龄的增加,有效磷含量先增加后降低(表3)。根据赵长青等[30]对窖泥理化评定表,一级、二级、三级窖泥质量中的有效磷含量分别为150~300、50~149 mg/100 g和<50 mg/100 g,可知本研究10 a和20 a窖龄中层和底层窖泥中的有效磷含量达到了高质量窖泥的标准,而对应的窖池上层位置窖泥样品中有效磷含量均较低,可被认为是窖泥质量较低。因此,窖龄长短和窖泥空间位置均对窖泥的质量有显著影响,从而反映出在日常生产过程中改善相应的酿造工艺或者营养物质配比,保证窖泥微生物群落处于有效动态平衡。

表3 不同窖龄及位置窖泥理化性质Table 3 Physicochemical properties of PM at different ages and locations of cellars
2.6 窖泥理化指标与微生物的相关性分析
不同窖龄及位置窖泥之间理化指标的差异可能是影响窖泥微生物生长代谢或其功能的因素[31]。利用冗余分析(redundancy analysis,RDA),分析窖泥理化指标与微生物之间的相关性。图9展示了窖泥微生物属水平中相对丰度前5的原核、真核微生物与窖泥理化指标之间的关系,原核生物2 个主成分的总解释度为29.27%,真核生物2 个主成分的总解释度为27.39%。

图9 原核微生物(a)和真菌(b)与理化指标的RDAFig.9 Redundancy analysis of prokaryotic microorganisms (a) and fungi (b) with physicochemical properties
由图9a所示,原核微生物中的Lactobacillus与水分、pH值、氨态氮、有效磷呈负相关,与张明珠等[32]的研究结果基本一致。Methanobacterium、Clostridium_sensu_stricto_12、Caproiciproducens、Methanobrevibacter与水分、pH值、氨态氮、有效磷呈正相关。S5、S10和S20与理化指标呈负相关,而其他位置样品与理化指标呈正相关,这表明这些理化指标对窖泥原核微生物分布影响较大,尤其是区分上、下部窖泥样品,与胡晓龙等[33]的研究结果一致。由图9b可知,真核微生物中unclassified_f__Dipodascaceae与水分、pH值、氨态氮呈负相关,unclassified_f__Aspergillaceae、Thermomyces与pH值呈正相关,而与水分、氨态氮和有效磷呈负相关。Cryptococcus_f__Tremellaceae、Apiotrichum与4 个理化指标都呈正相关。
3 结论
本研究对5、10 a和20 a窖龄窖泥上、中、底层空间位置的原核和真核微生物群落结构及其理化指标进行了比较分析,联合使用了高通量测序中较新的ASV分析流程和LEfSe方法,并结合数理分析法研究了窖泥原核微生物和真核微生物与理化指标之间的关系。结果表明:1)窖泥的真菌微生物物种多样性和丰富度普遍低于原核微生物;2)5 a窖泥原核微生物多样性总体上高于10 a和20 a窖泥。3)同一窖龄的中层窖泥原核微生物多样性高于上层和底层,而上层和中层的真核微生物多样性高于底层窖泥,即不同空间位置窖泥的微生物多样性有较大区别,同一窖龄的不同位置窖泥质量也有区别。4)窖泥微生物的组成方面,在门水平上,原核微生物共有5 个优势菌门,真核微生物有3 个优势菌门;在属水平上,原核和真核微生物均检出15 个优势菌属。其中原核微生物中的Lactobacillus在10 a和20 a窖泥样品中的上层占绝对优势,在5 a窖龄窖泥中检测到特有Hazenellas微生物类群;不同窖龄的窖泥真核微生物具有不同的绝对优势菌群。5)LEfSe发现,不同窖龄及位置的窖泥在属水平上共检出15 种差异原核微生物和5 种差异真核微生物。6)理化分析结果表明,同一窖龄的不均一性空间位置的窖泥在4 个理化指标方面均呈显著差异;结合RDA发现,水分含量、pH值和氨态氮分别与属水平总丰度前5的原核和真核微生物显著相关,即Lactobacillus、unclassified_f__Aspergillaceae、Thermomyces与水分、氨态氮和有效磷呈负相关,Methanobacterium、Clostridium_sensu_stricto_12、Caproiciproducens、Methanobrevibacter、Cryptococcus_f__Tremellaceae、Apiotrichum与水分、pH值、氨态氮、有效磷呈正相关。
综上,本研究系统测定了不同位置深度、不同窖龄窖泥的理化指标与原核和真核微生物菌群,相关结果发现不同空间位置和窖龄的窖泥样品中优势微生物存在较大差异,且理化指标与窖泥优势微生物存在显著相关。研究表明总体上窖龄长的窖泥质量高,但在10 a和20 a窖龄上层窖泥中,微生物Lactobacillus丰度高、有效磷含量偏低说明了窖龄长的窖池上层窖泥质量存在退化现象,故窖泥质量优劣的判断需要综合考虑空间位置、整个窖池的发酵效果及原酒酒体质量整体判别。本研究丰富了窖泥不同维度原核和真核微生物的研究,对于指导窖泥的日常养护、制作优质窖泥和老熟提供了一定的理论参考。

