核桃主要致敏蛋白Jug r 1的分离纯化、鉴定与分析
沈明娟,李云嵌,杨 曦,王永琴,沙小梅,张雪春,3,*
(1.西南林业大学生命科学学院,云南 昆明 650224;2.江西师范大学生命科学学院,国家淡水鱼加工技术研发专业中心,江西 南昌 330022;3.西南林业大学 云南省森林灾害预警与控制实验室,云南 昆明 650224)
泡核桃(Juglans sigillata)别名胡桃、羌果,为胡桃科胡桃属木本植物,是我国最重要的经济类坚果之一,其可食部位为核桃仁,富含蛋白、氨基酸及不饱和脂肪酸等营养成分,其中蛋白占比可达22.18%[1-2]。核桃蛋白是一种较为优质的植物蛋白资源,但同时也是世界上主要的食物过敏原之一。调查显示,坚果等“八大过敏原”导致了90%的食品过敏现象,其中核桃产生的过敏反应约占所有坚果过敏的34%,约15%的儿童过敏体质者对核桃过敏[3]。核桃过敏可作用于人体呼吸道、胃肠道等部位,导致恶心、唇肿、呼吸困难等临床症状,严重影响人们尤其是儿童的身体健康[4-5]。因此,明确核桃中的过敏原蛋白,深入研究其结构和性质,对人类膳食健康有重要意义。
截至目前,世界过敏原数据库(http://www.allergenonline.org)共收录了6 种核桃过敏原的信息,分别为Jug r 1、Jug n 1(2S蛋白),Jug r 2、Jug n 2(7S蛋白),Jug r 3(脂质转移蛋白)和Jug r 4(11S球蛋白)[6]。其中Jug r 1是一种分子质量约16.4 kDa的2S蛋白种子贮藏蛋白,由139 个氨基酸组成,研究发现在32 例核桃过敏患者中,约96.9%的患者对抗原Jug r 1过敏,说明Jug r 1是引发核桃过敏反应的主要原因[7]。Sordet等[8]利用大肠杆菌表达重组Jug r 1,同样证实了Jug r 1是核桃中的主要过敏原蛋白。但目前国内外关于Jug r 1的相关研究较少,主要集中在其致敏原线性表位[9-10]及基因表达[8,11]等方面,且使用的几乎都是Jug r 1含量较低的粗蛋白,与Jug r 1相关的过敏研究如人体血清学分析、免疫学分析和生物信息学分析等仍较为匮乏[6,12]。因此,迫切需要采用各种分离纯化手段制备高纯度的Jug r 1以开展进一步研究。
蛋白纯化的主要方法有尺寸排阻色谱、盐析沉淀法、离子交换层析、疏水层析、亲和层析等[13-14],其中尺寸排阻色谱一般又被称作凝胶过滤层析或分子筛层析,因具有分离效果好、操作简单等优点而被广泛使用[13]。目前已有对花生[15]、巴西坚果[16]、榛子[17]以及其他植物蛋白中过敏原蛋白[13,18]进行分离纯化的相关报道,但对核桃致敏蛋白Jug r 1分离纯化及鉴定的研究鲜有报道。
云南是我国核桃主产区,其种植面积和产量均居全国第一,且由于其独特的气候和地理环境,云南核桃的品质和品种随地域分布呈现丰富的多样性,但目前鲜见对云南不同产地核桃的致敏性及其Jug r 1含量的相关研究。因此,以云南不同产地的泡核桃为研究对象,采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)、双抗夹心酶联免疫吸附(enzyme-linked immunosorbent assay,ELISA)等方法,从中筛选出Jug r 1含量最高的品种,进一步采用硫酸铵分级沉淀、凝胶过滤层析、液相色谱-串联质谱等手段对Jug r 1进行提取、分离纯化和鉴定,并利用圆二色谱和紫外光谱法对其结构进行表征,旨在为深入研究Jug r 1提供科学基础,以期为核桃致敏的诊断、治疗和机理研究提供一定的参考依据。
1 材料与方法
1.1 材料与试剂
7 个核桃品种(产地):临沧大泡(云南临沧市),大姚三台(云南楚雄自治州大姚县三台乡),昌宁细香(云南保山市昌宁县),大理娘青、大理漾濞、大理龙佳(云南大理自治州),保山隆阳(云南保山市隆阳区)。选择品质较佳、大小均一、新鲜干燥的核桃,手工破碎后取核桃仁,置于4 ℃冰箱用于下一步实验。
硫酸铵(纯度≥99%)广东光华科技股份有限公司;三羟甲基氨基甲烷(tris(hydroxymethyl)aminomethane,Tris)、蛋白分子质量标准Marker 北京索莱宝科技有限公司;植物Jug r 1蛋白酶联免疫分析试剂盒 上海酶联生物科技有限公司;1.0 mol/L Tris-HCl缓冲液(pH 6.8)、1.5 mol/L Tris-HCl缓冲液(pH 8.8)、牛血清白蛋白标准品(纯度≥98%)上海源叶生物科技有限公司;Superdex 200 pg 美国GE公司;盐酸、冰乙酸等试剂均为国产分析纯。
1.2 仪器与设备
5427R高速冷冻离心机 德国Eppendorf公司;mini Protean3Cell垂直电泳槽、Powerpac Universal电泳仪美国伯乐公司;Gel-Pro Imager Kit电泳凝胶成像系统美国Media Cybernetics公司;15 mm×75 cm中压特制玻璃层析柱 北京索莱宝科技有限公司;MD SpectraMax Plus 384酶标仪 美国BioTek公司;BRIGHTTIME Chirascan-1500圆二色谱仪 日本分光JASCO公司;UV-2600紫外-可见分光光度计 岛津仪器(苏州)有限公司;Easy nLC 1200色谱系统、Q-Exactive HF-X质谱仪美国Thermo Scientific公司。
1.3 方法
1.3.1 脱脂核桃粉的制备
参考文献[19]并稍作修改。将不同产地的核桃仁用0.125 mol/L的NaOH溶液在室温下浸泡30 min,清水漂洗3~4 次,手工剥去核桃皮,50~60 ℃烘干后,按照核桃与石油醚料液比1∶6(g/mL)进行搅拌粉碎和脱脂3 h,旋蒸回收石油醚,重复上述操作步骤,直至滤液无色透明。收集脱脂后的核桃仁碎粒,最后过80 目筛得到脱脂核桃粉末。
1.3.2 核桃粗蛋白的制备
参考黄子林[20]方法稍作修改。将脱脂核桃粉与蒸馏水按料液比1∶10(g/mL)混合,用0.1 mol/L的NaOH溶液将pH值调为8.5,室温搅拌提取1 h后,于4 ℃、5000 r/min离心30 min,取上清液用0.1 mol/L HCl溶液调pH值至5.0,同样于4 ℃、5000 r/min离心30 min后取沉淀物,为消除酸性环境对实验结果的影响,向沉淀物加入适量的蒸馏水和NaOH溶液调至中性,冷冻干燥后即为核桃粗蛋白,收集备用。
1.3.3 双抗夹心ELISA法测定Jug r 1含量
参照植物Jug r 1蛋白酶联免疫分析试剂盒说明书进行,配制质量浓度为1 mg/mL的核桃粗蛋白溶液,按照核桃粗蛋白溶液和样品稀释液体积比1∶4进行混合稀释。分别设置空白孔(不加样品和酶标试剂)、标准孔、待测样品孔,以空白孔调零,在450 nm波长处测定光密度(OD值),在相同条件下测定试剂盒自带质量浓度为2.5、5、10、20、40 ng/L标准品的吸光度,以标准品质量浓度(X)为横坐标,以OD值(Y)为纵坐标,绘制标准曲线,得到标准方程Y=0.0449X-0.0119(R2=0.9974),依据标准曲线计算Jug r 1含量。
1.3.4 硫酸铵分级沉淀法提取Jug r 1
在4 ℃环境下,将脱脂核桃粉与25 mmol/L Tris-HCl中盐缓冲液(pH 7.5,含0.5 mol/L NaCl)按料液比1∶10(g/mL)混合搅拌12 h,然后10000 r/min离心20 min,取上清液并调节pH值至7.5[6]。在4 ℃环境下预冷后,于30 min内边搅拌边缓慢加入一定质量的硫酸铵,完全溶解后静置2 h,在12000 r/min离心30 min,收集沉淀与上清液。按相同的操作使离心后上清液的硫酸铵饱和度依次为0%~20%、20%~40%、40%~60%、60%~80%、80%~100%,每个梯度得到的沉淀透析48 h,冻干备用[21]。
1.3.5 凝胶过滤层析法分离纯化Jug r 1
填料预处理:将20%乙醇溶液已溶胀的Superdex 200 pg填料用适量超纯水反复清洗至无味。
装柱:选取已清洗干净的15 mm×75 cm中压特制玻璃层析柱,垂直固定在铁架台上,出口连接乳胶管,将上述清洗好的Superdex 200 pg填料与适量超纯水充分搅拌至均匀悬浊液后,用玻璃棒引流至层析柱上端管口1~2 cm处,连接进水口并打开恒流泵,用Tris-HCl缓冲液进行压柱与平衡,待凝胶液面不再改变。
上样:将1.3.4节中的硫酸铵沉淀蛋白用Tris-HCl缓冲液配制成质量浓度50 mg/mL的蛋白液,过0.22 μm水系膜,上样至已完全平衡的层析柱,流速为1 mL/min。
洗脱收集:待Tris-HCl中盐缓冲液洗脱至完全出峰后,收集各完整洗脱峰溶液待下一步测定[22]。
1.3.6 SDS-PAGE测定
将1.3.4节和1.3.5节中得到各洗脱峰分别采用12%、15%的分离胶与5%的浓缩胶进行SDS-PAGE分析,上样量为10 μL,恒压80 V,待样品全部进入分离胶后更改电压为120 V,电泳结束后,染色40 min,脱色至背景无色,用凝胶电泳成像系统进行图像采集并分析电泳条带[23],使用Image J软件对蛋白条带进行灰度扫描,分析蛋白纯度[13]。
1.3.7 液相色谱-串联质谱(liquid chromatographytandem mass spectrometry,LC-MS/MS)鉴定
将硫酸铵分级沉淀得到的Jug r 1粗提取组分或分离纯化得到目标蛋白质条带使用Easy nLC 1200色谱系统进行色谱分离。对于粗提取物组分,流动相:A为0.1%甲酸溶液,B为0.1%甲酸-乙腈溶液(乙腈为80%);梯度洗脱程序:0~3 min,95%~92% A、5%~8% B;3~43 min,92%~74% A、8%~26% B;43~48 min,74%~60% A、26%~40% B;48~50min,60%~10% A、40%~90% B;50~60 min,10% A、90% B。
对于纯化后的蛋白质条带,其色谱分离条件为:流动相:A为0.1%甲酸溶液,B为0.1%甲酸-乙腈和水混合溶液(乙腈体积分数80%);梯度洗脱程序:0~2 min,98%~95% A、2%~5% B;2~44 min,95%~72% A、5%~28% B;44~51min,72%~60% A、28%~40% B;51~53min,60%~0% A、40%~100% B;53~60 min,0% A、100% B。肽段分离后用Q-Exactive HF-X质谱仪进行数据依赖采集质谱分析。质谱条件:分析时长为60 min;检测模式为正离子;母离子扫描范围m/z350~1800;二级质谱采集:每次全扫描后触发采集20 个最高强度母离子的二级质谱图谱。使用质谱数据库检索软件MaxQuant 2.0.1.0进行数据库搜索及鉴定。
1.3.8 凝胶过滤层析条件优化
凝胶过滤层析法受洗脱液pH值、上样质量浓度、上样体积与洗脱流速的影响较大[24],参照1.3.5节方法已确定Jug r 1目标蛋白在pH 7.5时溶解性最好,故改变上样质量浓度、上样体积与洗脱流速,研究其对Jug r 1目标蛋白含量和得率的影响,从而对Jug r 1的凝胶过滤层析条件进行优化。其优化条件如表1所示,分别收集各洗脱峰组分并测定Jug r 1含量,按下式计算Jug r 1得率:
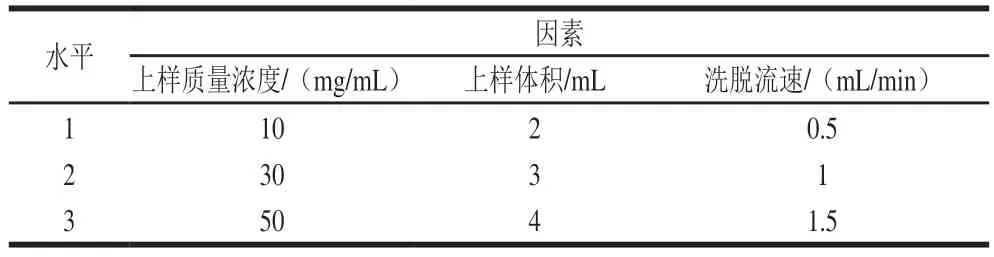
表1 凝胶过滤层析单因素试验因素与水平Table 1 Levels of variables used in single-factor experiments on GFC
1.3.9 圆二色谱检测二级结构
参考Sun Lingge等[25]方法,先用0.01 mol/L的磷酸缓冲液(pH 7.4)将蛋白样品配制为质量浓度1 mg/mL的溶液,12000 r/min离心10 min后取上清液稀释至0.1 mg/mL进行分析,测定条件:室温,带宽0.2 nm,测定范围190~240 nm,平均扫描速率100 nm/min,光径1 mm。将所得样品的圆二色性值转换成平均摩尔椭圆度[θ](deg·cm2/dmol),使用圆二色谱在线分析软件(http://dichroweb.cryst.bbk.ac.uk/html/process.shtml)对结果进行分析转换,计算各二级结构的相对含量。
1.3.10 纯化前后核桃蛋白中Jug r 1含量的测定
选取核桃蛋白、40%~80%硫酸铵沉淀蛋白,以及经凝胶过滤层析后的目标峰组分,测定其Jug r 1含量,具体操作同1.3.3节。
1.4 数据处理
所有实验重复3 次,采用Excel处理数据,利用SPSS 25中单因素方差(ANOVA)进行差异显著性统计分析(P<0.05),并用Origin 2018和Image Lab 3.0(Beta 3)作图。
2 结果与分析
2.1 不同产地核桃蛋白的Jug r 1含量
研究表明,核桃蛋白中的主要蛋白是谷蛋白(主要分布于17~19、33~35、55~70 kDa和250 kDa及以上)和球蛋白(主要分布于10~15、32~34、38~40、50~70 kDa)[26-27]。不同产地核桃蛋白SDS-PAGE如图1A所示,不同产地的核桃蛋白条带分布基本一致,分子质量均在10~75 kDa范围,说明含多种相同的蛋白亚基[28],即这7 种核桃成分组成较为一致,同源性高。另外,不同产地核桃蛋白彼此间条带明暗略有差异,其中保山隆阳的核桃蛋白条带最多,且在11、17、28 kDa和35 kDa附近颜色较深,条带较宽,说明其蛋白含量较高,种类较多。

图1 不同产地核桃蛋白SDS-PAGE图谱与Jug r 1含量Fig.1 SDS-PAGE profiles and Jug r 1 contents of walnut proteins from different regions
双抗夹心ELISA法可以有效用于各种食物中过敏原蛋白的检测[29],不同产地核桃蛋白Jug r 1含量如图1B所示。核桃中Jug r 1含量为:保山隆阳>临沧大泡>昌宁细香>大理龙佳>大理娘青>大理漾濞>大姚三台,其中,保山隆阳核桃中Jug r 1含量最高,为49.73 ng/L,约为大姚三台核桃的2 倍,进一步验证了SDS-PAGE结果。虽然临沧大泡核桃与保山隆阳相比,二者蛋白中Jug r 1的含量没有显著差别,但根据SDS-PAGE结果来看,保山隆阳产地的蛋白分子质量条带比临沧大泡产地的条带更多、颜色更深,各种蛋白分布的特征更明显,更适合于下一步的观察分析和分离纯化。且保山隆阳为云南核桃主产区,选择该地区的核桃进行研究更有意义。因此选取保山隆阳的核桃进行后续分离纯化。
2.2 最佳硫酸铵分级沉淀提取Jug r 1的确定
如图2所示,脱脂核桃粉经Tris-HCl中盐缓冲液提取后,小分子质量条带主要出现在浸提物的上清液中(泳道2),鉴于Jug r 1分子质量在16 kDa附近,故选择上清液进一步硫酸铵分级沉淀。

图2 硫酸铵分级提取后核桃蛋白的SDS-PAGE图谱Fig.2 SDS-PAGE profiles of walnut proteins obtained after ammonium sulfate fractionation
结果显示,硫酸铵饱和度在0%~40%区间的沉淀蛋白主要为大分子质量蛋白(25~75 kDa,泳道3~5),小分子质量蛋白在该区间的条带颜色较浅,随硫酸铵饱和度的增加,饱和度在40%~80%区间(泳道5~6)为小分子质量蛋白集中沉淀区,其条带颜色较深。张煜等[30]研究发现,当硫酸铵饱和度达到50%~65%的情况下,可将分子质量为14~30 kDa的大豆蛋白分离开,其分子质量为30 kDa以下的亚基条带颜色加深,说明这些亚基含量相对较多,且蛋白的分级分离效果最好,这与本实验结果相似。考虑到饱和度在80%~100%区间的沉淀蛋白中硫酸铵饱和结晶过多,蛋白含量较少,难以收集且影响实验结果。因此,后续选择硫酸铵饱和度为40%~80%区间收集沉淀蛋白。
2.3 硫酸铵分级沉淀粗提Jug r 1的鉴定
对40%~80%饱和硫酸铵的沉淀进行SDS-PAGE分析,结果如图3A所示。将符合目标蛋白分子质量范围的凝胶(11~17 kDa左右凝胶,红色标记范围)切下。硫酸铵饱和度为40%~80%区间获得的目标沉淀蛋白经LC-MS/MS鉴定分析,如图3B所示,该区域的凝胶检测出致敏蛋白Jug r 1、Jug r 4、Jug r 6以及其他非致敏蛋白的存在。通过Uniprot蛋白质序列数据库(http://www.uniprot.org/)对其蛋白含量检索发现,其中致敏蛋白Jug r 1的相对含量最高达到37.70%,占总致敏蛋白含量的76.03%。此外,经LC-MS/MS鉴定和相对定量结果可以看出(图3C和表2),硫酸铵饱和度为40%~80%区间蛋白条带的蛋白数量与丰度较大,质谱所收集到的关键峰以及组分复杂。图3C中标注有出峰时间的均为目标蛋白Jug r 1,其主要集中在20~30 min附近出峰,当出峰时间在27.0446 min时,目标蛋白Jug r 1相对丰度最高,峰面积最大。由表2可以看出,P93198序列蛋白为致敏蛋白Jug r 1,其相对分子质量达到16.4 kDa,Jug r 1的覆盖率最高达到44%。以上结果表明,采用饱和度为40%~80%硫酸铵分级沉淀的方法可较好地初步分离纯化核桃致敏蛋白Jug r 1。
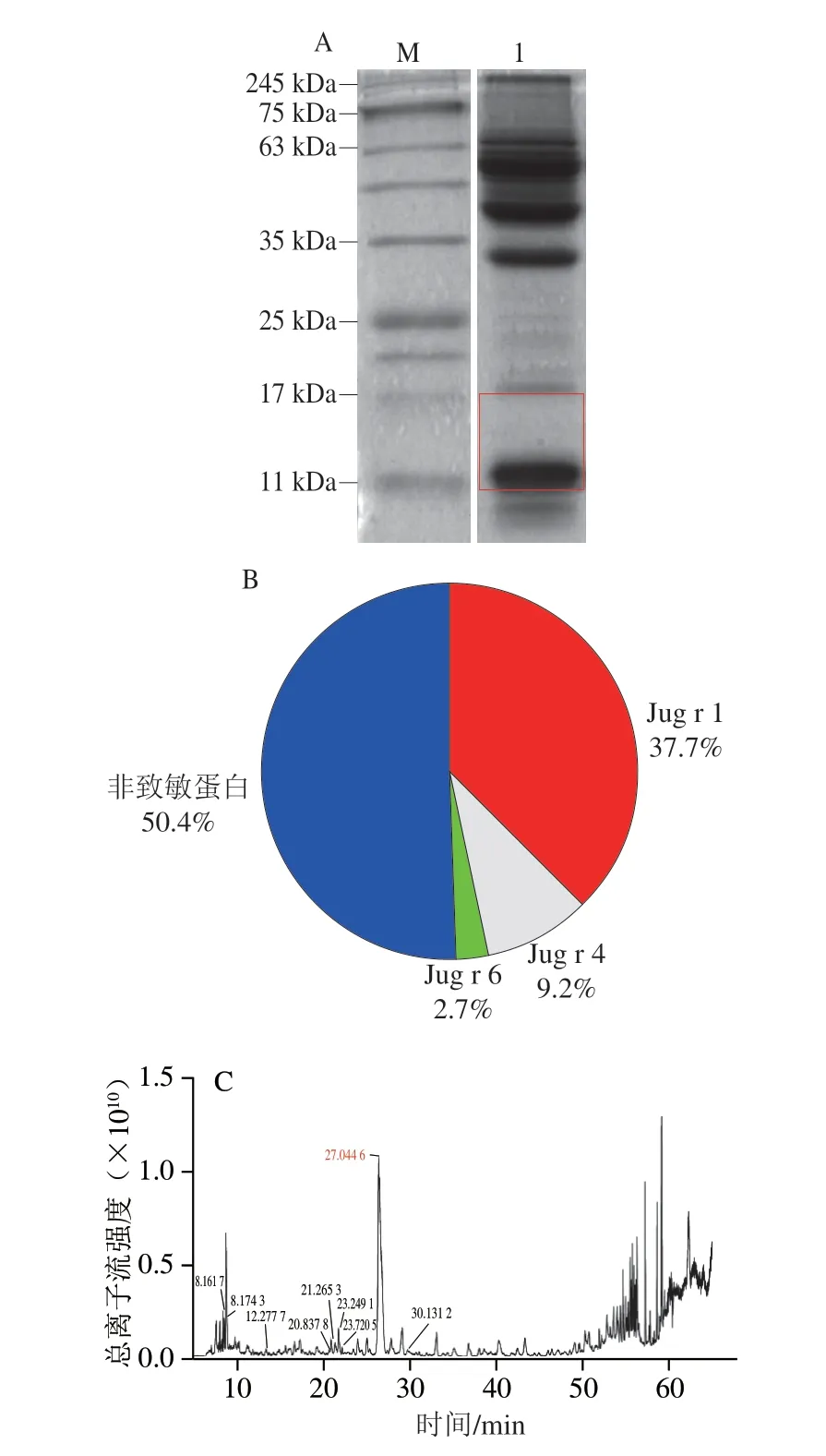
图3 40%~80%饱和硫酸铵沉淀提取后核桃蛋白的SDS-PAGE图谱和总离子流图Fig.3 SDS-PAGE profiles and total ion current chromatogram of walnut proteins obtained after 40%–80% saturated ammonium sulfate fractionation

表2 40%~80%饱和硫酸铵沉淀提取后核桃蛋白的LC-MS/MS鉴定结果Table 2 LC-MS/MS identification of walnut proteins obtained after 40%-80% ammonium sulfate fractionation
2.4 Jug r 1凝胶过滤层析纯化条件的确定
凝胶层析柱中的Superdex 200 pg是一种惰性的多孔网状结构的凝胶物质,可利用不同蛋白分子大小流经的途径差异将其分离[31]。如图4A所示,饱和度区间为40%~80%的粗蛋白液经凝胶层析过滤后,当洗脱时间约为40 min时出现第1个峰,直至240 min左右结束出峰,共计出现6 个洗脱峰,按照出峰顺序标记为F1~F6。除F2外,几乎所有峰的峰高较高,峰形窄而尖,说明分离效果较好。对6 个洗脱峰进行SDS-PAGE分析,结果如图4 B 所示,F 1 所含蛋白组分较少,且条带颜色较淡;F2、F3蛋白组分冗杂,其分子质量主要集中在20~75 kDa之间,属于高分子质量蛋白;F4收集的蛋白质组分只有1 条清晰的条带,其分子质量主要集中在11~17 kDa左右,符合目标蛋白Jug r 1的分子质量范围;F5、F6处的蛋白浓度较低,几乎检测不到蛋白条带。采用Image J软件对凝胶过滤层析后F4组分的SDS-PAGE蛋白条带进行灰度值扫描,结果如图5所示,根据蛋白电泳条带峰面积,计算得到F4组分的蛋白纯度占总蛋白的96.83%。因此,选择F4组分的蛋白进行后续研究。
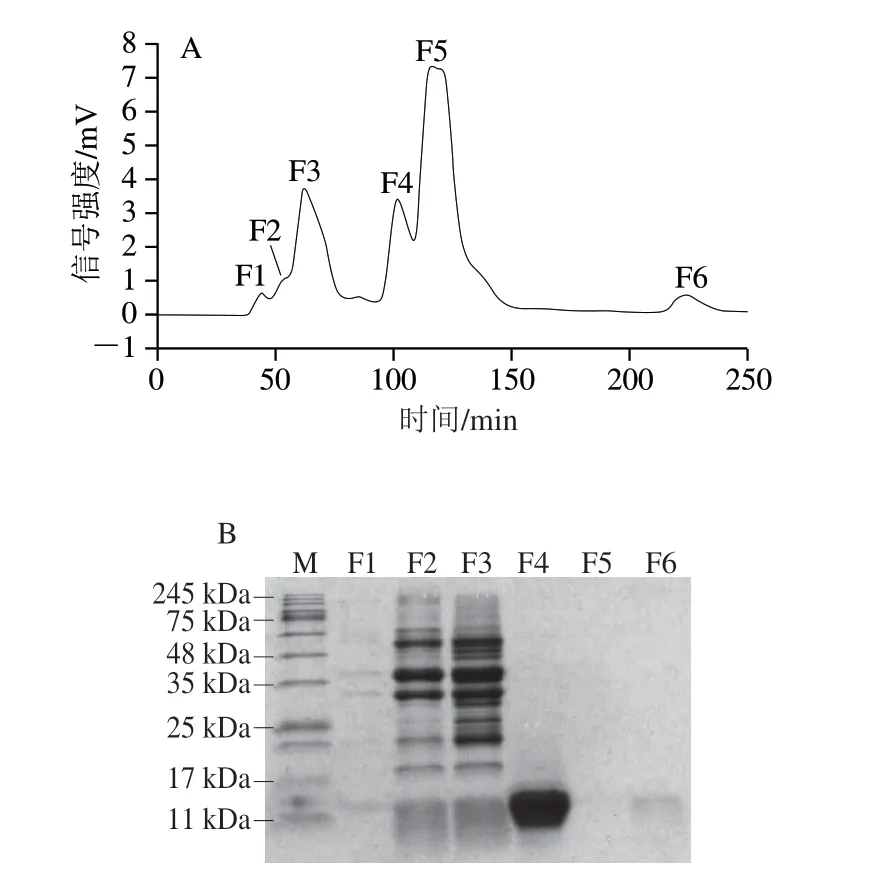
图4 40%~80%饱和硫酸铵沉淀提取后核桃蛋白的凝胶层析分离结果Fig.4 Gel filtration chromatographic separation and SDS-PAGE analysis of walnut proteins obtained after 40%-80% ammonium sulfate fractionation
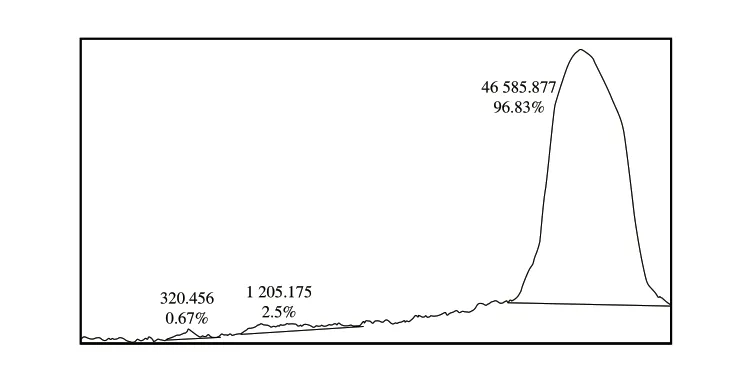
图5 凝胶层析分离后F4组分的SDS-PAGE灰度扫描峰面积图Fig.5 SDS-PAGE grayscale scanning peak area of F4 obtained after gel filtration separation chromatography
2.5 LC-MS/MS鉴定分析
将F4组分样品经透析除盐、冻干后进行LC-MS/MS检测,其总离子流图如图6所示。经过凝胶过滤层析分离纯化后的目标蛋白Jug r 1与硫酸铵沉淀法初级分离纯化的粗蛋白相比,质谱收集的关键峰组分较少,表明分离纯化之后,目标蛋白Jug r 1纯度提高,其关键出峰时间主要集中在57 min附近,经数据比对发现,出峰时间分别在56.545、57.579、58.087、58.153 min附近的为目标蛋白Jug r 1。综合表3可知,F4组分的肽段数量单一,丰度较高,其中序列号为P93198的蛋白分值最高,其分子质量为16.373 kDa,氨基酸序列为139,符合Jug r 1的典型特征[8]。此外质谱共检测到14 条肽段,均为对应蛋白质组中的唯一肽段,其中2 条肽段(GEEMEEMVQSAR、QQQQQGLR)为目标蛋白Jug r 1所唯一对应的肽段,总肽段长度最长(100~119),肽段分值最高(表4),故将其鉴定为Jug r 1。其他肽段使用UniProt蛋白质序列数据库(http://www.uniprot.org/)检索发现,均为非致敏蛋白,其蛋白质类型主要为蛋白组功能、分子功能、生物过程物质,如细胞骨架(A0A834CXD8)、脂肪酸结合(A0A2I4E8T0)、DNA转录(A0A6P9EG14)等。
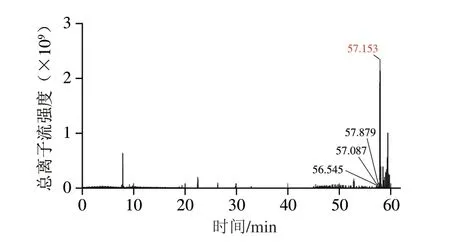
图6 目标组分的LC-MS/MS总离子流图Fig.6 Total ion current chromatogram of of the target fraction
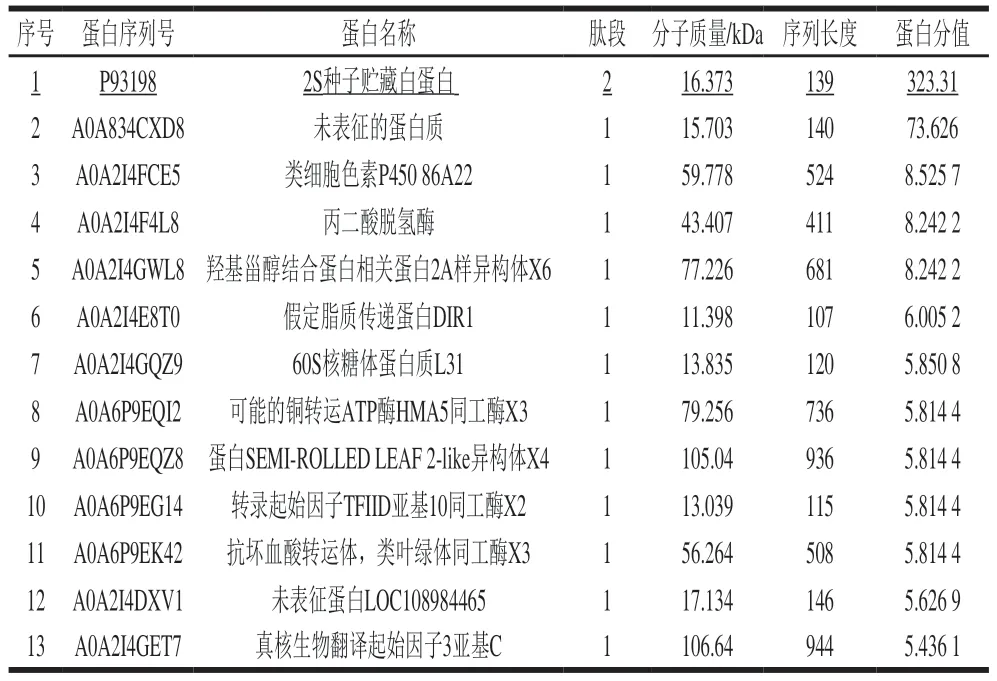
表3 目标组分的LC-MS/MS鉴定结果Table 3 Results of LC-MS/MS identification of the target fraction
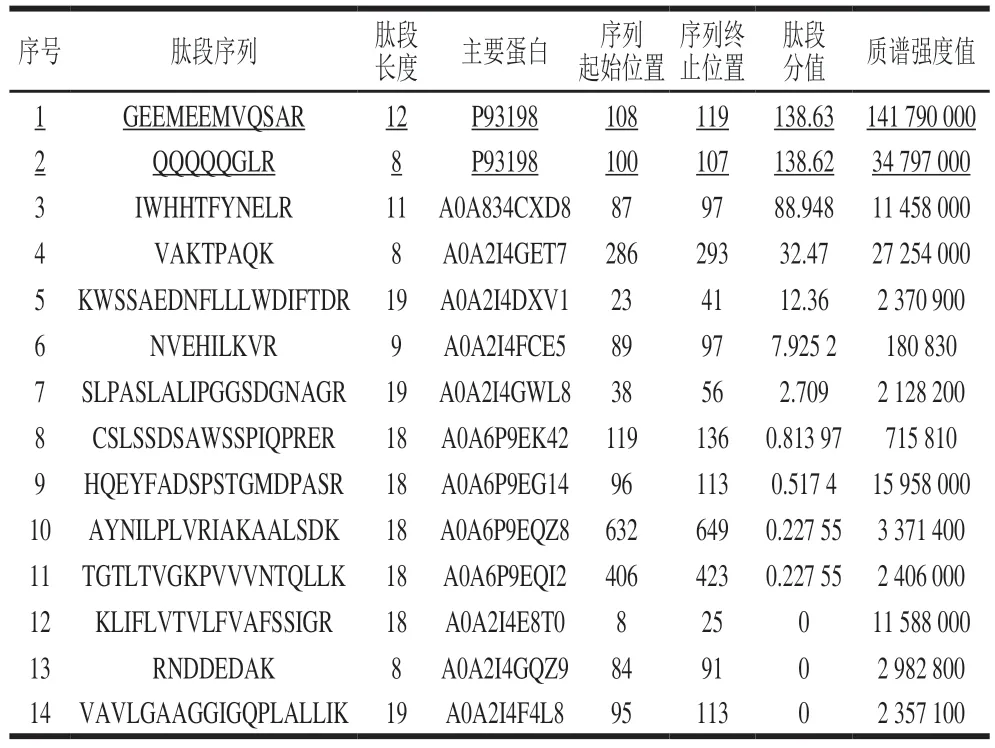
表4 目标组分的LC-MS/MS肽段鉴定Table 4 LC-MS/MS peptide identification table of the target fraction
2.6 凝胶过滤层析条件优化
单因素试验结果如图7A、B所示,Jug r 1的蛋白含量随上样质量浓度的增加呈上升的趋势,但蛋白得率却呈下降趋势,原因在于样品质量浓度随着上样质量浓度的增加而增大,而上样体积、洗脱流速保持固定不变,这导致Jug r 1增加的比例远小于样品增加的比例。综合蛋白吸收信号峰值及目标蛋白Jug r 1得率,选择上样质量浓度为30 mg/mL。由图7C、D可知,Jug r 1的蛋白吸收信号峰值随上样体积的增加而增大,当上样体积为4 mL时,此时的样品质量浓度最高,Jug r 1含量最高,而Jug r 1得率却与上样体积为3 mL的相比无显著差异(P>0.05),为了更方便检测Jug r 1的蛋白含量,综合考虑选择上样体积为4 mL。图7A~D结果与赵春燕等[32]报道一致,当上样质量浓度与上样体积继续增加时,蛋白吸收信号峰宽会有所增加,致使峰与峰之间分离不彻底,同时对蛋白质的得率无显著提高作用,反而造成蛋白的浪费。

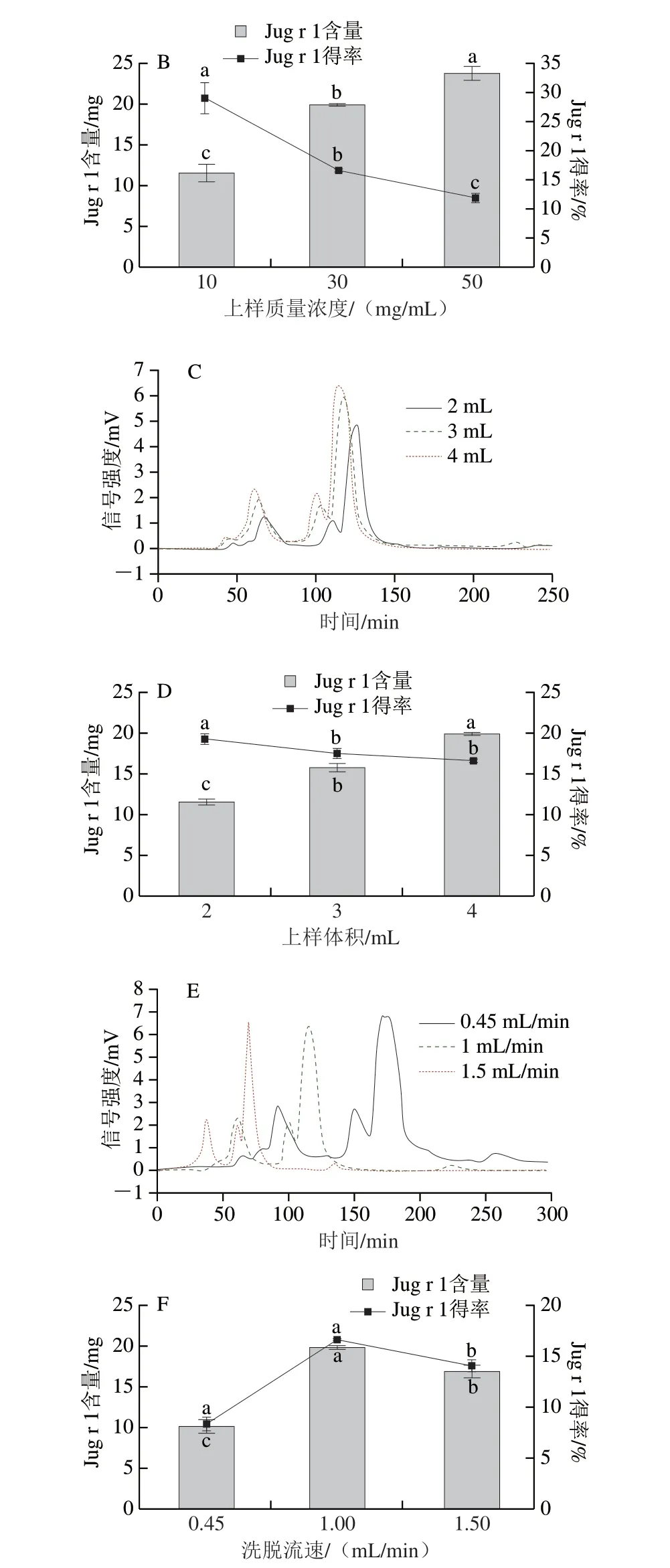
图7 凝胶过滤层析影响因素优化Fig.7 Optimization of influential factors of gel filtration chromatography
由图7E、F得知,Jug r 1含量和得率随着洗脱流速的增加呈上升后下降的趋势,当洗脱流速为1 mL/min时,Jug r 1含量和得率分别达到最高(P<0.05)。当洗脱开始后,样品质量浓度随着洗脱流速的增加而增加,此时Jug r 1含量和得率有所上升,但持续增加洗脱流速,洗脱流速过快造成部分样品直接没有分离而被洗脱,导致Jug r 1含量和得率下降。综合而言,过快或过慢的洗脱流速都会降低对Jug r 1分离纯化的效果,故选择洗脱流速为1 mL/min。
综上所述,确定凝胶层析最佳条件为上样质量浓度30 mg/mL、上样体积4 mL、洗脱流速1 mL/min,在此条件下Jug r 1目标蛋白含量和得率最高,分别为19.90 mg/120 mg上样量和16.58%。
2.7 二级结构的表征
蛋白的二级结构是组成高级结构的基础,圆二色谱是研究蛋白质溶液二级结构的有效方法,其中肽键的吸收范围在远紫外区能通过电子跃迁产生这个区域的信号,从而揭示肽链骨架结构信息[33-34]。过敏原Jug r 1的圆二色谱图及其二级结构(α-螺旋、β-折叠、β-转角以及无规卷曲)的相对含量如图8所示。由图8A所示,过敏原Jug r 1在190~200 nm间有一正谱峰,于195 nm波长处为最大吸收峰,并显示出209 nm和223 nm的双负峰谱带的存在,其中209 nm负峰是α-螺旋肽键的π-π*跃迁所致,223 nm负峰是α-螺旋肽键的n-π*跃迁所致[16,35],表明过敏原蛋白Jug r 1明显存在α-螺旋结构。另外,通过圆二色谱在线软件分析得到其二级结构相对含量结果如图8B所示,过敏原Jug r 1的二级结构中α-螺旋相对含量最大为49.89%(P<0.05),然后依次为无规卷曲(24.50%)、β-转角(17.70%)、β-折叠(7.95%),这说明核桃过敏原Jug r 1以多种构象共存,并以α-螺旋结构为主。目前鲜见过敏原Jug r 1二级结构的报道,因此本实验结果可为核桃过敏原蛋白Jug r 1的后续研究提供一定参考。

图8 Jug r 1的圆二色谱图谱和二级结构单元组分图Fig.8 CD spectrum and secondary structure composition of Jug r 1
2.8 核桃蛋白纯化前后Jug r 1的含量
双抗夹心ELISA具有灵敏度高、特异性强、操作方便等优点,广泛应用于致敏蛋白的定性和定量分析[36]。采用双抗夹心ELISA法检测核桃蛋白分离纯化前后Jug r 1的含量变化如图9所示,核桃蛋白的Jug r 1含量最低,经40%~80%硫酸铵分级沉淀后,其Jug r 1含量呈显著上升趋势(P<0.05),最后再经凝胶过滤层析后,Jug r 1的含量最高(16.73 ng/L),显著高于核桃蛋白和硫酸铵分级沉淀蛋白中Jug r 1含量(P<0.05),说明经过“两步”分离纯化可提高过敏蛋白Jug r 1的含量,为后续深入研究核桃蛋白的致敏性奠定基础。
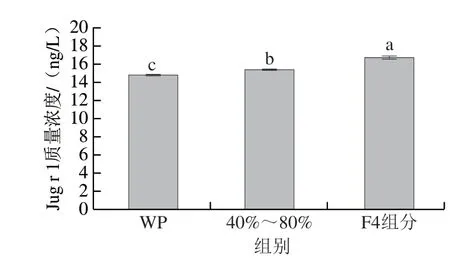
图9 核桃蛋白纯化前后Jug r 1的含量变化Fig.9 Changes in Jug r 1 content of walnut protein before and after purification
3 结论
针对云南不同产地的核桃,筛选出Jug r 1含量最高的保山隆阳产地核桃为原料,对其进行硫酸铵分级沉淀、Superdex 200 pg凝胶过滤层析以分离纯化Jug r 1,并采用SDS-PAGE、ELISA和LC-MS/MS等手段对Jug r 1进行鉴定。在纯化过程中,确定了目标蛋白Jug r 1的最佳硫酸铵沉淀饱和区间以及凝胶过滤层析的最佳条件,“两步”分离纯化可获得蛋白含量为19.90 mg/120 mg上样量、蛋白纯度占总蛋白96%以上的Jug r 1。圆二色谱表明,纯化的Jug r 1以α-螺旋结构为主,双抗夹心ELISA结果显示,经“两步”分离纯化后的核桃蛋白中Jug r 1含量显著上升。本研究技术路线简单、设备要求低、耗时短、重复性好,适合实验室少量制备,也可为核桃致敏蛋白Jug r 1后续的相关研究和应用提供科学参考。

