二醛木糖的合成及其交联性质分析
荆树桐,李正盛奥,李 涵,曹红花,厉雪聪,刘永浩,于嘉淇,温璟如,孙 逊,*
(1.中国海洋大学食品科学与工程学院,山东 青岛 266000;2.西安交通大学前沿科学技术研究院,陕西 西安 710054)
食品加工过程中往往通过加入各种交联剂,改变蛋白质的凝胶性、持水性[1]、稳定性[2]、乳化特性[3]等性质,从而赋予产品更高的肉质弹性以及更好的贮藏稳定性[4-5]。食品交联剂在肉制品、乳制品、乳液凝胶和食品包装及膜领域拥有广泛应用[6]。根据GB 2760—2014《食品添加剂使用标准》规定,可用于食品中的交联剂有谷氨酰胺转氨酶(transglutaminase,TG)和戊二醛[7],在肉制品中使用TG可增强肉制品质地、弹性和保水性而不对感官产生不良影响[8]。但TG属于生物大分子,由于体积太大,受分子动力学影响难以通过扩散方式进入蛋白质内部,因此其适用于高分散度的蛋白质体系(肉糜、蛋白乳等)或蛋白物料表面,不适用于海参、龙虾等整体蛋白质系统的交联。
戊二醛是一种小分子有机化合物,其分子质量小,因此渗透性非常优异。戊二醛的交联活性来源于其两端的醛基与氨基反应生成亚胺,因此对多氨基大分子的交联效果尤为优异,如蛋白质、壳聚糖等[9]。除此之外,基于戊二醛交联生物聚合物制备的薄膜生物降解性强,为可食用包装材料提供了新的思路和发展方向,具有广阔的应用前景[10]。然而,戊二醛具有较高的毒性,小鼠经口急性毒性LD50为166 mg/kg(以体质量计)[11],美国和欧盟一直禁止其在食品工业中使用[12],我国也仅允许戊二醛在肠衣的制作中作为交联剂少量使用。
糖类的定义是多羟基醛或多羟基酮。当醛糖的伯氨基氧化后,所生成的含有2 个醛基的多羟基物质叫做二醛糖。这一物质继承了糖类的基本骨架,因此有着较高的安全性预期,同时在同一分子中也如戊二醛一样,有2 个醛基,从结构上分析也可以交联蛋白质或壳聚糖。Steiner等[13]以葡萄糖为原料合成了二醛木糖,并证明了其可以与氨基酸的伯氨基发生两次亲电加成,证明了其与小分子上的伯氨基反应的活性,但该分子对蛋白或壳聚糖等生物大分子的加成活性尚鲜见报道。此外,Steiner仅把二醛木糖作为中间体直接用于后续合成,并未单独表征其真正结构,因此二醛木糖的存在形态,尤其是在水溶液中的具体结构目前尚不明了。为了解析二醛木糖的结构,以及验证其对大分子的交联活性,本研究以单丙酮葡萄糖为原料制备了二醛木糖,并使用该糖交联壳聚糖制备壳聚糖凝胶,通过质构分析、水分子活度分析、低场核磁等方法表征交联后凝胶的性质。本研究结果不仅可证明以二醛木糖为代表的二醛糖的交联活性,也为安全高效的新型小分子交联剂开发提供理论指导。
1 材料与方法
1.1 材料与试剂
冰乙酸(分析纯)、甲醇、正己烷、乙酸乙酯 国药集团化学试剂有限公司;高碘酸钠 上海麦克林生化科技有限公司;单丙酮葡萄糖、Amberlite IR-120阳离子交换树脂(钠型)、壳聚糖 上海源叶生物科技有限公司。
1.2 仪器与设备
GYW-1MX科技型水分活度仪 深圳冠亚水分仪科技有限公司;DSC 200 PC差示扫描量热仪 德国Sebur公司;低场核磁共振 上海纽曼电子科技有限公司;电子天平 上海梅特勒-托利多仪器有限公司;HH-4数显恒温水浴锅 国华电器有限公司;IMS-50制冰机 河南兄弟仪器设备有限公司;压力蒸汽灭菌锅 上海博迅医疗生物仪器股份有限公司;磁力搅拌器 海门市其林贝尔仪器制造有限公司;薄层层析色谱板 美国Millipore公司;Pro Pulse 500MHz核磁共振仪 美国Agilent Technologies公司。
1.3 方法
1.3.1 交联剂合成
1.3.11 单丙酮二醛木糖制备
参考Steiner等[13]报道的合成路线并稍作修改,具体方法如下:取13.252 g单丙酮葡萄糖(图1,化合物I)于圆底烧瓶中,加入300 mL甲醇混合均匀,冰浴,使体系温度保持在0 ℃。取12.84 g高碘酸钠于100 mL水中配制为溶液,利用分液漏斗缓慢加入高碘酸钠溶液并搅拌,滴加时间40 min。滴加完成后,控制体系温度保持在0 ℃,搅拌,通过薄层层析色谱判定反应情况。反应结束后减压移除溶剂,残留物通过硅胶层析分离,得单丙酮二醛木糖(图1,化合物II)(洗脱液成分为乙酸乙酯∶正己烷=3∶7,V/V)。
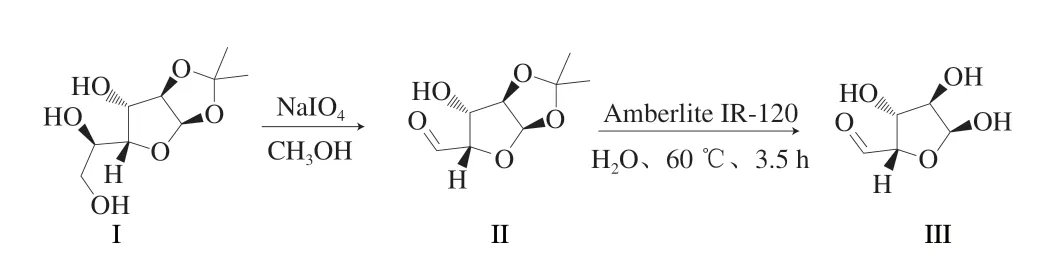
图1 二醛木糖合成途径Fig.1 Synthetic routes of dialdoxylose
1.3.12 二醛木糖制备
取单丙酮二醛木糖(图1,化合物II)1.23 g于100 mL圆底烧瓶中,加入2.52 g强酸性阳离子交换树脂Amberlite IR-120,加入32.68 mL超纯水,混合均匀,60 ℃保温搅拌3.5 h,期间每0.5 h使用薄层层析色谱监测(层析液为纯乙酸乙酯),直至反应原料完全消耗。经旋转蒸发,获得目标化合物二醛木糖(图1,化合物III)。
1.3.13 二醛木糖在水溶中存在形态的表征
以核磁共振波谱表征常温下二醛木糖在水中的存在形态,取二醛木糖10 mg,溶解于0.5 mL重水中,转移进核磁管。测定氢谱(1H nuclear magnetic resonance,1H NMR)、碳谱(13C nuclear magnetic resonance,13C NMR)、氢-氢相关谱(H-H correlation spectroscopy,H-H COSY)、异核单量子关系谱(heteronuclear single quantum coherence,HSQC)以及异核多量子关系谱(heteronuclear multiple-bond correlation,HMBC)。
1.3.2 不同温度下制备壳聚糖凝胶
配制体积分数为1%的乙酸溶液200 mL,加入壳聚糖8.00 g,磁力搅拌24 h,静置24 h,得质量浓度为0.04 g/mL的壳聚糖溶液[14]。取多个三角瓶加入30 mL壳聚糖溶液,分别加入二醛木糖0.075、0.105 g,配制成质量浓度为0.0025、0.0035 g/mL二醛木糖的壳聚糖溶液,同时设置对照组。分别在80、121 ℃[12,15-16]进行交联,对交联产物进行质构检测。
1.3.3 不同交联剂质量浓度制备壳聚糖凝胶
配制体积分数为1%乙酸溶液400 mL,加入壳聚糖16.00 g,磁力搅拌24 h,静置24 h,获得质量浓度为0.04 g/mL的壳聚糖溶液,将其分装在18 个三角瓶中,每个20 mL。
将二醛木糖依次配制成质量分数为2.5%、2.0%、1.5%、1.0%、0.5%的溶液,各取6.25 mL加入分装好的壳聚糖溶液中,配制成质量浓度为0.001、0.002、0.004、0.005、0.006 g/mL的壳聚糖溶液,每组3 个平行,同时设置对照组。在121 ℃交联5 min,对交联产物进行凝胶性质分析。
1.3.4 质构检测
参考陈海华等[17]的过程设计质构检测实验,略作修改。将壳聚糖交联产物切成边长均匀的正方体[18]进行测定,测定条件为:测试速率60 mm/min,触发力1 N,压缩形变率65%,循环间持续时间0。测定在0.001、0.002、0.004、0.005、0.006 g/mL交联剂质量浓度下(当交联剂添加质量浓度为0 g/mL时,产物为液态,故无法测定质构),交联产物硬度、咀嚼性、弹性和胶黏性的变化[19]。
1.3.5 水分活度检测
参考吴琼琳等[20]方法,采用水分活度仪进行测定。测定时间为15 min,测定前使用饱和NaCl溶液进行水分活度传感器校正。取待测交联产物于平皿中央,并摊平,使样品覆盖平皿60%左右的面积进行测定,共测0、0.001、0.002、0.004、0.005、0.006 g/mL六组梯度。
1.3.6 低场核磁检测
参考文献[21-22]进行低场核磁检测,略作修改。采用CPMG脉冲序列采集样品NMR信号,通过反转信号数据得到T2弛豫谱,可以获得样品中水分存在状态及分布状况;并用核磁共振成像仪捕捉质子加权像,可以反映样品中氢质子的分布,进而可以得到水分分布。测定参数:90°脉冲时间9.5 μs,180°脉冲时间19.0 μs,采样点数1024,扫描次数8,回波时间200 μs,回波数3500,频谱宽度200 kHz,重复采样等待时间4000 ms。
1.3.7 差示扫描量热法
参考江磊等[23]的方法,略作修改,为研究交联后壳聚糖的热稳定性,采用DSC 200 PC差示扫描量热仪,在20~200 ℃范围内以10 ℃/min的速率升温,在N2的氛围下对不同交联剂质量浓度的壳聚糖进行差示扫描量热分析。
2 结果与分析
2.1 二醛木糖的结构及其在水中存在形态
以单丙酮葡萄糖为原料(图1,化合物I),经高碘酸钠氧化断裂结构中的邻二羟基,脱除一分子甲醛后获得单丙酮二醛木糖中间体(图1,化合物II),后者经固体酸Amberlite IR-120催化水解获得目标二醛木糖(图1,化合物III)。在此基础上,对产物进行高分辨质谱检测,通过分子质量确定产物结构的存在。如图2A所示,产物的高分辨质谱的最高丰度峰对应分子质量为319.0644 Da,而目标产物二醛木糖二聚体与钠结合粒子[2M+Na]+的理论相对分子质量为319.0641 Da,二者差距的绝对值为0.0003 Da,相对值为0.0003/319.0641=0.94×10-6。此偏差远小于高分辨质谱测定分子质量允许的误差范围(<5.0×10-6),因此可以判定该峰即为二醛木糖二聚体与钠结合粒子,即可判定目标分子质量的存在。
图2 二醛木糖结构表征Fig.2 Structure characterization of dialdoxylose
在此基础上,再使用1H NMR表征产品,以确定其化学结构。由于样品溶剂为重水,所以所有OH基团中的活泼H均通过H-D置换,因而在1H NMR中不显示,则显示的H信号均为C—H信号。如图2B所示,1H NMR图谱中共有7 组信号,对应至少7 种C—H,且异头碳区(4.5×10-6~6.0×10-6)中包含3 组信号,非异头碳区包含2 组信号。而二醛木糖中仅有5 种C—H,这一差距表明该样品中的二醛木糖是一组混合物。在此基础上,再对样品进行H—H COSY(图2C)、13C NMR(图2E)、HSQC(图2F)以及HMBC(图2G)分析,得出结论:产物中存在2 个共振体系,即2 种化合物;一种化合物高度对称(占比44.4%),因此仅显示3 组C—H信号,仅有1 个异头碳信号(δ=4.58,d,J=8.0 Hz),符合β构型;另一种化合物不对称(占比65.6%),显示5 组C—H信号,其中异头碳信号2 个,分别位于5.10×10-6和4.91×10-6处,均为d峰,耦合常数分别为3.8 Hz和8.1 Hz,说明这两个异头碳呈α,β构型;两种化合物中,各有1 个C—H信号在δ=3.13~3.19区域相互重叠,因此在1H NMR图谱上显示的信号总数为7 组。根据HMBC结果,不对称化合物的异头碳均相互关联,说明异头碳的距离在3 个化学键之内,因而这2 个化合物均以环状存在。
综上,可以推出所得二醛木糖在水溶液中呈2 种结构(图2D),其中一个为高度对称的β,β-二醛木糖,由于对称性,在1H NMR图谱中二个β异头碳的C—H显示同一个信号,C2-H和C4-H显示同一个信号,而C3-H显示一个信号,因此该化合物显示3 个信号;另一个是不对称的α,β-二醛木糖,有5 个不同的C—H,显示5 组不同的信号。至此,二醛木糖的存在形态得以验证。
2.2 二醛木糖对壳聚糖溶液的交联效果的表征
2.2.1 二醛木糖交联机理
Schoevaart等[24]证明了二醛半乳糖(与本研究的二醛木糖属同系物,但主链上多一个HCOH单元)可以与小分子伯胺类化合物发生交联,交联过程主要包括亚胺化及Amadori重排两个反应。实验中使用的生物大分子-壳聚糖的主要官能团也是伯胺,也可以发生上述2 个反应[25],据此推测二醛木糖对壳聚糖交联作用机理如图3所示。二醛木糖经加热后瞬间开环,形成开链二醛木糖中间体,其主链结构与戊二醛相同(图3A,虚线内红色键表示)。在加热条件下,二醛木糖开链结构中的二个醛基可与壳聚糖分子中的氨基反应生成亚胺结构[26-27](图3B,美拉德反应初期),当1 个二醛木糖分子分别与2 个不同蛋白质分子上的氨基发生反应时,所得到的结果则是两个蛋白质分子经同1 个二醛木糖的亚胺化反应,产生交联;在高温下,由于二醛木糖的糖类属性,其羟基可以与亚胺进一步产生Amadori重排,此反应不可逆,因此经过重排后,交联的稳定性进一步提高[12,28]。由于该交联体系交联的位点是氨基,因此二醛木糖的交联底物并不限于本研究中使用的模型化合物壳聚糖,理论上所有包含氨基基团的大分子都可以被二醛木糖交联,如蛋白质、聚赖氨酸等。
图3 二醛木糖交联壳聚糖机理及交联实物展示Fig.3 Mechanism and physical display of dialdoxylose crosslinking
2.2.2 交联温度和时间对凝胶质构的影响
在此基础上,本研究在不同温度、不同交联时间下,以二醛木糖交联壳聚糖,得到了富有弹性的凝胶,具体数据见表1。
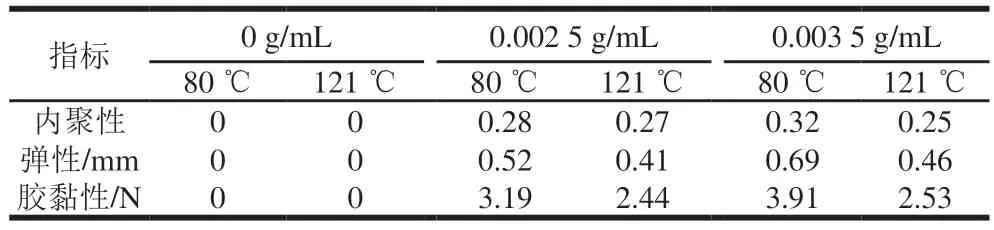
表1 二醛木糖交联壳聚糖质构数据Table 1 Texture properties of dialdoxylose crosslinked chitosan
对比不同二醛木糖质量浓度和不同交联温度得到的交联壳聚糖的内聚性,发现使用80 ℃、0.0035 g/mL二醛木糖条件下内聚性最好,形态表现为浅褐色固体;对比不同条件下的弹性数值,发现使用80 ℃、0.0035 g/mL二醛木糖条件下弹性最好;对比不同条件下的胶黏性数值,发现同样是使用80 ℃、0.0035 g/mL二醛木糖条件下胶黏性最好[29];最后对比不同条件下的咀嚼性数值,发现同样是使用80 ℃、0.0035 g/mL二醛木糖条件下咀嚼性最好。综上所述,使用80 ℃、0.0035 g/mL二醛木糖得到的交联壳聚糖效果最佳。
通过对比发现,使用较高质量浓度的二醛木糖得到的交联效果更好,使用0.0035 g/mL二醛木糖对比使用0.0025 g/mL二醛木糖,在80 ℃或121 ℃进行交联时都体现出了更好的交联效果,在80 ℃为浅褐色固体,121 ℃形成深褐色固体。预计交联效果与二醛木糖质量浓度在一定范围内呈现出正相关的趋势。
此外,在80 ℃和121 ℃两种交联温度下,80 ℃时交联效果更好。可能原因是二醛木糖属于糖类,因此可以发生美拉德反应、焦糖化反应,在温度较高时二醛木糖发生美拉德反应更为明显,所以对于以二醛木糖作为交联剂,使壳聚糖发生交联的效果有一定的影响[30]。
2.2.3 固态凝胶的性质
2.2.31 水分活度分析
如图4所示,当交联剂质量浓度升至0.001 g/mL和0.002 g/m L 后,样品水分活度有所上升,但在0.004 g/mL时水分活度下降至与空白相当水平,在0.005 g/mL和0.006 g/mL条件下,水分活度有大幅上升,从而在交联剂质量浓度为0.006 g/mL时达到最高,为0.996。
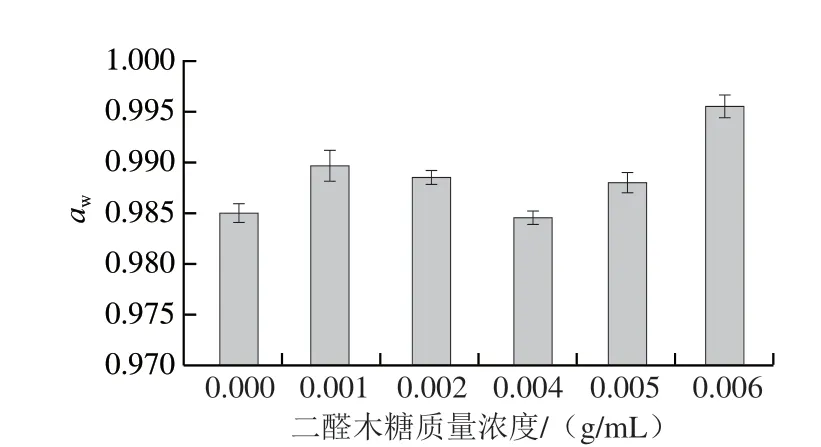
图4 不同质量浓度交联剂交联产物的水分活度Fig.4 Water activity of crosslinked chitosan with different concentrations of dialdoxylose
2.2.3.2 质构分析
通过质构测定得到4 组数据,发现当交联剂质量浓度在0.002 g/mL时,交联产物硬度、咀嚼性、胶黏性处于最佳状态,在质量浓度逐渐升高至0.006 g/mL过程中,硬度、咀嚼性、胶黏性均呈下降趋势。这可能是因为交联剂分子填充到凝胶网络中,减弱了壳聚糖与水分子的交联作用,从而导致硬度、咀嚼性、胶黏性的变化[31]。交联剂质量浓度为0 g/mL时,产物为黏稠液体状态,无法进行质构分析,因此不在图5中展示。产物的弹性在交联剂质量浓度为0.002、0.004、0.006 g/mL时差别较小,均为1.05 mm左右,当交联剂质量浓度较低为0.001 g/mL时,弹性较低为0.55 mm。
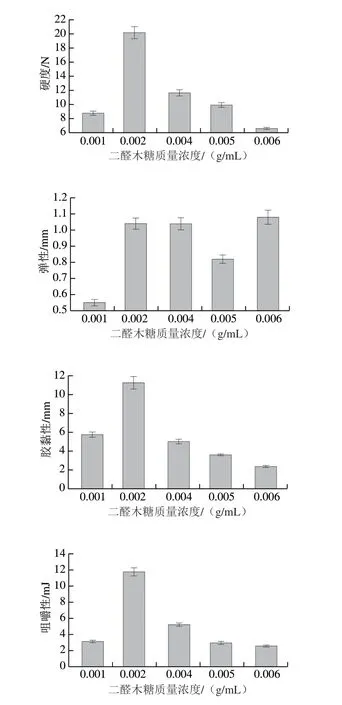
图5 不同质量浓度交联剂交联壳聚糖溶液的质构变化Fig.5 Texture changes of crosslinked chitosan with different concentrations of dialdoxylose
2.2.33 低场核磁检测分析
对MRI图像进行伪彩处理(图6)可以清楚地看到壳聚糖凝胶中水分的分布,图中颜色不同表示水分含量的变化,红色越多,样品中H+密度越高,代表水分活度越高[32]。由图7可知,交联剂质量浓度0 g/mL的壳聚糖凝胶样品成像中红色的信号显而易见,即水分活度高;0.002 g/mL的壳聚糖凝胶水分含量也较高,而随着交联剂质量浓度的上升,壳聚糖凝胶样品成像中红色信号减少,即水分活度降低,说明交联剂的加入降低了凝胶内部游离水的含量,可以反映出凝胶持水性能的增强[33]。
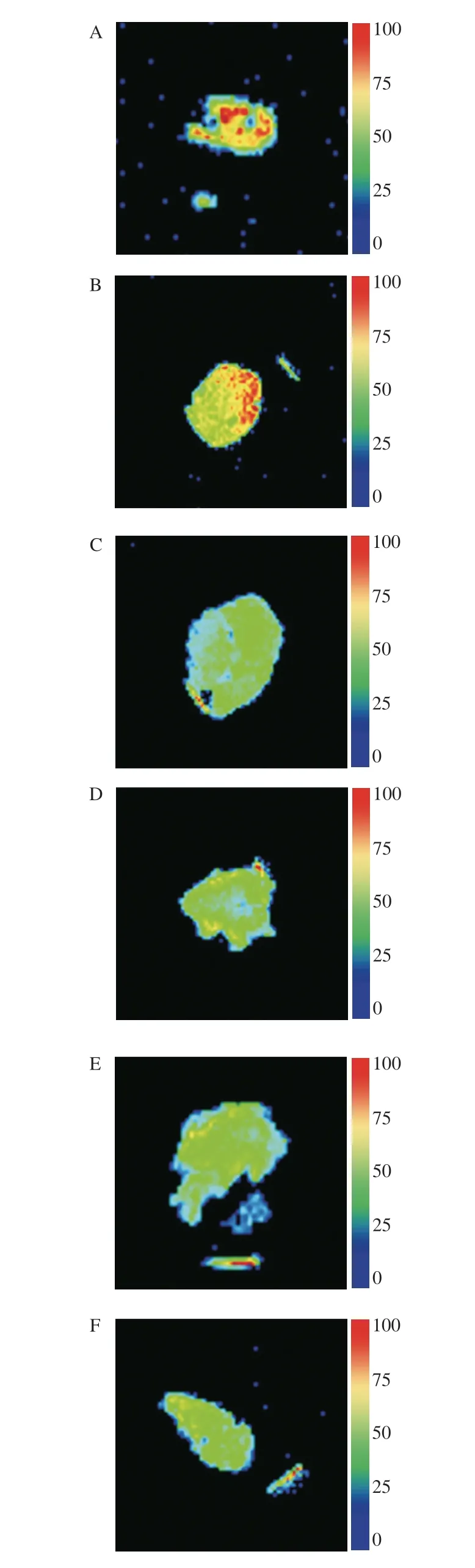
图6 壳聚糖凝胶加权成像Fig.6 Weighted imaging of chitosan gels
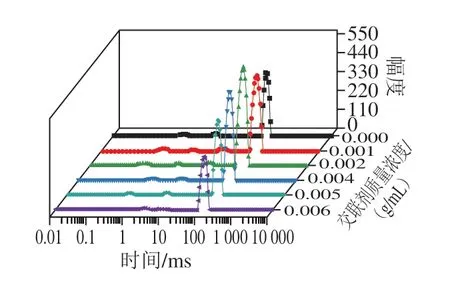
图7 壳聚糖凝胶中不同状态的水分分布Fig.7 Water distribution in chitosan gels
壳聚糖凝胶样品的核磁共振T2弛豫谱可以反映水分子的动态特征,不同的弛豫峰反应不同形式的水。由图7可知,壳聚糖凝胶样品的弛豫峰均有3~4 个,水分子弛豫时间越短,说明在样品内的结合程度越紧密[34]。由此可以得到,图7中的弛豫峰从左到右分别是结合水、不易流动水及自由水,其中面积最大的峰代表自由水[35]。
与交联剂质量浓度0 g/mL的壳聚糖凝胶样品相比,0.002 g/mL壳聚糖凝胶自由水弛豫峰面积增大,峰值增高,推测是由于少量交联剂的加入破坏了壳聚糖分子中氨基与水分子之间形成的氢键,从而导致水分子游离,某一弛豫时间的自由水含量增多,即峰值升高。而总体来看,随着交联剂质量浓度的增加,自由水弛豫峰有小幅左迁,峰值也逐步降低,说明更多的长弛豫水转变为短弛豫水,更多的液态水远离峰值位置,说明样品内部水的流动性降低,即游离的水分子数目增多,推测是由于随着交联剂二醛木糖质量浓度的提高,分子中羟基发挥作用,使水分子与凝胶分子之间形成很强的氢键作用,造成凝胶持水能力大大提高,游离的水分子减少,造成自由水弛豫峰左迁,即短弛豫水增多[36]。
2.2.34 差示扫描量热分析
由图8可以看出,不同质量分数二醛木糖的壳聚糖凝胶均主要有两个峰:推测前者为样品中的水汽化,后者为固体熔融[37]。相比空白组,样品的峰数明显减少,交联剂的加入降低了壳聚糖凝胶的熔融温度和峰值温度,且熔融温度和峰值温度的降低值基本随二醛木糖质量浓度的增加而增加,说明二醛木糖交联后的壳聚糖凝胶热稳定性有所提升[38],且在一定范围内,二醛木糖质量浓度越大,提升效果越好。
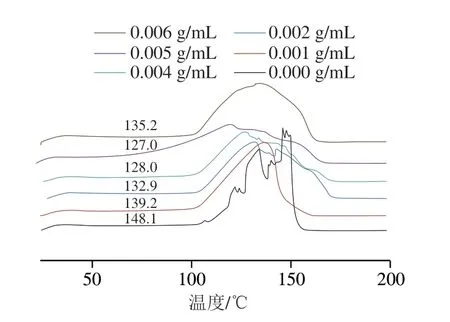
图8 不同质量浓度二醛木糖的壳聚糖凝胶差示扫描量热曲线对比Fig.8 Comparison of DSC curves of crosslinked chitosan with different concentrations of dialdoxylose
3 结论
本研究成功制备的二醛木糖在水中以(α,β)和(β,β)两种构型存在,在加热条件下可以有效交联富含氨基的化合物,使之成为凝胶类物质。以壳聚糖为模型化合物,交联后产生的凝胶弹性、胶黏性、咀嚼性均有较大提升;经低场核磁谱图证实,二醛木糖交联壳聚糖水凝胶的水分活度大幅降低,说明交联可提升凝胶的持水性。本研究证明二醛木糖可以作为交联剂进行使用,二醛木糖属于糖类,其毒性预期很低,该分子或其衍生物有望替代现有的高毒性戊二醛,用于蛋白质等高氨基含量的食品中,提升这类食品的口感等质构性能。

