CMV和EBV共感染可影响造血干细胞移植患者预后
张 娜 牛伟华 孙媛媛 贾 玫
(北京大学人民医院检验科,北京 100044)
巨细胞病毒(cytomegalovirus,CMV)和EB病毒(Epstein-Barr virus,EBV)是普遍存在的人类特异性DNA病毒,属于疱疹病毒科,在免疫抑制/移植患者和先天性感染新生儿中起重要作用[1]。CMV和/或EBV感染是异基因造血干细胞移植(hematopoietic stem cell transplantation,HSCT)后常见的并发症,可引发致命的病毒相关性疾病,如移植后淋巴增生性疾病[2-3]。相关研究结果表明,CMV或EBV感染降低了HSCT患者的生存率[4-5],但对CMV和EBV共同感染与HSCT患者预后的研究较少。本研究收集HSCT患者的临床基本资料和病毒感染情况,分析CMV和EBV共感染与HSCT患者预后的相关性,以期对患者的抗病毒治疗和疾病转归相关研究提供参考。
1 材料和方法
1.1 研究对象
收集2018年1月—2019年1月北京大学人民医院血液科327例接受HSCT的患者,其中男193例、女134例,年龄(34.55±12.10)岁。根据患者HSCT术后CMV和EBV感染情况,分为共感染组(75例)、单一感染组(165例)、无感染组(87例)。本研究经北京大学人民医院伦理委员会批准( 2018PHB155-01)。
1.2 方法
1.2.1 CMV DNA和EBV DNA检测
采集所有患者乙二胺四乙酸抗凝全血2 mL,离心后取上层血浆,提取DNA。采用实时荧光定量聚合酶链反应(polymerase chain reaction,PCR)检测患者CMV DNA和EBV DNA载量,每周2次。CMV DNA检测试剂盒购自上海之江生物科技股份有限公司,EBV DNA检测试剂盒购自广州达安基因股份有限公司,Light Cycler扩增仪购自瑞士Roche公司。PCR扩增条件:37 ℃孵育3 min,95 ℃预变性1 min,93 ℃变性5 s,60 ℃退火40 s,40个循环。以CMV DNA≥1 000 拷贝/mL,EBV DNA≥500 拷贝/mL为阳性。严格按仪器和试剂说明书要求进行操作。
1.2.2 患者临床基本资料收集
收集所有患者的临床资料,包括性别、年龄、疾病类型[急性髓系白血病(acute myeloid leukemia,AML)、急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)、骨髓增生异常综合征(myelodysplastic syndrome,MDS)]、人白细胞抗原(human leukocyte antigen,HLA)位点、输入单个核细胞(mononuclear cell,MNC)数量、输入CD34+细胞数量、急性移植物抗宿主病(acute graft versus host disease,aGVHD)和慢性移植物抗宿主病(chronic graft versus host disease,cGVHD)发生情况、中性粒细胞和血小板植入情况、CMV血症和EBV血症发生情况、移植后1年总体生存率(overall survival,OS)和缓解生存率(leukemia-free survival,LFS)。
1.2.3 干预措施
所有患者在行HSCT术前2~9 d给予更昔洛韦1周预防病毒感染。对HSCT术后CMV DNA阳性患者,静脉注射磷甲酸酯(每天90 mg/kg)或更昔洛韦(5 mg/kg,Bid),直至连续2次未检出CMV DNA;对于EBV DNA阳性患者,行利妥昔单抗治疗。
1.3 统计学方法
采用SPSS 25.0软件进行统计分析。非正态分布计量资料用中位数(四分位间距)表示,比较采用非参数U检验。计数资料以例或率表示,组间比较采用χ2检。采用 Kaplan-Meier生存曲线分析不同病毒感染情况患者的预后。采用Cox比例回归分析评价影响HSCT患者预后的危险因素。以P<0.05为差异有统计学意义。
2 结果
2.1 HSCT患者的基本特征
327例HSCT患者中,男性占59.0%(193/327),≤40岁患者占69.1%(226/327)。AML患者所占比例最高(47.1%,154/327)。HLA匹配方面,半相合在共感染组中所占比例明显高于其他组(P<0.05)。见表1。

表1 HSCT患者基本特征
2.2 共感染组、单一感染组、无感染组相关临床指标比较
共感染组、单一感染组、无感染组aGVHD发生率分别为56.3% 、61.0%、37.0%,差异有统计学意义(P=0.002)。共感染组CMV和EBV感染持续时间均明显长于单一感染组(P<0.05)。共感染组移植后第1次感染EBV的时间早于单一感染组(P<0.001);共感染组EBV最高病毒载量高于单一感染组(P<0.001)。见表2。
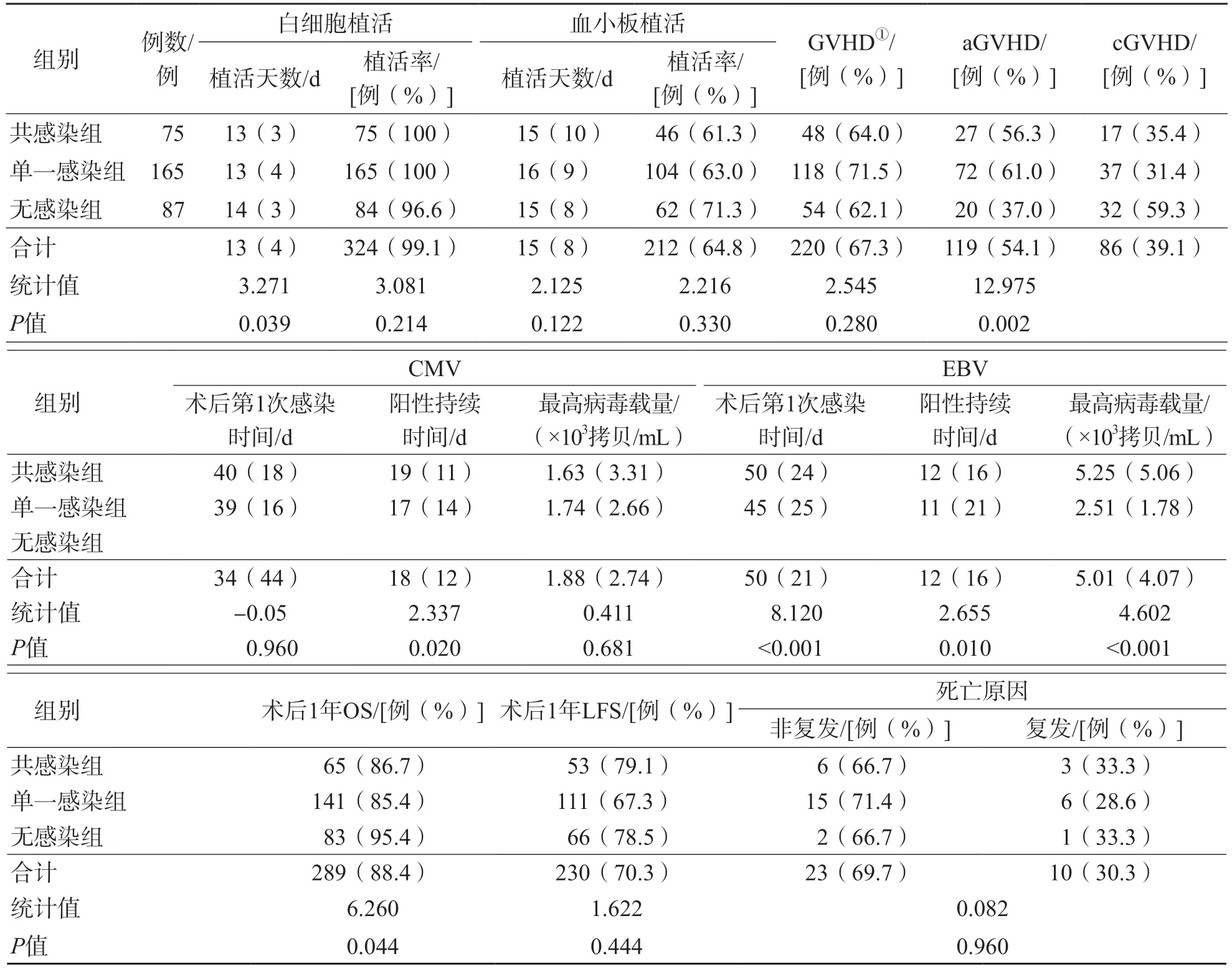
表2 CMV和EBV病毒感染对患者HSCT后的影响
2.3 CMV和EBV感染状况与HSCT患者预后的关系
共感染组、单一感染组、无感染组1年OS分别为86.7%、85.4%和95.4%,差异有统计学意义(P=0.044);共感染组、单一感染组、无感染组1年LFS差异无统计学意义(P=0.444)。见表2。
Kaplan-Meier生存曲线分析结果显示,CMV和EBV共感染与HSCT患者术后1年OS降低有关(P=0.048),与HSCT患者术后1年LFS无关(P=0.479)。见图1、图2。

图1 HSCT患者术后1年OS Kaplan-Meier生存曲线
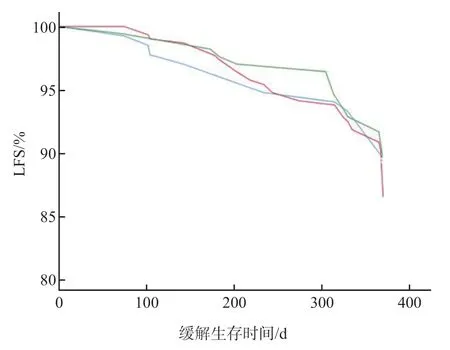
图2 HSCT患者术后1年LFS Kaplan-Meier生存曲线
采用Cox比例回归分析结果显示,校正年龄、性别、基础疾病、HLA匹配和疾病状态等因素后,CMV和/或EBV感染是HSCT患者术后1年OS降低的危险因素[风险比(hazardratio,HR)值分别为12.553、13.108,95%可信区间(confidence interval,CI)分别为1.456~108.230、1.683~102.062,P<0.05)。有GVHD是HSCT患者术后1年LFS的危险因素(HR=2.129,95%CI为1.152~3.935,P=0.016)。见表3。
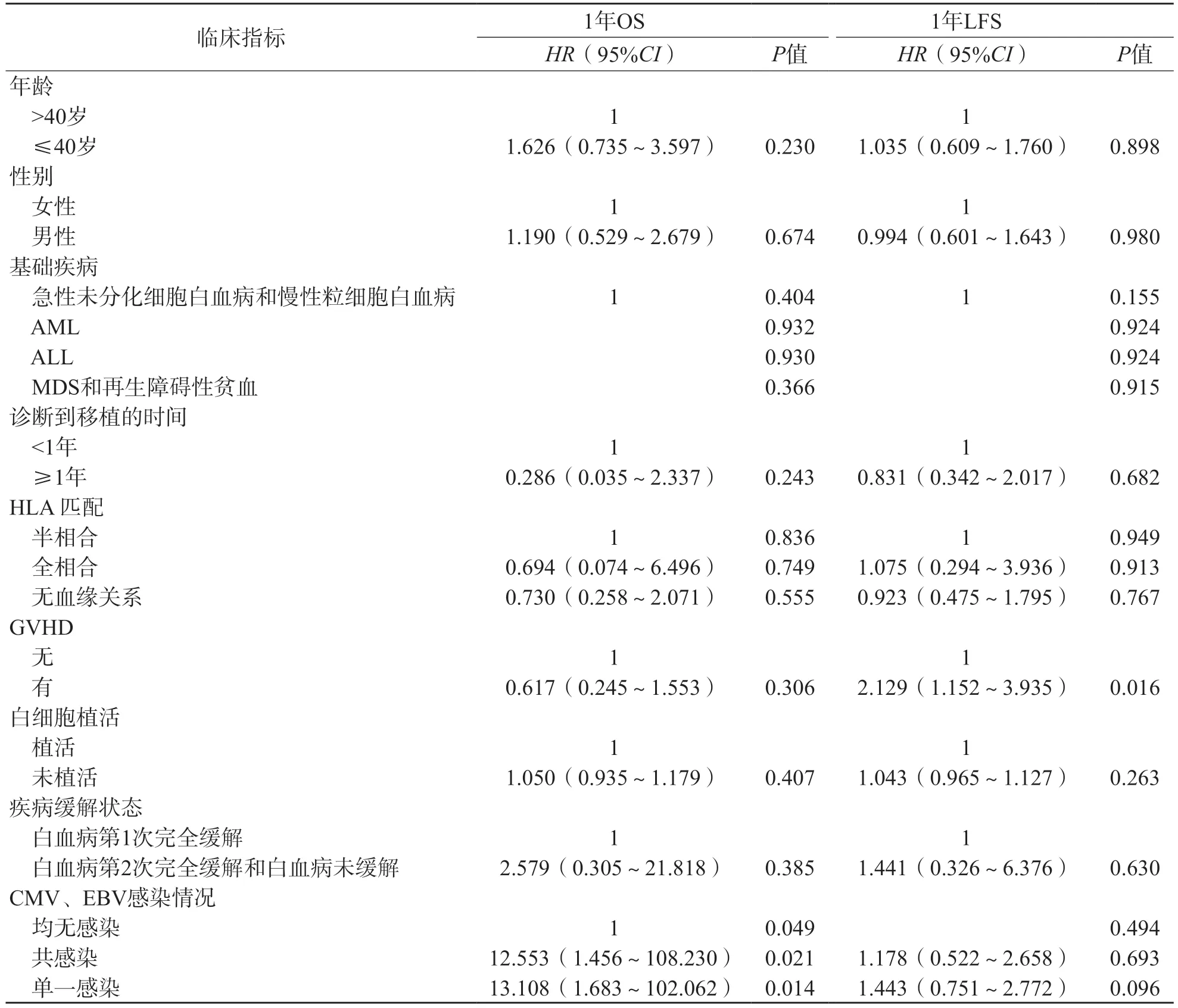
表3 HSCT患者预后影响因素
3 讨论
1957年,HSCT作为一种新的癌症治疗方法被应用于临床[6]。全球每年有5万多例患者接受HSCT,以治疗各种恶性和良性疾病[7]。HSCT患者移植后CMV感染发生率约为60%,是导致移植失败和患者死亡的重要原因之一[8],也是GVHD和移植相关血栓性微血管病(transplantassociated thrombotic microangiopathy,TATMA)的重要危险因素之一,特别严重的CMV肺炎、CMV脑炎、CMV肠炎和CMV视网膜炎等可能直接导致患者死亡[9-10]。因处于深度免疫抑制状态,移植后EBV感染患者易发生移植后淋巴组织障碍(post-transplant lymphoproliferative disorder,PTLD)[11]。本研究分析了CMV和EBV共感染与HSCT患者预后的相关性,结果显示,≤40岁患者在CMV和EBV共感染组中所占比例明显高于>40岁的患者(P<0.05)。CMV感染可引起慢性炎症,导致免疫衰老、分化和T淋巴细胞、自然杀伤细胞的膨胀[12]。CMV潜伏感染和老化有助于改变T淋巴细胞的功能和表型,在青年和中年个体中,血清CMV阳性与多功能CD57+T淋巴细胞在不同刺激下的扩增有关。CMV感染和年龄对T淋巴细胞亚群的影响是不同的,CMV是高功能CD57+T淋巴细胞扩增的主要驱动力[13-14],提示在任何免疫衰老研究中,考虑CMV血清学状态非常必要,可能与年轻患者基础疾病和特殊的免疫状态有关。
本研究发现,CMV和/或EBV感染是HSCT患者术后1年OS的危险因素[HR(95%CI)为12.553(1.456~108.230),P=0.021;HR(95%CI)为13.108(1.683~102.062),P=0.014]。有研究结果表明,CMV感染会降低HSCT术后患者OS[15-16]。HSCT患者在造血重建过程中,CMV特异性免疫重建、CMV易感性和感染保护能力可能因HLA型别不同而有所差异[17-18]。CMV抗原表位与细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)结合力的高低与HLA等位基因密切相关,HLA等位基因识别位点的空间构象差异及其与抗原肽的亲和力与抗病毒免疫有重要关系[19]。EBV感染会增加成人和儿童HSCT患者的病死率[20-21]。EBV感染伴随持续炎症和T淋巴细胞/自然杀伤细胞克隆增殖,主要表现为淋巴液肿瘤和炎症性疾病[22]。HSCT过程也是患者免疫系统重建的过程,而此时感染CMV或EBV,病毒的免疫保护等各种免疫过程均会与患者的免疫重建互相影响,但目前尚有许多机制不明。
综上所述,CMV和EBV共感染会导致HSCT后患者1年总病死率升高。移植后的免疫系统重建和病毒感染免疫是极其复杂、多变的过程,但目前机制不明。限于本研究观察例数的限制,需要进一步设计多中心前瞻性研究,来验证本研究成果,以便为临床应用提供最直接的指导。

