心肌损伤多肽和蛋白类标志物方法学分析和进展
孙泽朋 王洪彬 王建东 宋德伟 肖 鹏
[1.天津科技大学,天津 300450;2.中国计量科学研究院 国家市场监管重点实验室(营养与健康化学计量及应用),北京 100029]
缺氧、细菌、病毒、支原体、药物反应、先天性心脏病、心肌梗死、心力衰竭、川崎病等都可干扰心肌细胞代谢,从而引起心肌损伤,每年有超过700万人死于心肌损伤类疾病[1]。标志物筛查是疾病分类、病程判断的快捷方法,也是确定治疗方案、用药、预后的关键方法。据报道,约有70%的临床诊断来自相关标志物的体外检验结果[2],因此检验结果准确性会在很大程度上影响临床诊断和治疗。近年来,生命科学和临床医学均取得了长足进步,欧盟、美国、中国、日本等在其制定的诊疗指南、专家共识中,均将生物标志物作为影像学诊断的补充,并对生物标志物的判断阈值、参考区间进行细化。在心肌损伤类疾病标志物中,很大一部分为氨基酸组成的多肽和蛋白质。然而,准确测量大分子生物标志物存在很多难点:生物标志物的含量通常很低,需要高灵敏的检测方法才能检出;在蛋白酶的作用下,一些生物标志物会发生降解,导致被测物水平下降;生成的酶解产物有可能干扰检测结果的准确性。本文从大分子标志物测量存在的核心问题出发,分析成因,并对先进检测技术在临床检验中的应用可行性进行展望。
1 心肌损伤标志物的发展历程
1954年,LADUE等[3]首次发现心肌梗死患者血液中天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)异常升高。随后经过多年研究发现,乳酸脱氢酶(lactic acid dehydrogenase,LDH)、肌酸激酶(creatine kinase,CK)、肌酸激酶MB同工酶(creatine kinase isoenzyme,CK-MB)等也会在心肌损伤过程中被大量释放至外周血中[4]。上述酶类被公认为是最早的心肌损伤体外诊断标志物。随着医学科技的发展,敏感性和特异性更高的标志物,如肌红蛋白(myoglobin,MYO)、D-二聚体(D-dimer,DD)、肌钙蛋白、B型钠尿肽(B-type natriuretic peptide,BNP)、氨基末端B型钠尿肽原(N-terminal B-type natriuretic peptide,NT-proBNP),被逐步应用于临床实践。另外,脂肪酸结合蛋白(fatty acid-binding protein,FABP)、C反应蛋白(C-reactive protein,CRP)、可溶性生长刺激表达基因2蛋白(soluble growth stimulation expressed gene 2,sST2)等非特异性标志物在心肌损伤疾病诊断和预后评估中也发挥了重要的辅助作用,多指标联合检测更加有利于提高诊断准确度。
2 多肽和蛋白质类标志物的检测方法和面临的挑战
通过单克隆/多克隆抗体特异性结合目标蛋白,再根据抗原抗体复合物二次结合的报告基团产生的光谱、化学等信号间接定量目标蛋白,是目前临床检测大分子标志物的主流方法。低丰度(ng/L)的心肌损伤标志物,如BNP、心肌肌钙蛋白I(cardiac troponin I,cTnI),可以采用化学发光法进行检测,一些含量相对较高(μg/L~g/L)的标志物,如CKMB、MYO,可采用生化方法进行检测[5]。2种方法在分析时间、检测范围、成本、自动化程度等方面各有优缺点。乳胶增强免疫比浊法、化学发光法等利用了抗原抗体结合的免疫学原理。标志物与抗体的复合体形成过程可被视为影响检测结果准确性的先决因素,抗原结构异质性、抗体识别特异性等均可以改变事先定义的目标蛋白及其检测结果。由此可见,方法的灵敏度决定了是否能检测到被测物。另外,检测方法的特异性代表检测到被测物属于单一结构还是结构类似物的集合,对半衰期短、个体异质性程度高的被测物进行检测或许是临床检验面临的最大的挑战。
2.1 抗原结构异质性对检测准确度的影响
美国临床医学科学家、肌钙蛋白发现者之一的APPLE教授于2012年发文称:“在我有生之年可能无法看到肌钙蛋白I标准化的那一天”[6]。我国国家卫生健康委临床检验中心2012年针对124家临床实验室的室间质量评价(external quality assessment,EQA)结果显示,cTnI的中位值为0.09 μg/L,但最大值约是最小值的230倍(0.01 μg/L~2.3 μg/L)[7]。异质性或许是肌钙蛋白准确测量的最大障碍。有研究发现,急性心肌梗死(acute myocardial infarction,AMI)患者肌钙蛋白主要以CI双亚基形式出现,但同样会存在游离I亚基、CTI三亚基的形式[6,8]。更糟糕的是,亚基氨基端或羧基端还会发生酶解、氧化、还原、磷酸化等反应,生成大量代谢产物,导致抗原中包含了游离、代谢、复合体形式,以及翻译后修饰产物,而这一系列反应与个体的性别、年龄和健康状况等均有关。因抗原组成复杂、个体间异质性明显,即便使用相同试剂和检测系统,结果一致性也无法得到保证,这或许就是肌钙蛋白难以准确测量的根本原因。另外,美国国家标准和技术研究院(the National Institute of Standards and Technology,NIST)研制的SRM2921是目前唯一的冰冻人血清肌钙蛋白复合体有证标准物质,利用该标准物质对不同系统校准后,13个平台的测量变异程度由校准前的40倍缩小到3倍[9]。尽管在标准物质介入下不同检测系统间的校准效果明显,但3倍的变异程度也是不可接受的。可惜的是,SRM2921由于稳定性问题目前已经停产,且NIST暂时没有重新研制或复制该标准物质的计划。中国计量科学研究院(the National Institute of Metrology,NIM)研制的肌钙蛋白溶液纯度国家一级标准物质(GBW09229)为了避免抗原降解给定值带来偏差,在研制过程中建立了稳定片段代替完整蛋白的同位素稀释质谱法,使得定值结果在长期监测中具备很好的稳定性。肌钙蛋白已经是全球公认的心肌梗死诊断金标准,个体异质性使得抗体结合程度无法准确量化,免疫学方法的检测结果变异程度高;同时,负责量值传递和溯源的血清/血浆标准物质稳定性差,也给检测系统的校准带来了极大阻力。导致出现这种结果的根本原因可归结为分子结构的复杂性。在不改变现有临床免疫检测原理和抗体类型的前提下,准确测量肌钙蛋白亚基或复合体,确实很难实现。
cTnI的EQA结果变异很大,而意大利组织的130家临床实验室开展的BNP能力验证计划结果显示,不同实验室间的偏差达到了43%[10],类似的情况还有很多。追踪偏差成因的难度较大,因为检验结果不但受试剂、仪器的影响,环境、操作者等因素也会造成一定的影响,偏差成因往往很难聚焦。在我国,各级临床检验中心会定期组织大量EQA活动,通过分发考核样本对不同品牌仪器、试剂的性能和不同临床检验机构的检测能力进行测试、对比,在督促仪器、试剂生产厂商提高产品质量的同时,操作人员也可以随时查找问题,主观上避免额外偏差产生。EQA的统计结果时刻提醒临床医学从业者,试剂生产、被测物定义、溯源体系建立等很多环节还具备提升和改进空间,标准化技术和标准体系的建立任重道远。ISO17511是体外诊断试剂(in vitrodiagnostic reagent,IVD)量值溯源的核心文件,其中规定了多种溯源路线图,无论哪一种技术路线都离不开标准物质和方法。现阶段,大分子标准物质的研制仍具有很大挑战性,这种挑战并不完全来自于定值方法,而是来自“物质量”和“活性量”之间的一条“鸿沟”。在化学计量学中,针对被测物开展绝对定值可以通过将蛋白质水解至氨基酸,或酶解至肽段的形式,采用同位素稀释质谱法获得量值准确可靠、可溯源至国际单位制(SI单位)的定值结果,也就是“物质量”;但“活性量”目前还没有明确溯源技术和方法,事实上“活性”既不是SI单位也不是导出单位。因此,以免疫技术为主的临床测量若想实现标准化,达到结果统一、可比的目的,就一定要建立连接“物质量”和“活性量”的桥梁。
2.2 抗体识别特异性对检测准确度的影响
当某些标志物的前体分子和代谢物都能被抗体识别时,将会发生交叉反应[11-12],BNP便是典型代表。由于外周血中存在多种内肽酶,BNP在被释放至外周血后,半衰期仅为20 min左右,此时患者血液中不仅有完整的BNP,即BNP1-32,还存在大量的代谢产物,如BNP3-32、BNP4-32、BNP5-32,甚至还存在糖基化的B型钠尿肽原。根据国际临床化学和检验医学联合会(the International Federation of Clinical Chemistry and Laboratory Medicine,IFCC)公开的BNP检测系统信息,识别抗体针对的抗原表位为BNP的aa.5-13、aa.27-32、aa.14-21,这表明B型钠尿肽原和绝大多数BNP代谢产物均可被抗体结合,从而被计算到检测结果中,也就是说,目前技术检测的是BNP的总量,而非BNP1-32。BNP总量是否可以代替BNP1-32尚需要大量的临床研究才能下结论。但追求被测量的真实结果一定是检验的发展方向。另外,BNP1-32还具有激活cGMP通路等的活性,将其与无活性的代谢物一起计入BNP检测结果显然是不合适的。基于此,LEWIS等[13]针对氨基端抗原表位设计并研制了一种新型抗体,用于识别BNP1-32,在与50E1(aa.26-32)检测抗体结合使用后,发现交叉反应得到了很好的抑制,尽管这项研究还未应用于商品化试剂的生产中,但在追求BNP检测真实结果中无疑具有里程碑式的意义。
3 多肽和蛋白类标志物检测新技术
随着科学技术的发展,一些新兴的多肽和蛋白类检测技术已经被开发出来,可以克服检测灵敏度不够、特异性较差、动态范围小的问题。此外,还能实现高通量分析,即在单个样本中同时检测多种蛋白质,有利于提高检测效率、减少样本损耗、降低成本。这些新兴的多肽和蛋白类检测技术具有超高灵敏度、高特异性、宽动态范围,能够实现高通量分析。
3.1 表面增强拉曼散射技术
表面增强拉曼散射(surface-enhanced Raman scattering,SERS)是一种超灵敏的振动光谱技术,通过拉曼光谱法测定附着在经过特殊处理的金属表面(金/银)的样本,以拉曼散射作为读取信号进行测量。基于SERS免疫分析法检测蛋白标志物的基本过程见图1[14]。SERS的探针在特异性识别目标分析物的同时还可为目标分析物的定量检测提供SERS信号。HE等[15]使用了一种可以容纳很多金/银纳米颗粒的新型高孔隙率晶体材料-金属有机骨架(metal-organic framework,MOF),显著增强了拉曼信号,从而提高了SERS的灵敏度。通过这种方法,成功对NT-proBNP进行了快速有效的超灵敏检测,其最低检测限为0.75 fg/mL,检测范围为1 fg/mL~1 ng/mL。
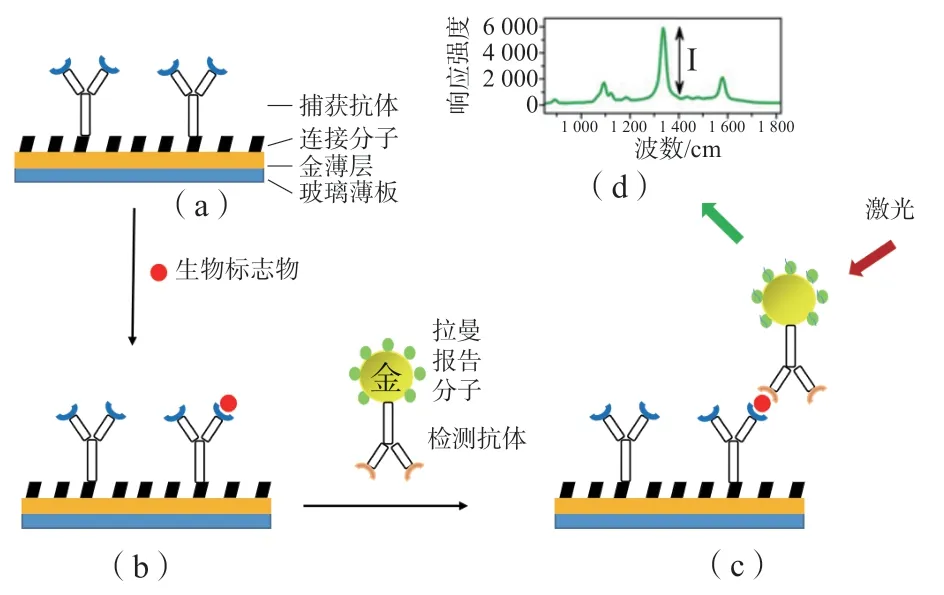
图1 基于SERS的夹心免疫分析法[14]
为了将这种高灵敏度、高特异性、动态范围宽的SERS免疫分析方法应用于临床疾病蛋白类标志物检测,未来关注点应该集中于提高检测方法的可重复性、降低成本和简化操作步骤方面。
3.2 悬浮阵列技术
悬浮阵列技术是美国Luminex公司研制的以荧光编码微球为核心,集流式细胞分析、激光分析、高速信号处理等技术于一体的分析技术平台。该技术将聚苯乙烯微球用荧光染色法进行编码(即通过2种荧光染料对微球进行染色,调节比例后,可以获得100种不同颜色的微球),每种染色的微球交联1种针对某个被测物的生物探针(抗体、适体)。不同被测物的编码微球进行混合后,再加入微量待检的样本,靶分子与微球表面交联的探针在悬液中进行特异性结合,在1个反应孔中可同时完成约100种不同的生物学反应,采用激光流式仪鉴定微球颜色来确定被测物,同时通过检测靶物质上的报告分子产生的荧光强度来进行定量[16]。LIU等[17]通过该技术检测了血清中3种心肌梗死生物标志物(cTnI、CK-MB、MYO),具体过程见图2。与常规酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)相比,悬浮阵列技术的检测灵敏度可提高10~100倍,最低检测下限为0.01 pg/mL;检测的动态范围比常规的ELISA方法高10倍以上,可达3~5个数量级;检测所需时间更短,检测效率更高,重复性好;一次可同时检测多种疾病的生物标志物,具高通量检测能力[17]。

图2 悬浮阵列技术检测AMI生物标志物[17]
悬浮阵列技术的高通量、高灵敏度、高精确性的特点符合临床多指标联合检测的要求,在检验医学领域具有广阔的应用前景。
3.3 单分子免疫阵列分析技术
单分子免疫阵列分析技术是一种在体积为fL大小的微孔中进行单分子酶促反应,并可进行荧光成像的数字式ELISA(图3),具有灵敏度高、检测范围宽、耗时短等优势[18]。单分子免疫阵列分析技术采用经典的双抗夹心ELISA原理,可实现极低含量蛋白的定量检测。该技术的关键在于将免疫复合物捕获,并密封在含有超过20万个fL大小的微孔的芯片中,从而实现单个分子的检测,大幅提升了检测灵敏度,因此这种技术又被称为数字式ELISA,比传统的ELISA方法灵敏度高1 000倍。JAROLIM等[19]基于单分子免疫阵列技术开发了一种用于检测cTnI的新型全自动数字分析仪,检测限为0.01 ng/L,定量限为0.08 ng/L;通过检测健康对照者和心力衰竭患者的cTnI水平,发现心力衰竭患者cTnI水平显著升高,并可作为心力衰竭严重程度更详细的分类参考。此外,建立个性化的参考区间,不仅适用于测定健康个体cTnI水平,还适用于运动负荷测试后cTnI变化的监测。

图3 单分子阵列免疫分析示意图[18]
这种超灵敏、高通量、操作简便的单分子免疫阵列分析技术不仅可以检测血清、血浆中极低含量的蛋白类标志物,还可以辨别生物标志物的微小变化,有利于心肌损伤类疾病的早期诊断,了解高风险患者的疾病进展,及时采取个性化预防措施。
3.4 临床质谱
与前几项技术相比,质谱技术具有极好的特异性,可以提供蛋白质序列信息,并可用于检测和量化蛋白翻译后修饰和代谢产物。此外,质谱技术已被应用于一些临床检验领域,如基于高分辨质谱的微生物鉴定、基于四极杆质谱和配套试剂盒的定量检测,但大多数还仅限于小分子物质的检测。液相色谱质谱联用技术对复杂基质中的多肽和蛋白进行准确定量较为困难,需要验证方法的回收率、定量范围、定量限、准确度和精密度[20],该技术主要受制于前处理方法的性能,一旦样本经处理后达到检测要求,色谱、质谱和工作站等完全具备检测大分子生物标志物的能力。
同位素稀释质谱(isotope dilution mass spectrometry,ID-MS)是目前国际物质量咨询委员会认可的基准方法之一,被各国计量机构广泛用于大分子标准物质的研制。TORMA等[21]基于ID-MS对BNP中的氨基酸或酶解肽段进行准确定量,从而推导出完整分子的量值,由于所有结果均可以溯源至氨基酸国家标准物质,利用该方法研制标准物质也同时具备了计量学溯源性,因此该方法也被称为参考测量程序。电感耦合等离子体质谱(inductively coupled plasma mass spectrometry,ICP-MS)可通过测定标志物中金属元素的量,再根据一级结构信息去计算蛋白的绝对量。由于BNP中的甲硫氨酸和半胱氨酸含有硫元素,因此可针对硫元素开发一种ICP-MS方法,间接对BNP进行定量。DEITRICH等[22]采用ICP-MS技术对人硒蛋白P1(selenoprotein 1,SEPP1)进行定量检测,通过测量78Se/76Se和82Se/76Se同位素比值来确定2种酶解肽的Se质量分数,从而对SEPP1进行准确定量。这种方法校正了处理过程和分析过程中的随机误差和系统误差,提高了ICP-MS定量的准确性。
近年来,国际物质量咨询委员会蛋白工作组的工作计划可以看出,在完整蛋白水平开展ID-MS或许是下一阶段技术突破的重点方向,尽管在完整蛋白水平开展研究需要更大的投入,但由于不使用水解或酶解反应,目标物的溯源路径更短、定值不确定度更小,因此可提高ID-MS检测系统校准后测量结果的准确性。
4 展望
临床对心肌损伤标志物检测的第一诉求往往是速度,尤其是急性患者,检测结果呈现给医生的时间可能直接与患者生命相关联。目前的免疫学检测技术可以满足“快”的需求,尤其是近年来开发的可达到μg和ng量级的即时检验(point-of-care testing,POCT)产品,使检测的便捷性有了质的提升。但在“快”的同时,还需面对“准”的问题。很多研究结果均提示检验工作者,随着更加灵敏、高特异性技术的发展,我们对复杂样本中标志物的存在状态有了更清晰的认知,下一步将是把这些技术向临床应用转化。质谱等新型技术在心肌损伤标志物检测的应用中还有许多问题需要解决,但质谱特有的质量分辨率和扩展分析能力可能是解决“准”的问题的关键。尽管新型技术目前受到较多限制,但将具有更高结构分析能力的技术引入临床,必将推动检验医学的发展。

