基于多组学探讨川陈皮素调控脂质合成氧化逆转胃癌顺铂耐药的机制
申隽于,李怀志,陈梦麟,郑姗姗,张粲粲,韩 博,吴 坚,孙庆敏
基于多组学探讨川陈皮素调控脂质合成氧化逆转胃癌顺铂耐药的机制
申隽于1,李怀志1,陈梦麟1,郑姗姗1,张粲粲1,韩 博1,吴 坚2*,孙庆敏2*
1. 南京中医药大学第一临床医学院,江苏 南京 210023 2. 南京中医药大学附属医院,江苏 南京 210029
运用脂质代谢组学和网络药理学寻找川陈皮素对胃癌顺铂耐药细胞(AGS-DDP)的核心靶点,并结合细胞实验进一步探究川陈皮素逆转胃癌顺铂耐药的机制。采用UPLC-Orbitrap质谱系统进行非靶向脂质组学分析。利用GENE Card、TCMSP数据库挖掘川陈皮素和甘油磷脂代谢通路的潜在靶点,通过微生信在线作图工具平台整合二者的交集靶点,并进行基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析,通过STRING数据库绘制蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络,运用Cytoscape软件将川陈皮素的核心靶点可视化。川陈皮素给药后,通过CCK-8法检测AGS和AGS-DDP细胞的存活率;流式细胞术检测AGS-DDP细胞的凋亡情况;划痕实验检测AGS-DDP细胞的迁移能力;Western blotting检测AGS-DDP细胞的B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)、E-cadherin、N-cadherin、Vimentin、过氧化物酶体增殖物激活受体γ(peroxisome proliferators-activated receptor γ,PPARγ)和三磷酸腺苷柠檬酸裂解酶(adenosine triphosphate citrate lyase,ACLY)蛋白表达。AGS和AGS-DDP细胞通过脂质组学分析检测得到31个亚类中的1450个差异的脂质化合物,主要富集在甘油磷脂代谢通路,对川陈皮素潜在靶点进行KEGG富集分析结果显示川陈皮素具有逆转铂类耐药的潜力。细胞实验结果显示,与对照组比较,川陈皮素剂量相关性地抑制AGS-DDP细胞的存活率(<0.05、0.01),增加AGS-DDP细胞对顺铂的敏感性(<0.05),且能诱导AGS-DDP细胞凋亡并抑制其迁移能力(<0.05、0.01)。Western blotting实验结果显示川陈皮素组Bax、E-cadherin蛋白表达水平显著升高(<0.05、0.01),Bcl-2、N-cadherin、Vimentin、ACLY和PPARγ蛋白表达水平均显著降低(<0.05、0.01)。AGS和AGS-DDP细胞的差异脂质代谢产物主要富集在甘油磷脂代谢通路,川陈皮素通过调控脂质合成氧化关键基因抑制AGS-DDP细胞增殖、迁移,最终逆转胃癌顺铂耐药。
胃癌;川陈皮素;网络药理学;顺铂耐药;脂质合成氧化;过氧化物酶体增殖物激活受体γ
胃癌是一种起源于胃黏膜上皮细胞的恶性肿瘤,其发病率和死亡率均位列全球恶性肿瘤的前5名,对人们的健康造成巨大威胁[1-2]。顺铂是一种能够产生有效细胞毒性的非特异性抗肿瘤药物,被广泛应用于胃癌的治疗。但其在治疗过程中的持续使用会逐渐产生耐药性[3-4],因此寻求一种疗效确切且可以减少胃癌细胞顺铂耐药性的药物尤为重要。
肿瘤细胞的代谢重编程是肿瘤的重要特征,代谢重编程发生在肿瘤生成的各个阶段,与细胞对抗癌药物的敏感性也有很密切的关系。相较于糖代谢,对肿瘤细胞中脂质代谢的研究较少,但近年越来越多的研究证明在肿瘤细胞中,脂质代谢也发生了明显的变化[5]。脂质作为第二信使和激素在信号传递中扮演着重要的角色,脂质堆积在肿瘤中非常常见,它本身被视为癌症的标志[6],脂肪酸的合成和氧化也受到过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptors,PPARs)转录因子家族的调控[7]。肿瘤耐药的机制十分复杂,研究发现抑制PPAR对于治疗肿瘤耐药有显著的抑制作用,PPAR介导的脂肪酸氧化水平升高会导致耐药的发生[8]。三磷酸腺苷柠檬酸裂解酶(adenosine triphosphate citrate lyase,ACLY)是糖酵解和脂质代谢的连接酶,是肿瘤细胞脂肪酸从头合成的第一步,在多种肿瘤中表达增加[9],已有研究发现可通过下调ACLY抑制磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)通路和激活单磷酸腺苷激活的蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)/活性氧(reactive oxygen species,ROS)通路逆转卵巢癌顺铂耐药[10]。因此,抑制PPAR和ACLY可能是克服肿瘤顺铂耐药的新策略。通过调控脂代谢可以改善胃癌细胞耐药性,研究脂质代谢物的改变对于阐明脂质代谢在胃癌细胞耐药中的作用意义重大[11]。
中医治疗肿瘤类疾病依据扶正祛邪的原则,中药辅助放射治疗、化疗可增敏减毒,改善耐药,减少术后复发转移,提高患者生存质量[12-13]。因此,研究中医药改善肿瘤耐药的机制具有重大意义。陈皮是最常用的理气药,具有理气健脾、燥湿化痰的功效。药理学研究表明陈皮及其有效成分类黄酮可以减少肝脏中的脂质堆积[14]。川陈皮素是多甲氧基黄酮类化合物,是陈皮中发挥作用的重要活性成分,具有抗肿瘤、抗炎、抗氧化应激、降血糖、调血脂等多种药理活性[15-17],川陈皮素作为一类天然的活性物质,具有较高安全性。已有研究发现川陈皮素能有效缓解由高脂膳食诱导的代谢紊乱,可改善血脂水平和肝脏脂肪变性程度[18],但其对胃癌耐药的作用却鲜有报道。因此,本研究基于中药理论并结合网络药理学和脂质组学方法探究川陈皮素在胃癌顺铂耐药中的作用,并从分子层面揭示川陈皮素改善胃癌细胞顺铂耐药的机制。
1 材料
1.1 细胞
人胃腺癌细胞株(AGS)和人胃腺癌顺铂耐药株(AGS-DDP)购自江苏凯基生物技术股份有限公司。
1.2 药品与试剂
川陈皮素(质量分数≥98%,批号Must-22100917)购自成都Must生物科技有限公司;顺铂(批号WA2A1210)购自齐鲁制药有限公司;RPMI 1640培养基(批号BC-M-018)、PBS溶液(批号BC-BPBS-04)购自Bio-Channel生航生物公司;新生牛血清(批号22011-8612)购自浙江天杭生物科技股份有限公司;胰酶细胞消化液(批号C0201)、RIPA裂解液(批号P0013B)、蛋白酶磷酸酶抑制剂混合物(批号P1005)、BCA蛋白浓度测定试剂盒(批号P0010)、Annexin-V-FITC细胞凋亡检测试剂盒(批号C1062)购自碧云天生物技术有限公司;CCK-8试剂盒(批号FD3788)购自杭州弗德生物科技有限公司;ECL发光液(批号BL520B)购自Biosharp公司;B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)抗体(批号12789)、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)抗体(批号89477)、E-cadherin抗体(批号220874)、N-cadherin抗体(批号22018)、Vimentin抗体(批号10366)、PPARγ抗体(批号16643)均购自武汉三鹰生物技术有限公司;ACLY抗体(批号AB40793)购自英国Abcam公司;二抗(批号ZB-2301、ZB-2305)购自北京中杉金桥生物技术有限公司。
1.3 仪器
UHPLC Nexera LC-30A型超高效液相色谱(日本岛津公司);ELX800型全自动酶标仪测(美国Bio-Tek公司);3111型CO2培养箱(美国FORMA公司);SW-CJ-HS2型细胞培养超净台(苏州净化设备厂);IX71型倒置显微镜(日本Olympus公司);5430R型低温高速离心机(德国Eppendorf公司);电泳仪、MP-4型电泳槽(美国Bio-Rad公司);Tanon-4600型化学发光成像仪(Tanon公司);涡旋混合器(Thermolyne公司)。
1.4 数据库与软件
MetaboAnalyst 5.0网站(https://www. metaboanalyst.ca/home.xhtml);TCMSP数据库(http://lsp.nwu.edu.cn/tcmsp.php);GSEA GENE Set Enrichment Analysis网站(http://www.gsea-msigdb. org/gsea/index.jsp);Sangerbox 3.0在线平台(http:// vip.sangerbox.com/home.html);STRING网站(https://cn.string-db.org/cgi/input),GENE Card数据库(https://www.genecards.org/);微生信网站(www. bioinformatics.com.cn);LipidSearch(Thermo Scientific)自动化脂质组学分析软件;Cytoscape 3.7.2软件。
2 方法
2.1 AGS和AGS-DDP细胞的脂质代谢组学检测与分析
将样本加入200 µL 4 ℃超纯水中,涡旋混匀,加入240 µL预冷甲醇,涡旋混合后加入800 µL甲基叔丁基醚,再次涡旋混合后低温水浴中超声20 min,室温放置30 min,10 ℃、14 000×离心15 min,取上层有机相,氮气吹干,−80 ℃保存样本。样品采用UHPLC Nexera LC-30A超高效液相色谱系统进行分离,柱温45 ℃;体积流量300 μL/min;流动相A为10 mmol/L甲酸铵乙腈水溶液(乙腈-水6∶4),B为10 mmol/L甲酸铵乙腈异丙醇溶液(乙腈-异丙醇1∶9),梯度洗脱:0~2 min,30% B;2~25 min,30%~100% B;25~35 min,100%~30% B。整个分析过程中样品置于10 ℃自动进样器中,为避免仪器检测信号波动而造成的影响,采用随机顺序进行样本的连续分析。
当白砂糖添加量12%,姜水比1∶1,姜汁添加量14%,柠檬酸添加量0.625%,β-环状糊精添加量0.04%时,在配比为7∶1∶1的卡拉胶、黄原胶、槐豆胶的胶凝剂添加量分别为1.00%,1.10%,1.20%,1.30%,1.40%时,设计单因素试验,进行感官评价。
采用LipidSearch自动化脂质组学分析软件进行峰识别、峰提取、脂质鉴定等处理,主要参数:前体耐受性5×10−6,产物离子阈值5%。对LipidSearch提取得到的数据进行数据分析,包括单变量统计分析、多元变量统计分析、层次聚类分析和相关性分析等;单变量统计分析包括Student’s-test/非参检验和变异倍数分析。
2.2 MetaboAnalyst通路分析
在脂质代谢组学分析得到的结果中,根据差异倍数(fold change,FC)值由高到低筛选出前20个耐药细胞的代谢物,并将其导入MetaboAnalyst 5.0进行系统通路分析[19]。以Impact>0.1和<0.05为筛选条件,确定最相关的路径,最后将分析出的代谢途径输入GSEA GENE Set Enrichment Analysis网站获得该代谢途径的相关靶点信息。
2.3 川陈皮素的京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析
在TCMSP中预测的川陈皮素靶点进行KEGG富集分析。使用Sangerbox 3.0 在线平台进行数据分析和可视化的KEGG富集分析。最后将<0.01设定为阈值,以确定具有显著差异的生物过程和信号通路。
2.4 川陈皮素与代谢途径靶点的获取和网络药理学分析
TCMSP数据库是根据中药系统药理学的相关理论建立的。药物筛选以吸收、分布、代谢、排泄(absorption, distribution, metabolism, excretion,ADME)为标准,如人体口服生物利用度、半衰期、药物亲和性、Caco-2渗透性、血脑屏障和Lipinski规则[20]。从TCMSP数据库中检索川陈皮素中的靶点;以“glycerophospholipid metabolism”为关键词,在GENE Card数据库中检索甘油磷脂代谢通路相关的靶点,得到的结果以“Relevance”为指标获得相关靶点,将预测的靶点与川陈皮素的靶点联系起来,得到的交集基因上传到STRING网站进行蛋白质-蛋白质相互作用(protein-protein interaction,PPI)分析,根据PPI的结果,建立了包含药物和代谢物相互作用的基因之间关系的网络图。
2.5 CCK-8法检测AGS细胞和AGS-DDP细胞的存活率
将处于对数生长期的AGS和AGS-DDP细胞细胞分别用胰酶消化,离心收集后重悬,然后以5000个/孔接种于96孔板中。分别用不同浓度(0、1、5、10、50、100 μmol/L)的顺铂或者不同浓度(0、5、10、100、150、200 μmol/L)的川陈皮素分别处理细胞24、48 h,或者50 μmol/L的川陈皮素联合不同浓度(0、1、5、10、50、100 μmol/L)的顺铂处理24 h,另设置不接种细胞不加入药物的空白孔,每孔加入10 μL的CCK-8试剂继续培养1 h,用全自动酶标仪测定450 nm处的吸光度()值,计算细胞存活率。
细胞存活率=(实验-空白)/(对照-空白)
2.6 流式细胞术检测AGS-DDP细胞凋亡
AGS-DDP细胞以2×105个/孔接种于6孔板中,用不同浓度(0、50、100、200 μmol/L)的川陈皮素处理24 h,收集细胞并用PBS洗涤2次。采用Annexin-V和碘化丙啶(PI)凋亡检测试剂盒检测AGS-DDP细胞的凋亡,将细胞重悬于195 μL结合缓冲液中,然后依次加入10 μL Annexin V-FITC和5 μL PI。避光孵育15 min后,上机检测AGS-DDP细胞的凋亡情况。
2.7 平板克隆形成实验检测AGS-DDP细胞增殖
AGS-DDP细胞以2×103个/孔接种于6孔板中,用不同浓度(0、50、100、200 μmol/L)的川陈皮素处理24 h后,更换完全培养基生长10 d,然后用多聚甲醛固定细胞,再加入0.1%结晶紫溶液染色10 min,染色后拍照,最后进行细胞克隆计数。
2.8 划痕实验检测AGS-DDP细胞迁移
2.9 Western blotting检测Bax、Bcl-2、E-cadherin、N-cadherin、ACLY和PPARγ蛋白表达
取对数生长期AGS-DDP细胞,以2×105个/孔接种于6孔板中,用不同浓度(0、50、100、200 μmol/L)的川陈皮素处理24 h,收集细胞,加入RIPA裂解液于冰上裂解15 min。4 ℃、12 000×离心20 min,吸取上清,BCA法测定蛋白浓度。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,加入5%牛血清白蛋白溶液封闭1 h,加入一抗4 ℃孵育过夜,加入二抗室温摇床孵育1 h后,经TBST漂洗,使用ECL液进行发光,用Image J软件进行条带分析。
2.10 统计学分析
采用GraphPad Prism 8.0软件对实验结果进行统计分析及作图,两组间比较采用检验分析,两组以上比较采用单因素方差分析。
3 结果
3.1 AGS和AGS-DDP细胞的脂质代谢物存在显著差异
主成分分析结果表明2组细胞能够得到明显的区分,提示本实验建立的模型具有较高可靠性(图1-A);火山图展示AGS和AGS-DDP细胞中脂质分子的整体差异表达倍数情况,图中的点为FC>1.5或FC<0.67、<0.05的脂质分子,即单变量统计分析筛选的差异脂质分子(图1-B);热图显示了AGS-DDP和AGS细胞差异脂质的层次聚类结果(图1-C);弦图显示了AGS和AGS-DDP细胞差异脂质的相关性分析结果(图1-D)。
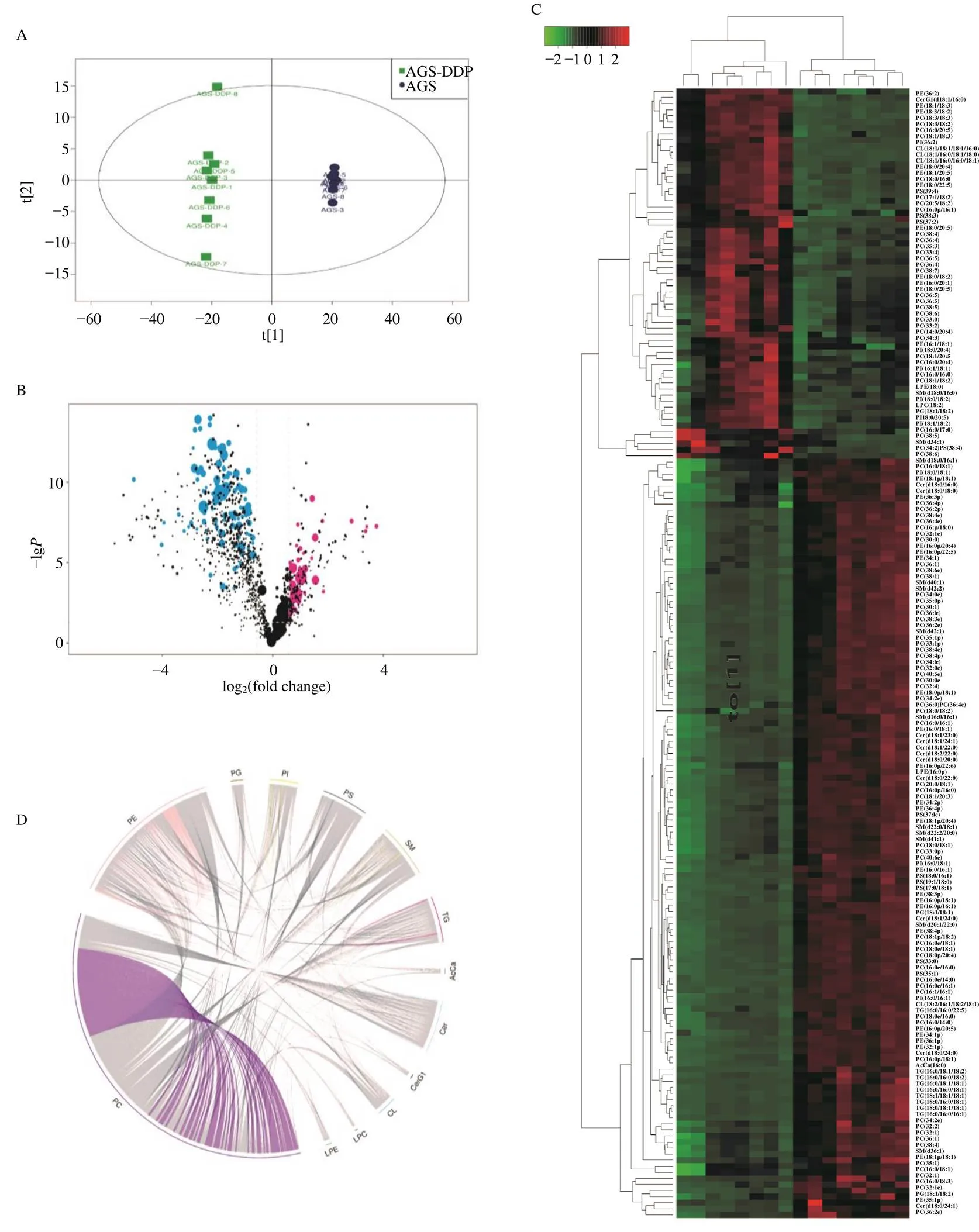
A-AGS与AGS-DDP细胞的PCA得分图 B-差异脂质分子火山图 C-AGS与AGS-DDP细胞差异脂质的层次聚类热图 D-差异脂质的相关性分析弦图
3.2 MetaboAnalyst通路分析脂质代谢产物富集在甘油磷脂代谢通路
根据FC值筛选出了差异最为显著的前20个脂质代谢产物,热图显示了这20个代谢物(图2)。将这20个代谢产物导入MetaboAnalyst网站中,最终分析得到的5条代谢通路(甘油磷脂代谢、亚油酸代谢、α-亚油酸代谢、糖基磷脂酰肌醇-锚生物合成、花生四烯酸代谢)。以Impact>0.1、<0.05为指标来确定最相关的途径,重点分析了差异最为显著的甘油磷脂代谢途径。
3.3 川陈皮素潜在靶点与铂类耐药相关
从TCMSP数据库中得到川陈皮素的34个潜在靶点,分别是环加氧酶1(prostaglandin endoperoxide synthase 1,PTGS1)、PPARγ、凝血因子X(F10)、PTGS2、雌激素受体2(estrogen receptor 2,ESR2)、核受体共激活因子2(nuclear receptor coactivator 2,NCOA2)、环腺苷酸反应元件结合蛋白1(cAMP responsive element binding protein 1,CREB1)、磷脂酶A2组IVA(phospholipase A2 group IVA,PLA2G4A)、一氧化氮合酶2(nitric oxide synthase 2,NOS2)、兔抗凝血酶III(rabbit antithrombin-III,SERPINC1)、钾电压门控通道亚家族H成员2(potassium voltage-gated channel KQT-like subfamily member 2,KCNH2)、ESR1、雄激素受体(androgen receptor,AR)、凝血因子VII(F7)、蛋白酪氨酸磷酸酶(protein tyrosine phosphatase,PTPN1)、DNA拓扑异构酶IIα(TOP2A)、TOP2B、二肽基肽酶-4(dipeptidyl peptidase-4,DPP4)、热休克蛋白90AB1(heat shock protein 90 kDa alpha class B member 1,HSP90AB1)、检查点激酶1(cell cycle checkpoint kinase 1,CHEK1)、丝氨酸蛋白酶1(protease serine 1,PRSS1)、大电导钙离子激活的钾通道M亚族α亚基(potassium large conductance calcium-activated channel subfamily M alpha member 1,KCNMA1)、糖原合酶激酶3β(glycogen synthase kinase 3β,GSK3B)、电压门控钠通道α亚基5(sodium voltage-gated channel alpha subunit 5,SCN5A)、BCL2、BAX、半胱氨酸天冬氨酸蛋白酶9(cystein-asparate protease 9,CASP9)、基质金属蛋白酶9(matrix metalloproteinase 9,MMP9)、Jun原癌基因(Jun proto-oncogene,JUN)、肿瘤蛋白p53(tumor protein p53,TP53)、丝裂原活化蛋白激酶8(mitogen-activated protein kinase 8,MAPK8)、金属蛋白酶组织抑制剂1(tissue inhibitor of metalloproteinase 1,TIMP1)、CD163、促红细胞生成素产生肝细胞B2受体(erythropoietin-producing hepatocyte B2 receptor,EPHB2)。对这些靶点进行KEGG富集分析发现川陈皮素具有逆转铂类耐药的潜力(图3)。
3.4 网络药理学预测川陈皮素抑制胃癌铂类耐药的潜在靶点
将川陈皮素的34个靶点与从GENE Card数据库获得甘油磷脂代谢相关的548个潜在靶点相交,其中共同作用的靶点有8个,分别是PTGS1、PPARγ、F10、PTGS2、ESR2、NCOA2、CREB1、PLA2G4A。将数据导入Cytoscape进行可视化后显示2个节点(红色倒三角表示川陈皮素,深蓝色倒三角表示甘油磷脂代谢)和34个潜在靶点(菱形表示潜在靶点),每条连线表示节点之间的相互作用(图4)。

图2 AGS和AGS-DDP细胞的前20个差异脂质代谢产物热图
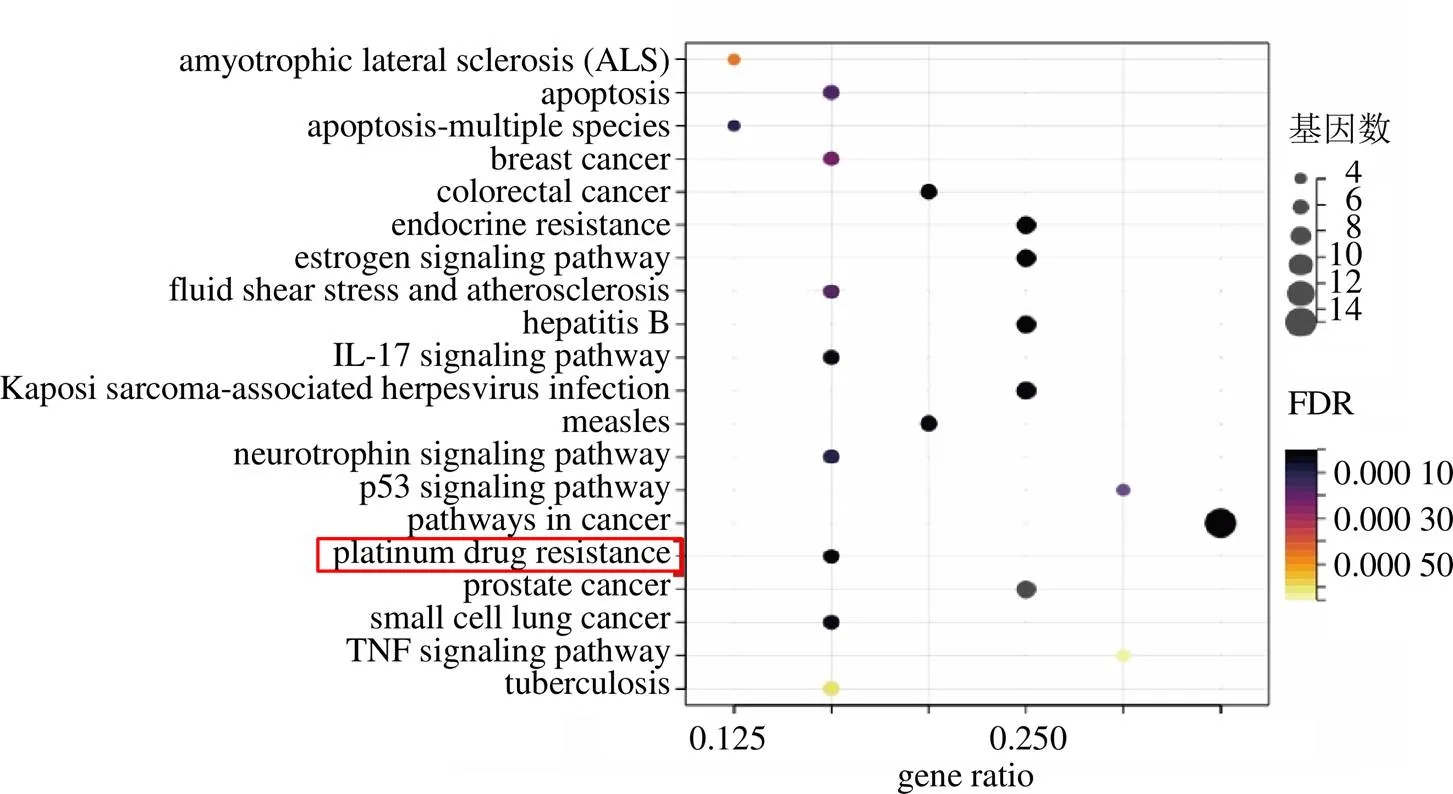
图3 KEGG通路富集分析
3.5 川陈皮素浓度-时间相关性地逆转顺铂耐药
如图5所示,不同浓度顺铂处理后的AGS-DDP细胞存活率在给药48 h后高于AGS细胞。与对照组比较,10、50、100、200 μmol/L川陈皮素处理24 h后,AGS和AGS-DDP细胞的存活率均显著降低(<0.05、0.01),5、10、50、100、200 μmol/L川陈皮素处理48 h后的AGS和AGS-DDP细胞的存活率均显著降低(<0.05、0.01)。50 μmol/L的川陈皮素和不同浓度(0、1、5、10、50、100 μmol/L)的顺铂联用时,AGS-DDP细胞的存活率与仅用顺铂给药时相比有显著性差异(<0.05),说明川陈皮素能增强AGS-DDP细胞对顺铂的敏感性,逆转顺铂耐药。
3.6 川陈皮素诱导AGS-DDP细胞凋亡
如图6所示,与对照组比较,川陈皮素各剂量组细胞凋亡率均显著升高(<0.01),且呈剂量相关性。
3.7 川陈皮素抑制AGS-DDP细胞增殖能力
如图7所示,与对照组比较,川陈皮素各剂量组细胞克隆形成数目均显著减少(<0.01),且呈剂量相关性。
3.8 川陈皮素抑制AGS-DDP细胞迁移能力
如图8所示,与对照组比较,川陈皮素各剂量组给药12 h后细胞迁移能力均显著降低(<0.05、0.01),川陈皮素中、高剂量组给药24、48 h后细胞迁移能力均显著降低(<0.05、0.01),且呈时间-剂量相关性。
3.9 川陈皮素可以调控Bax、Bcl-2、E-cadherin、N-cadherin、ACLY和PPARγ蛋白表达
如图9~11所示,与对照组比较,川陈皮素中、高剂量组Bax、E-cadherin蛋白表达水平均显著升高(<0.05、0.01),ACLY蛋白表达水平均显著降低(<0.05、0.01);川陈皮素高剂量组Bcl-2、N-cadherin、Vimentin和PPARγ蛋白表达水平均显著降低(<0.05、0.01),且呈剂量相关性。

A-DDP作用24 h后细胞存活率 B-DDP作用48 h后细胞存活率 C-川陈皮素作用24 h后细胞存活率 D-川陈皮素作用48h后细胞存活率 E-川陈皮素与顺铂共同作用24 h后细胞存活率 与对照组(0 μmol·L−1)比较:*P<0.05 **P<0.01;与AGS-DDP组比较:#P<0.05,下图同

图6 川陈皮素对AGS-DDP细胞凋亡的影响(, n = 3)
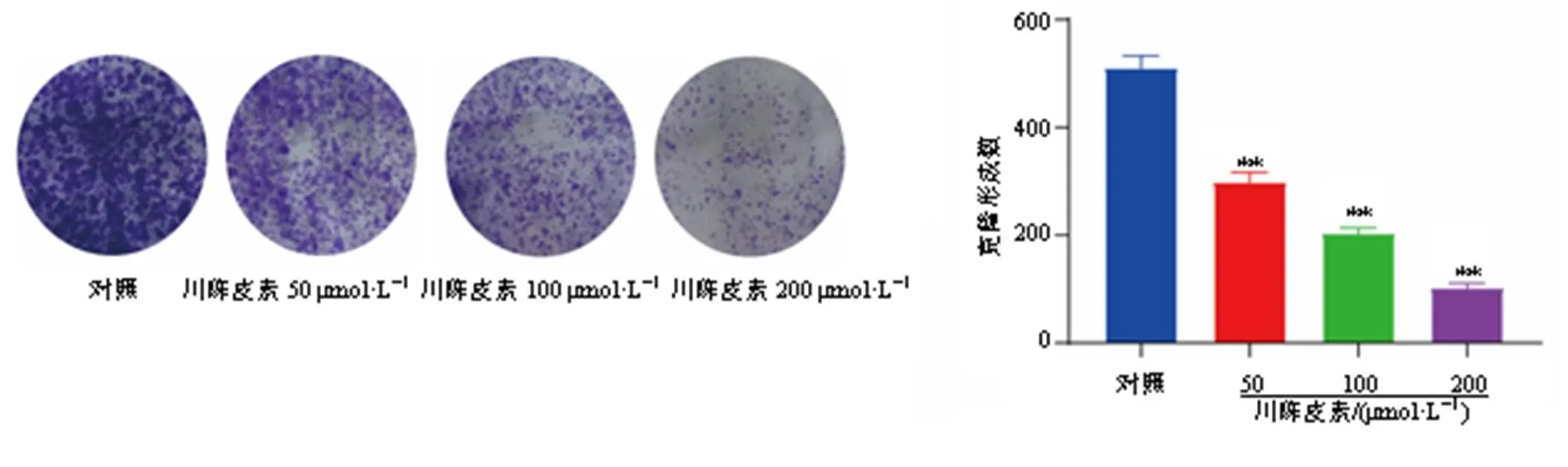
图7 川陈皮素对AGS-DDP细胞增殖的影响(, n = 3)

图8 川陈皮素对AGS-DDP细胞迁移的影响(, n = 3)
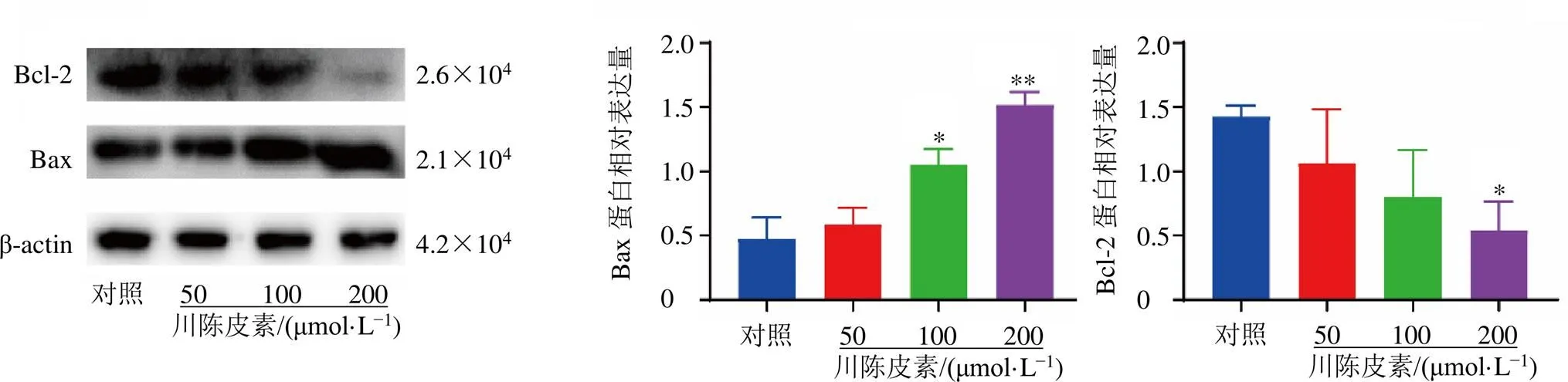
图9 川陈皮素对AGS-DDP细胞凋亡相关蛋白表达的影响(, n = 3)

图10 川陈皮素对AGS-DDP细胞迁移相关蛋白表达的影响(, n = 3)
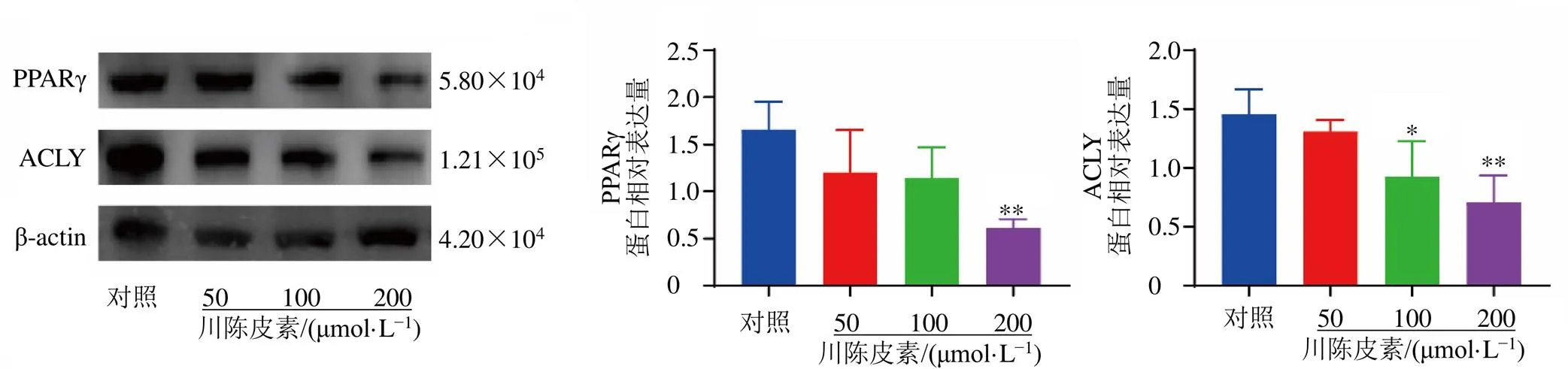
图11 川陈皮素对AGS-DDP细胞脂质代谢相关蛋白表达的影响(, n = 3)
4 讨论
顺铂为金属铂类络合物,是一种周期非特异性抗肿瘤药,被广泛应用于胃癌的治疗,但长期使用顺铂会产生获得性的耐药[3]。近年来,天然活性化合物的潜在机制已成为药物研发的重要内容,越来越多研究证实了陈皮有抗癌的功效[21],川陈皮素是从陈皮中分离得到的一种多甲氧基黄酮类化合物[22],具有抑制肿瘤细胞增殖、控制癌症发生和发展的作用,对多种癌症都有着极强的抗癌功效[23-24]。在课题组前期研究中已经证实了川陈皮素在胃癌中的作用,并且通过抑制脂肪酸的从头合成以改善胃癌的进展[25],因此选取了川陈皮素继续展开接下来的研究,探索川陈皮素对胃癌耐药细胞AGS-DDP的潜在抗癌和逆转耐药的作用机制。
本研究首先采用了超高效液相色谱脂质代谢组学技术,其主要研究目标为各机体内的脂类物质、鉴定脂类分子在蛋白表达和基因代谢中的调控机制[26]。结果显示,AGS与AGS-DDP细胞的脂质代谢产物有显著的差异,根据FC值筛选出了差异最显著的20个代谢产物集中在甘油磷脂代谢途径,预测胃癌耐药可能与甘油磷脂通路的脂质代谢相关。利用网络药理学对川陈皮素的潜在靶点进行KEGG通路富集分析,结果显示川陈皮素可能通过诱导细胞凋亡逆转铂类耐药。进一步发现川陈皮素与甘油磷脂代谢通路预测的靶点中共同作用的有8个,分别是PTGS1、PPARγ、F10、PTGS2、ESR2、NCOA2、CREB1、PLA2G4A,其中PPARγ重组蛋白与脂质的合成与代谢密切相关,研究发现川陈皮素可上调脂肪组织中PPAR家族mRNA表达水平,表明川陈皮素可以诱导脂质贮积和脂肪酸氧化[27],因此PPARγ可能是川陈皮素治疗胃癌细胞耐药的关键靶点。
随后在体外进行细胞实验验证,CCK-8结果显示,不同浓度顺铂处理后的AGS-DDP细胞的存活率在处理48 h后明显高于AGS细胞,证实AGS-DDP细胞对顺铂更不敏感,产生了耐药性;与对照组比较,用不同浓度川陈皮素处理24、48 h后的AGS和AGS-DDP细胞的存活率均降低,50 μmol/L的川陈皮素和顺铂联用时,AGS-DDP细胞的存活率与仅用顺铂给药时相比明显降低,说明川陈皮素能增强AGS-DDP细胞对顺铂的敏感性,逆转顺铂耐药,且呈时间-剂量相关性,因此选用对照组和川陈皮素低、中、高剂量(50、100、200 μmol/L)组进行后续的实验。流式细胞术检测细胞凋亡发现AGS-DDP细胞凋亡数量随着川陈皮素浓度的升高而增加,并且有显著的差异,说明川陈皮素能诱导AGS-DDP细胞凋亡。平板克隆形成结果显示川陈皮素给药后的克隆形成数目与对照组克隆形成数目相比降低,并且有显著性差异,说明川陈皮素能抑制AGS-DDP细胞的增殖能力。细胞划痕实验结果显示,川陈皮素可以明显抑制AGS-DDP细胞的迁移能力。
Bcl家族在细胞凋亡中发挥重要作用,Bcl-2在细胞凋亡中起抑制作用,Bax则起到促进作用,Bcl-2、Bax在评定细胞凋亡中发挥重要作用[28]。Western blotting实验检测了Bcl-2和Bax的蛋白表达水平,与对照组比较,Bcl-2蛋白表达水平降低,Bax蛋白表达水平升高,且与给药剂量呈正相关,说明川陈皮素能诱导AGS-DDP细胞的凋亡;E-cadherin、N-cadherin和Vimentin是维持细胞骨架和细胞黏附能力的重要蛋白,是评定细胞迁移能力的重要标志[29]。E-cadherin表达水平升高,N-cadherin和Vimentin的表达降低,且与给药剂量呈正相关,说明川陈皮素能抑制AGS-DDP细胞的迁移能力;PPARγ是一种重要的转录因子,在炎症性细胞因子产生和细胞分化中起控制作用[30],文献报道PPARγ表达和转录活性的上调与肌肉内脂质沉积有关,拮抗PPARγ可以成功阻止各种来源肿瘤细胞的体外生长,而激活PPARγ则可通过将有毒脂肪酸转化为惰性三酰甘油促进肿瘤生长,并且PPARγ还可以调控ACLY的表达量,ACLY是葡萄糖代谢和脂肪酸合成的桥梁,能催化柠檬酸转化为乙酰辅酶A(coenzyme A,CoA),从而将过量的糖酵解产物导向脂质合成,从而促进肿瘤的生长和分化。因此,PPARγ和ACLY可能成为肿瘤治疗的潜在靶点[31-32]。为了探究川陈皮素是否能调控AGS-DDP细胞的脂质合成和氧化,Western blotting实验检测了PPARγ和ACLY的蛋白表达水平,在给药24 h后均减低,且与给药剂量呈正相关,说明川陈皮素可以通过PPARγ和ACLY调控AGS-DDP细胞的脂质合成和氧化过程。
综上,本研究运用脂质代谢组学和网络药理学探究川陈皮素通过调控脂质合成和氧化改善胃癌顺铂耐药的作用机制,并结合细胞实验验证了川陈皮素对顺铂胃癌耐药细胞增殖、凋亡和迁移能力的作用,为后续川陈皮素治疗胃癌耐药的研究提供新思路、新方向,为进一步研究其作用机制提供数据支撑。
利益冲突 所有作者均声明不存在利益冲突
[1]蒋金玲, 周尘飞, 王超, 等. 2022年度胃癌研究和诊疗新进展 [J]. 中国癌症杂志, 2023, 33(4): 303-314.
[2]张丹, 马甘青, 阎龙, 等. 进展期胃癌转化治疗的研究进展 [J]. 胃肠病学和肝病学杂志, 2023, 32(5): 569-573.
[3]Huang D Q, Savage S R, Calinawan A P,. A highly annotated database of genes associated with platinum resistance in cancer [J]., 2021, 40(46): 6395-6405.
[4]宋婷婷, 赵红燕. 逆转胃癌顺铂耐药的研究进展 [J]. 医学研究杂志, 2021, 50(9): 15-18.
[5]Bian X, Liu R, Meng Y,. Lipid metabolism and cancer [J]., 2021, 218(1): e20201606.
[6]向丽娟, 汪圣毅, 包楚阳, 等. 胃癌脂代谢通路基因表达的转录组学高通量分析 [J]. 安徽医科大学学报, 2019, 54(1): 5-9.
[7]王莹, 周芳. 肿瘤代谢重排与肿瘤耐药相关性的研究进展 [J]. 药物评价研究, 2019, 42(3): 378-384.
[8]Aloia A, Müllhaupt D, Chabbert C D,. A fatty acid oxidation-dependent metabolic shift regulates the adaptation of BRAF-mutated melanoma to MAPK inhibitors [J]., 2019, 25(22): 6852-6867.
[9]孙恺, 杨天民, 夏庆华. 脂代谢途径与肾脏肿瘤治疗 [J]. 泌尿外科杂志: 电子版, 2023, 15(1): 12-17.
[10]Wei X, Shi J J, Lin Q H,. Targeting ACLY attenuates tumor growth and acquired cisplatin resistance in ovarian cancer by inhibiting the PI3K-AKT pathway and activating the AMPK-ROS pathway [J]., 2021, 11: 642229.
[11]缪明永, 石汉平. 肿瘤脂代谢异常和脂代谢调节治疗 [J]. 肿瘤代谢与营养电子杂志, 2016, 3(2): 77-81.
[12]Zhang Y, Lou Y N, Wang J B,. Research status and molecular mechanism of the traditional Chinese medicine and antitumor therapy combined strategy based on tumor microenvironment [J]., 2021, 11: 609705.
[13]Xu W C, Li B L, Xu M C,. Traditional Chinese medicine for precancerous lesions of gastric cancer: A review [J]., 2022, 146: 112542.
[14]Yu X, Sun S, Guo Y Y,.(Chenpi): Botany, ethnopharmacology, phytochemistry, and pharmacology of a frequently used traditional Chinese medicine [J]., 2018, 220: 265-282.
[15]杨静帆, 李敏艳, 秦燕勤, 等. 川陈皮素的药理活性研究进展 [J]. 中医学报, 2023, 38(4): 719-725.
[16]徐健, 曾万祥, 王晓东, 等. 陈皮的化学成分与药理学作用研究进展 [J]. 中国野生植物资源, 2022, 41(10): 72-76.
[17]杨超君, 王跃武, 周开珩. 川陈皮素防治肝缺血再灌注损伤的作用机制研究[J]. 中草药, 2021, 52(8): 2343-2350.
[18]黄睿, 沈淑妤, 陈虹霖, 等. 柑橘类黄酮的生物学活性及提高生物利用度技术研究进展 [J]. 食品科学, 2019, 40(1): 319-326.
[19]Chong J, Soufan O, Li C,. MetaboAnalyst 4.0: Towards more transparent and integrative metabolomics analysis [J]., 2018, 46(W1): W486-W494.
[20]Ru J L, Li P, Wang J N,. TCMSP: A database of systems pharmacology for drug discovery from herbal medicines [J]., 2014, 6: 13.
[21]Singh B, Singh J P, Kaur A,. Phenolic composition, antioxidant potential and health benefits of citrus peel [J]., 2020, 132: 109114.
[22]杨雪竹, 张浩, 崔西玉, 等. 川陈皮素抑制胃癌SGC-7901细胞侵袭能力的机制探讨 [J]. 现代肿瘤医学, 2020, 28(18): 3099-3104.
[23]Ashrafizadeh M, Zarrabi A, Saberifar S,. Nobiletin in cancer therapy: How this plant derived-natural compound targets various oncogene and onco-suppressor pathways [J]., 2020, 8(5): 110.
[24]Kazak F, Akalın P P, Yarım G F,. Protective effects of nobiletin on cisplatin induced neurotoxicity in rats [J]., 2022, 132(5): 531-537.
[25]Chen M L, Zhang R J, Chen Y L,. Nobiletin inhibits de novo FA synthesis to alleviate gastric cancer progression by regulating endoplasmic reticulum stress [J]., 2023, 116: 154902.
[26]仙晴颖, 吴骏, 鲁露, 等. 胃癌代谢组学研究进展 [J]. 中国癌症防治杂志, 2021, 13(2): 211-215.
[27]冯孔龙. 多甲氧基黄酮及陈皮油降脂减肥作用研究 [D]. 广州: 华南农业大学, 2018.
[28]Lin H C, Lin J Y. GSF3, a polysaccharide from guava (L.) seeds, inhibits MCF-7 breast cancer cell growth via increasing Bax/Bcl-2 ratio ormRNA expression levels [J]., 2020, 161: 1261-1271.
[29]陈晓, 谢涵. 川陈皮素调节TLR4/TRIF/IRF3信号通路对宫颈癌细胞增殖、凋亡和侵袭的影响 [J]. 中国优生与遗传杂志, 2022, 30(8): 1305-1311.
[30]Ma S, Zhou B, Yang Q,. A transcriptional regulatory loop of master regulator transcription factors, PPARG, and fatty acid synthesis promotes esophageal adenocarcinoma [J]., 2021, 81(5): 1216-1229.
[31]贠浩, 周锦纹, 张锋, 等. 敲减PPARG对乳腺癌MCF-7细胞裸鼠移植瘤生长影响的研究 [J]. 中国现代普通外科进展, 2023, 26(2): 89-92.
[32]Lian M, Chen J, Shen X,.may promote chemosensitivity of hypopharyngeal squamous cell carcinoma [J]., 2020, 2020: 6452182.
Mechanism of nobiletin on reversing cisplatin resistance in gastric cancer by regulating lipid synthesis and oxidation based on multiomics
SHEN Jun-yu1, LI Huai-zhi1, CHEN Meng-lin1, ZHENG Shan-shan1, ZHANG Can-can1, HAN Bo1, WU Jian2, SUN Qing-min2
1. The First Clinical Medical College, Nanjing University of Chinese Medicine, Nanjing 210023, China 2. Affiliated Hospital of Nanjing University of Chinese Medicine, Nanjing 210029, China
To search for the core targets of nobiletin on gastric cancer cisplatin resistant cells (AGS-DDP) by lipid metabolomics and network pharmacology, and further explore the mechanism of nobiletin on reversing gastric cancer cisplatin resistance through cell experiments.UPLC-Orbitrap mass spectrometry system was used for non-targeted lipidomics analysis. GENE Card and TCMSP databases were utilized to explore potential targets for the metabolic pathways of nobiletin and glycerol phospholipids, the intersection targets were integrated through Microbioinformatics online mapping tool platform, and Kyoto encyclopedia of genes and genomes (KEGG) pathway enrichment analysis was performed. STRING database was used to construct protein-protein interaction (PPI) network, the core targets of nobiletin was visualized by Cytoscape software. After administration of nobiletin, the survival rate of AGS and AGS-DDP cells was detected by CCK-8 method; Flow cytometry was used to detect the apoptosis of AGS-DDP cells; Scratch experiment was used to detect the migration ability of AGS-DDP cells; Western blotting was used to detect B-cell lymphoma-2 (Bcl-2), Bcl-2 associated X protein (Bax), E-cadherin, N-cadherin, Vimentin, peroxisome proliferators-activated receptor γ (PPARγ) and adenosine triphosphate citrate lyase (ACL) protein expressions in AGS-DDP cells.A total of 1450 different lipid compounds were detected in 31 subclasses of AGS and AGS-DDP cells through lipidomics analysis, mainly enriched in glycerol phospholipid metabolism pathway. KEGG enrichment analysis of potential targets of nobiletin showed that nobiletin had the potential to reverse platinum resistance. The results of cell experiment showed that compared with control group, nobiletin significantly inhibited the survival rate of AGS-DDP cells in a dose-dependent manner (< 0.05, 0.01), increased the sensitivity of AGS-DDP cells to cisplatin (< 0.05), induced AGS-DDP cells apoptosis and inhibited its migration ability (< 0.05, 0.01). The results of Western blotting experiments showed that Bax and E-cadherin protein expression levels were significantly increased (< 0.05, 0.01), as well as Bcl-2, N-cadherin, Vimentin, ACL and PPARγ protein expression levels were significantly reduced (< 0.05, 0.01).The differential lipid metabolites between AGS and AGS-DDP cells are mainly enriched in glycerol phospholipid metabolism pathway. Nobiletin inhibits the proliferation and migration of AGS-DDP cells by regulating key genes for lipid synthesis and oxidation, ultimately reversing cisplatin resistance in gastric cancer.
gastric cancer; nobiletin; network pharmacology; cisplatin resistance; lipid synthesis and oxidation; peroxisome proliferators-activated receptor γ
R28.5
A
0253 - 2670(2023)21 - 7066 - 12
10.7501/j.issn.0253-2670.2023.21.015
2023-07-10
国家自然科学基金资助项目(81973609);国家自然科学基金资助项目(81973782);国家自然科学基金资助项目(82174197);江苏省自然科学基金项目(BK20211392);江苏省医学青年人才项目(QNRC2016641);江苏省“333”计划项目(LGY2018065);江苏省中医院学术人才计划项目(Y2021RC29,Y2021RC45)
申隽于,硕士研究生,从事肿瘤临床药学研究。E-mail: 20210143@njucm.edu.cn
通信作者:孙庆敏,副主任药师,从事肿瘤临床药学研究。E-mail: qingminsun@njucm.edu.cn
吴 坚,副研究员,从事肿瘤微环境的研究。E-mail: czcyg@sina.com
[责任编辑 李亚楠]

