基于“药辅合一”的蜗牛黏液载丹酚酸B纳米凝胶制备及其表征
姚碧金,罗 玺,张俏菊,郑俊侨,徐万帮,时 军, 3*
·药剂与工艺·
基于“药辅合一”的蜗牛黏液载丹酚酸B纳米凝胶制备及其表征
姚碧金1,罗 玺1,张俏菊1,郑俊侨1,徐万帮2*,时 军1, 3*
1. 广东药科大学中药学院,广东 广州 510006 2. 广东省药品检验所,广东 广州 510663 3. 广东省局部精准递药制剂工程技术研究中心,广东 广州 510006
制备丹酚酸B-蜗牛黏液纳米凝胶(salvianolic acid B-snail mucus nanogel,SAB-SM/Gel),进行相关表征及体外透皮性能研究。采用高压均质法制备丹酚酸B-蜗牛黏液纳米粒(salvianolic acid B-snail mucus nanoparticles,SAB-SM),再用搅拌法将其与凝胶基质制成SAB-SM/Gel。对纳米粒的形状、粒径、多分散指数(polydispersity index,PDI)、ζ电位等进行表征;用Franz扩散池法考察SAB-SM/Gel体外透皮吸收及真皮层滞留性能。SAB-SM纳米粒为透明均一的液体,具有丁达尔效应,透射电子显微镜(transmission electron microscope,TEM)下呈球状或类球状结构,大小均一,粒子间无黏连现象,平均粒径为(155.55±2.95)nm,PDI为0.31±0.01,平均ζ电位为(−15.45±1.67)mV,pH值为6.11±0.12,SAB-SM纳米粒中SAB的包封率为(37.70±1.16)%,载药量(1.78±0.06)mg/mL;SAB-SM/Gel在常温下为无色透明液体,TEM下呈圆形或类圆形,pH值为6.24±0.13,包封率为(42.42±1.02)%,SAB载药量(1.44±0.04)mg/mL,平均黏度为0.02 Pa·s,质地均匀细腻,涂抹至皮肤能快速胶凝,可涂布性能良好。体外透皮试验表明,SAB-SM/Gel中SAB在48 h内单位面积累透过量为(188.39±2.89)μg/cm2,真皮滞留量为(17.58±0.04)μg/cm2,透皮释放过程符合Hixson-Crowell方程。SAB-SM/Gel处方工艺合理,具有良好的透皮吸收性能和真皮滞留性能。
药辅合一;蜗牛;黏液;丹酚酸B;高压均质法;纳米粒;凝胶;透皮吸收
皮肤衰老包括内源性衰老和外源性衰老。外源性衰老是由于外在环境刺激而加速的皮肤衰老,其中以紫外线照射为主,占80%,因此,外源性衰老又称为光老化[1]。紫外线照射皮肤会产生过量的自由基,在皮肤细胞中产生严重的氧化应激,可导致细胞损伤、细胞凋亡、炎症反应,进而造成皮肤松弛、粗糙、皱纹增多、色素异常,甚至诱发鳞状细胞癌等恶性皮肤癌[2-4]。预防和改善皮肤光老化已成为皮肤问题研究热点,具有重要的社会价值和意义。
丹酚酸B(salvianolic acid B,SAB)是丹参中的一种多酚酸类化合物,具有较强的抗氧化性和清除自由基功能,其作用强度优于维生素E,还兼具抗炎、抑制细胞凋亡等作用[5]。SAB通过降低活性氧(reactive oxygen species,ROS)的产生、调节抗氧化酶活力、增加沉默信息调节因子1(silent information regulator 1,SIRT1)蛋白表达、抑制炎症因子的产生等多种途径,减少氧化应激损害,保护细胞,发挥抗光老化作用[6-8]。蜗牛黏液(snail mucus,SM)是从白玉等蜗牛足腺分泌的黏液中过滤萃取的精华物,富含尿囊素、乙醇酸、透明质酸及多酚等活性成分[9]。尿囊素以脱皮作用促进细胞增殖和伤口愈合;乙醇酸具有极好的渗透皮肤的能力,并能够增加胶原蛋白的合成;透明质酸具有保湿功能;而多酚则抵消与氧化应激有关的损害[10-12]。SM已被证明在抗菌、抗炎、抗氧化、抗酪氨酸酶和抗肿瘤等方面具有一定的作用。同时其具有复杂网状结构,是一种天然的载体材料[13]。本课题组前期通过细胞试验证实,SAB可能具有抗光老化的潜力[7],本研究结合SM独特的药理活性和物理特性,运用“药辅合一”理念[14-15]设计纳米粒。将SM作为载体包裹SAB,制备丹酚酸B-蜗牛黏液纳米粒(salvianolic acid B-snail mucus nanoparticles,SAB- SM),再加入泊洛沙姆制备其纳米凝胶,为丹酚酸B抗老化研究提供科学依据。图1为丹酚酸B-蜗牛黏液纳米粒(salvianolic acid B-snail mucus nanogel,SAB-SM/Gel)制剂设计思路图。

图1 SAB-SM/Gel制剂设计思路图
1 仪器与材料
1.1 仪器
Ultimate 3000型高效液相色谱仪系统,赛默飞世尔科技公司;NS1001L型高压均质机,意大利GEA Niro Soavi公司;Hitachi HT7800型透射电子显微镜(TEM),日立有限公司;Delsa Nano C型纳米粒度/Zeta电位分布分析仪,贝克曼库尔特公司;MS-H-Pro+型磁力搅拌器,美国赛洛捷克公司;PHS- 25型电子数显pH计,上海雷磁仪器厂;FD-1A-50型冷冻干燥机,北京博医康实验仪器有限公司;HH- 2型数显恒温水浴锅,常州智博瑞仪器制造有限公司;MX-S型漩涡混匀器,大龙兴创实验仪器(北京)股份公司;BSA124S型万分之一电子天平、单道可调节移液器(10、20、50、100、200、1000 μL),北京赛多利斯仪器系统有限公司;TP-6型透皮扩散仪,天津市精拓仪器科技有限公司;Tiss-24型高速组织研磨机,上海净信实业发展有限公司;TGL-16型台式高速冷冻离心机,湖南湘仪离心机仪器有限公司。
1.2 材料
丹酚酸B对照品,批号PS011518,质量分数≥98%,成都普思生物科技股份有限公司;蜗牛黏液,批号210912,广州雨霖蜗牛有限公司;蔗糖,批号20204112081,天津市致远化学试剂有限公司;泊洛沙姆407(批号GND11321B)、泊洛沙姆188(批号GND17422B),武汉胜天宇生物科技有限公司;乌来糖,批号M25HS183263,上海源叶生物科技有限公司;氯化钠,批号20220701,天津市大茂化学试剂厂;SAB-SM纳米粒,实验室自制;SAB-SM/Gel,实验室自制。
1.3 动物
SPF级健康SD雄大鼠,体质量200~250 g,合格证号为SCXK(粤)2021-0041;所有动物实验遵循广东药科大学试验动物伦理委员会有关实验动物管理和使用的规定,均符合3R原则。
2 方法与结果
2.1 SAB-SM纳米粒的制备
采用高压均质法制备SAB-SM纳米粒。精密称取适量SM,加入5 mL去离子水,搅拌均匀;称取适量SAB,去离子水定容于1 mL量瓶中,在400 r/min磁力搅拌条件下,缓慢匀速加入至蜗牛黏液中,搅拌10 min,采用高压均质机在70 MPa压力下均质10次,过0.22 μm滤膜,即得SAB-SM纳米粒。
2.2 丹酚酸B含量测定
2.2.1 色谱条件 Cosmosil C18-PAQ色谱柱(250 mm×4.6 mm,5 μm);流动相为乙腈-0.1%磷酸水溶液,梯度洗脱程序:0~5 min,32%乙腈;5~20 min,42%乙腈;柱温30 ℃;体积流量1.0 mL/min;进样量10 μL;检测波长286 nm。
2.2.2 对照品溶液的制备 分别精密称取适量丹酚酸B对照品于1 mL棕色量瓶中,甲醇稀释至刻度,摇匀,即得质量浓度为1000 μg/mL和100 μg/mL的丹酚酸B对照品溶液。
2.2.3 供试品溶液的制备 精密吸取SAB-SM 1 mL于10 mL棕色量瓶中,甲醇稀释至刻度,超声20 min,过0.22 μm滤膜,即得供试品溶液。
2.2.4 空白对照溶液的制备 精密吸取SM 1 mL于10 mL量瓶中,甲醇稀释至刻度,超声20 min,过0.22 μm滤膜,即得空白对照溶液。
2.2.5 线性关系考察 制备高质量浓度(1000 μg/mL)和低质量浓度(100 μg/mL)SAB对照品溶液,并分别绘制标准曲线。将2个质量浓度对照品溶液进行梯度稀释,分别精密吸取1、2、4、6、8、10 mL于10 mL的量瓶中,甲醇稀释至刻度,摇匀。以“2.2.1”项下色谱条件进行检测,记录峰面积。以SAB峰面积()对其质量浓度()进行线性回归,得到高质量浓度曲线回归方程为=0.210 9+3.579 1(2=0.999 7),低质量浓度曲线回归方程为=0.230 2-0.220 9(2=0.999 3),结果表明,SAB在100~1000 μg/mL和10~100 μg/mL线性关系良好。
2.2.6 专属性考察 精密吸取SAB、SM、SAB-SM溶液,按“2.2.1”项下色谱条件,进样测定。结果如图2所示,SAB保留时间为(6.15±0.20)min,峰拖尾因子在0.95~1.05,理论板数不低于8000,表明该方法专属性强,SAB峰形稳定,分离度良好,无其他物质干扰,符合试验要求。

图2 SAB对照品溶液(a)、SM (b) 和SAB-SM纳米粒(c) 的HPLC图
2.2.7 精密度考察 制备3种不同质量浓度的SAB对照品溶液(1000、500、100 μg/mL),连续进样测定6次,计算精密度。RSD均小于3%,说明仪器精密度良好,符合试验检测要求。
2.2.8 重复性考察 平行制备6份供试品溶液,进样测定。RSD小于2%,表明该实验方法操作误差较小,方法可行。
2.2.9 稳定性考察 精密吸取供试品溶液10 μL,分别在0、2、4、6、8、12、24 h进样,测定SAB含量。RSD小于3%,说明SAB在24 h内检测稳定性良好。
2.2.10 加样回收率考察 配制500 μg/mL的SAB- SM溶液,分别精密加入SAB-SM样品中SAB含量50%、100%、150%的SAB对照品溶液,甲醇定容于5 mL量瓶中,平行3次,进样测定加样回收率。50%、100%、150% SAB加入量的平均加样回收率分别为100.47%、99.98%、100.59%,RSD分别为1.02%、1.56%、0.74%,均小于2%,符合试验检测要求。
2.3 SAB-SM纳米粒的工艺优化及基本性能表征
2.3.1 超滤离心法测定SAB-SM包封率
(1)游离药物加样回收率考察:用去离子水配制1.03、2.00、3.02 mg/mL 3种质量浓度的SAB溶液,平行3次;取0.5 mL SAB溶液,分别置于截留相对分子质量(molecular weight cut off,MWCO)为1.0×104、3.0×104、5.0×104超滤离心管上层,4000 r/min离心(离心半径为6.4 cm)30 min,取滤液和滤过前的溶液,加甲醇稀释1倍,过0.22 μm滤膜,进行HPLC测定。结果如表1所示,MWCO 1.0×104超滤管平均加样回收率为(85.51±0.33)%,MWCO 3.0×104超滤管平均加样回收率为(95.28±0.57)%,MWCO 5.0×104超滤管平均加样回收率为(98.87±0.73)%,因此,选用MWCO 5.0×104超滤管进行后续实验。
(2)超滤加样回收率考察:在空白SM溶液中,分别加入上述不同质量浓度的SAB对照品溶液,然后转移到MWCO 5.0×104超滤管上层,平行3次。SAB含量测定同上。结果如表2所示,低、中、高3个质量浓度的平均加样回收率分别为95.01%、95.67%、96.76%,RSD分别为1.18%、1.47%、1.49%,均小于2%,符合实验要求。

表1 游离药物加样回收率考察结果(, n = 3)

表2 超滤加样回收率考察结果(, n = 3)
(3)包封率的测定:采用超滤离心法测定SAB-SM包封率。取0.5 mL SAB-SM于MWCO 5.0×104超滤管,4000 r/min离心30 min,取滤液(1)和滤过前的溶液(2),甲醇稀释10倍,过0.22 μm滤膜,HPLC测定,代入标准曲线计算SAB含量,根据下面公式计算SAB的包封率。
包封率=(2-1)/2
1为SAB-SM中未被包封的药量,2为SAB-SM中总药量
2.3.2 蜗牛黏液用量的筛选 分别精密称取0.1、0.2、0.3、0.4、0.5 g蜗牛黏液,其余步骤同“2.3.1”,并测定其包封率。结果如表3所示,蜗牛黏液为0.4 g时,包封率较高。
2.3.3 SAB用量的筛选 分别精密称取0.5、1.0、1.5、2.0、2.5 mg的SAB,其余步骤同“2.3.1”项,并测定其包封率。结果如表4所示,SAB用量为2.0 mg时,包封率较高。

表3 SM用量对包封率的影响(, n = 3)

表4 SAB用量对包封率的影响(, n = 3)
2.3.4 SAB-SM纳米粒的最优工艺 采用高压均质法制备SAB-SM纳米粒。精密称取0.4 g SM,加入5 mL去离子水,搅拌均匀;称取2 mg SAB,去离子水定容于1 mL量瓶中,在400 r/min磁力搅拌条件下缓慢匀速加入至蜗牛黏液中,搅拌10 min,采用高压均质机在70 MPa压力下均质10次,过0.22 μm滤膜,即得SAB-SM纳米粒。
2.3.5 SAB-SM纳米粒的基本性能表征 根据最优工艺制备SAB-SM,取适量处方优化后的SAB-SM观察外观性状,用激光笔照射,观察是否具有丁达尔现象;取适量SAB-SM于10 mL小烧杯中,利用pH计测定其pH值;用移液枪吸取适量SAB-SM纳米粒滴至铜网上,滴加2%磷钨酸溶液进行负染,静置3~5 min,自然干燥后,利用TEM观察其形貌特征;利用马尔文激光粒度仪测定SAB-SM的平均粒径、粒度多分散系数(polydispersity index,PDI)和ζ电位。结果如图3所示,SAB-SM纳米粒为透明均一的液体,激光笔照射可观察到一条明显的光路,表明具有丁达尔效应;pH值为6.11±0.12;TEM下呈球状或类球状结构,大小均一,分散均匀,粒子间无黏连现象;SAB-SM纳米粒的平均粒径为(155.55±2.95)nm,PDI为0.312±0.011,平均ζ电位为(−15.45±1.67)mV;SAB的平均包封率为(37.70±1.16)%,载药量(1.78±0.06)mg/mL。
2.4 SAB-SM/Gel的制备与表征
2.4.1 药物载体的选择 水溶性凝胶常用的基质如泊洛沙姆、卡波姆、透明质酸等天然高分子材料,具有生物降解性和生物相容性,已广泛应用于药物递送系统。卡波姆凝胶常用于弱碱性药物体系,不适于作为酸类活性成分的载体。透明质酸单独作为药物载体时易被酶解,其改性操作复杂,且价格昂贵。泊洛沙姆是一类热敏性高分子聚合物,与其他半固体和液体制剂相比,黏性没那么大、容易清洗、比液体配方停留时间长、更方便使用。综合考虑各基质的材料特性,结合SAB特性及凝胶的物理性质,最终选择泊洛沙姆作为药物载体。
2.4.2 SAB-SM/Gel的制备 采用搅拌法制备SAB- SM/Gel。取适量SAB-SM,加入10%蔗糖作为冻干保护剂,冷冻干燥24 h,得SAB-SM纳米粒冻干粉;配制一定质量浓度的泊洛沙姆溶液,4 ℃冷藏过夜,充分溶胀。精密称取适量SAB-SM纳米粒冻干粉,加至泊洛沙姆溶液中,搅拌均匀,静置,即得丹酚酸B-蜗牛黏液纳米凝胶(SAB-SM/Gel)。
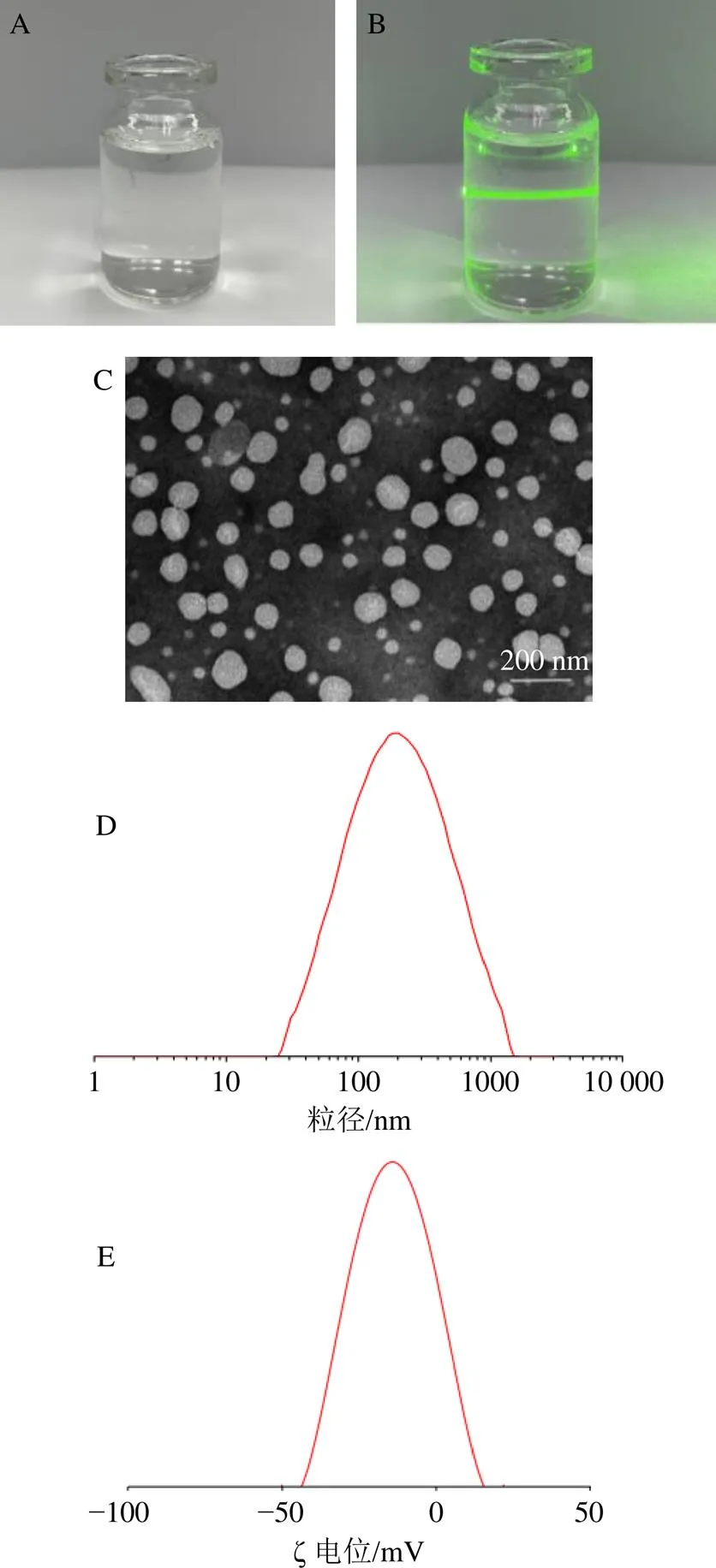
A-外观 B-丁达尔效应 C-TEM (×10) D-粒径 E-ζ电位
2.4.4 SAB-SM投料量的考察 考察SAB-SM纳米粒冻干粉的加入对基质胶凝温度的影响。不同SAB- SM投料量对胶凝温度的影响如表6所示,可以发现SAB-SM投料量对泊洛沙姆的胶凝温度影响较小,所制得的SAB-SM/Gel均一细腻,无颗粒感。为尽可能提高处方含药量,确定SAB-SM投料量为80%。

表5 不同浓度P407与P188的胶凝温度(, n = 3)

表6 不同SAB投料量的考察(, n = 3)
2.4.5 SAB-SM/Gel的表征 取适量处方优后制得的SAB-SM/Gel于烧杯中,用pH计测定其pH值;取适量SAB-SM/Gel观察外观性状;另取适量SAB- SM/Gel,用2%的磷钨酸负染,自然干燥后,TEM下观察其形态。结果如图4所示,SAB-SM/Gel的pH值为6.24±0.13,在常温下为无色透明液体,TEM下呈圆形或类圆形,分布均匀,可见泊洛沙姆的加入对SAB-SM纳米粒结构没有显著影响。SAB- SM/Gel中SAB的包封率为(42.42±1.02)%,SAB载药量(1.44±0.04)mg/mL。

A-外观 B-TEM (×10)
2.4.6 胶凝温度的测定 采用试管法测定胶凝温度。将2 mL P407-P188置于10 mL西林瓶内,西林瓶置于25 ℃恒温水浴锅中,每隔一段时间升高0.5 ℃,待温度稳定后,将西林瓶倒置,观察液面是否流动,液面不再流动时,为胶凝温度。结果发现,室温状态下,SAB-SM/Gel为无色透明液体,当温度升高至30 ℃,SAB-SM/Gel快速胶凝,倒置不流动(如图5所示),表现出良好的胶凝能力,符合皮肤给药要求。
2.4.7 SAB-SM/Gel的黏度考察 取适量SAB-SM/ Gel,按照黏度测定法用旋转式黏度计测定,测得平均黏度为0.02 Pa·s(=3)。

图5 SAB-SM/Gel在不同温度下的物理状态(n = 3)
2.4.8 SAB-SM/Gel的可涂布性能 取适量SAB- SM/Gel,涂抹至皮肤,评价其可涂布性能。SAB-SM/ Gel质地均匀细腻,涂抹至皮肤能快速胶凝,可涂布性能良好。
2.5 SAB-SM/Gel透皮性能研究
选用Franz扩散池法考察SAB-SM/Gel体外透皮性能和真皮层滞留性能,计算并拟合药物释放模型,探究SAB-SM/Gel在皮肤内渗透动力学规律,为其在药物递送领域的应用提供了理论依据。
2.5.1 体外透皮实验 取SD大鼠进行脱毛处理,处死后剥取腹部皮肤并去除皮下脂肪及黏液组织,将皮肤固定于Franz扩散池的供给室和接收室之间,角质层朝向供给室,接收介质溶液为生理盐水,37 ℃、350 r/min进行试验;分别在供给室中加入1 mL同等质量浓度的SAB溶液、SAB-SM纳米粒和SAB-SM/Gel,分别于0、1、2、4、6、8、10、12、24、30、36、48 h取样1 mL,并补加等温等量接收介质,保证接收液的液面与皮肤真皮层紧密接触,没有气泡。将各时间点的样品溶液过0.22 μm滤膜,HPLC法测定SAB的质量浓度,按公式计算单位面积累积透过量(Q)。

Q为时间点单位面积累积透过量,C为第个取样点所取样品中药物的质量浓度,C为第(=-1)个时间点所取样品中药物的质量浓度,为接收池体积(15 mL),V为取样体积,为扩散池有效接触面积(1.766 cm2)
2.5.2 真皮滞留量 透皮试验结束后,用生理盐水洗净离体皮肤,剪碎,加入1 mL生理盐水,制成10%皮肤匀浆,3500 r/min离心10 min,取上清液,过0.22 μm滤膜,HPLC法测定SAB含量,按公式计算真皮滞留量(s)。
s=/
s为药物的真皮滞留量,为皮肤样品液中药物的质量浓度,为皮肤样品液的总体积(1 mL)
以为横坐标,Q为纵坐标,绘制-曲线并进行模型拟合,结果见图6和表7。
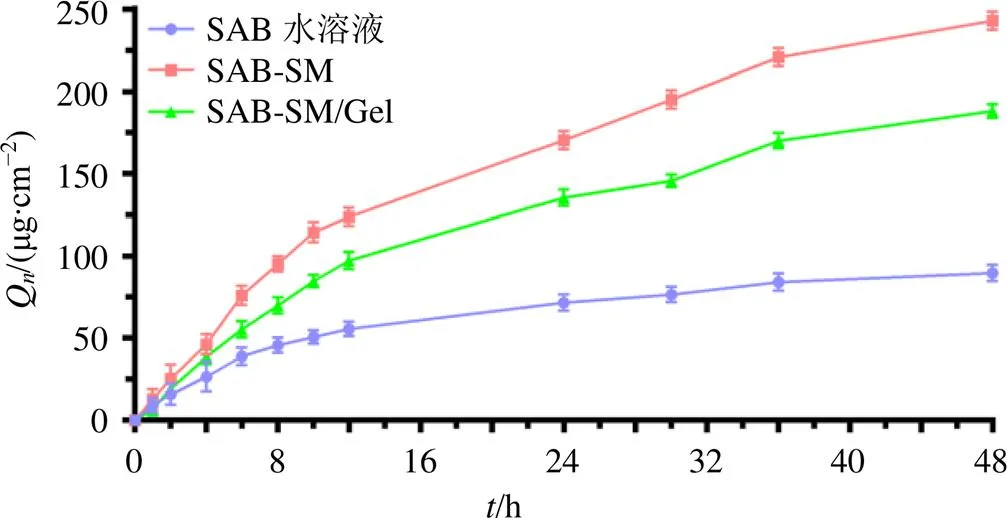
图6 SAB-SM/Gel透皮吸收曲线(, n = 3)

表7 SAB-SM/Gel体外透皮试验结果(, n = 3)
如图6所示,SAB-SM/Gel中SAB累积透皮量高于SAB水溶液,表明SAB-SM/Gel能提高SAB体外透皮性能。SAB-SM中SAB累积释放量最高,高于SAB-SM/Gel。这可能是由于凝胶具有良好的药物缓释性,SAB-SM/Gel中部分SAB储存于皮肤真皮层。SAB-SM/Gel中SAB的真皮滞留量为(17.58±0.04)μg/cm2(=3),高于SAB溶液、SAB-SM纳米粒,表明SAB-SM/Gel在可以皮肤真皮层蓄积,形成药物贮库,缓慢持续释放药物。
如表7所示,SAB-SM/Gel中SAB在48 h内Q为(188.390 3±2.890 0)μg/cm2(=3),= 0.002 73-0.273 02+10.832 0-0.870 6(2=0.996 9),透皮释放过程符合Hixson-Crowell方程,释药过程遵循扩散和溶蚀规律,表明SAB-SM/Gel具有一定的缓释作用。
3 讨论
丹酚酸B是丹参中含量最高的水溶性成分,有较好的抗氧化活性,能够调节细胞氧化应激,清除细胞内的活性氧,改善组织细胞损伤,为天然有效的自由基清除剂[16-19]。此外还具有抗炎、改善微循环、增强新陈代谢等作用。研究表明,SAB具有抑制皮肤光老化的功能[19-20]。Wang等[6]研究发现SAB可以抑制H2O2诱导大鼠肠上皮细胞的细胞活力下降和细胞凋亡,改善了H2O2诱导的肠上皮屏障功能障碍和线粒体功能障碍,并不同程度地抑制了H2O2诱导的ROS产生。然而SAB性质不稳定,在水中极易水解,对温度比较敏感,且透皮性能较差,阻碍了其在皮肤制剂领域中的应用。
蜗牛黏液是一种有吸引力的天然物质,由于其润肤、保湿、保护和修复性能,越来越多地用于药物和化妆品中。SM已被证明在抗氧化、抗菌、抗病毒和免疫调节等方面发挥重要作用[21]。SM不仅可以治疗黑色素生成,而且具有抗人黑色素瘤细胞的肿瘤活性。SM刺激胶原蛋白,弹性蛋白和真皮成分的形成,修复光老化的迹象,并最大限度地减少自由基产生的损伤[22]。在壳聚糖基和纤维素基薄膜中添加SM,显著改善了其水分屏障和生物粘附性能、薄膜伸长率、黏附强度和紫外线屏蔽效果[23]。
纳米凝胶是具有高度交联结构的多孔的三维网状系统,尺寸在10~1000 nm[24]。纳米凝胶结合了水凝胶和纳米粒的特性,具有一定的黏附性,避免了纳米粒的皮肤滞留效果不佳的情况;保护不稳定性药物,避免药物受外界因素影响而被破坏[25];具有较高的载药量;并具有生物相容性和生物可降解性[26]。此外,多项研究证明,纳米凝胶具有优良的缓释性能,有利于在真皮层形成药物贮库,提高生物利用度。因此,其在药物载体方面具有广阔的应用前景。
本研究基于“药辅合一”这一中药复方制剂中的重要指导原则,将SM与SAB制成纳米凝胶,既发挥SAB和SM的抗氧化、抗炎的药理作用,又利用SM良好的保湿性、润肤性及其复杂网状结构,发挥药物载体作用。本实验结果表明,SAB-SM/Gel制备方法简单,具有良好的缓释性能,且药物真皮滞留性能良好,可提高患者顺应性,后续试验将深入研究SAB-SM/Gel抗光老化效果及作用机制,为丹参抗光老化研究提供科学依据。
利益冲突 所有作者均声明不存在利益冲突
[1]Cui B N, Wang Y, Jin J H,. Resveratrol treats UVB-induced photoaging by anti-MMP expression, through anti-inflammatory, antioxidant, and antiapoptotic properties, and treats photoaging by upregulating VEGF-B expression [J]., 2022, 2022: 6037303.
[2]罗珍, 宁初光, 李祚禛, 等. 番茄、野樱莓提取物抗光老化功效及机制研究 [J]. 食品工业科技, 2023, 44(16): 395-402.
[3]孔翔, 徐开颜, 吴芷菁, 等. 小细胞外囊泡在皮肤光老化等皮肤疾病中的作用及机制研究进展 [J]. 中国细胞生物学学报, 2023, 45(2): 334-344.
[4]陈诚, 肖洁银, 余梦. 强脉冲光联合超脉冲点阵CO2激光治疗皮肤光老化的有效性及安全性分析 [J]. 中国美容医学, 2022, 31(7): 1-4.
[5]王瑞醒, 谢毅鹏, 王车礼. 丹酚酸B杂化纳米花的合成与体外抗氧化活性研究 [J]. 化工新型材料, 2023, 51(4): 238-242.
[6]Wang D, Lu X N, Wang E B,. Salvianolic acid B attenuates oxidative stress-induced injuries in enterocytes by activating Akt/GSK3β signaling and preserving mitochondrial function [J]., 2021, 909: 174408.
[7]罗玺. 丹酚酸B抗光老化作用及其纳米凝胶制备考察[D]. 广州: 广东药科大学, 2023.
[8]Lou Y T, Wang C G, Zheng W H,. Salvianolic acid B inhibits IL-1β-induced inflammatory cytokine production in human osteoarthritis chondrocytes and has a protective effect in a mouse osteoarthritis model [J]., 2017, 46: 31-37.
[9]Noothuan N, Apitanyasai K, Panha S,. Snail mucus from the mantle and foot of two land snails,andexhibits different protein profile and biological activity [J]., 2021, 14(1): 138.
[10]Mane P C, Sayyed S A R, Kadam D D,. Terrestrial snail-mucus mediated green synthesis of silver nanoparticles andinvestigations on their antimicrobial and anticancer activities [J]., 2021, 11(1): 13068.
[11]Messina L, Bruno F, Licata P,. Snail mucus filtrate reduces inflammation in canine progenitor epidermal keratinocytes (CPEK) [J]., 2022, 12(14): 1848.
[12]Cilia G, Fratini F. Antimicrobial properties of terrestrial snail and slug mucus [J]., 2018,doi: 10.1515/jcim-2017-0168.
[13]郭思旖, 陈桂添, 时军, 等. 丹皮酚-蜗牛黏液纳米凝胶理化性质考察及抗兔耳增生性瘢痕作用研究 [J]. 中国中药杂志, 2019, 44(22): 4857-4863.
[14]邱菁, 徐纯艺, 周玮玲, 等. 基于“药辅合一”理念的当归精油纳米乳递药系统的构建、表征及评价 [J]. 中草药, 2023, 54(6): 1783-1792.
[15]彭磊, 封亮, 杨艳君, 等. 基于“药辅合一”理念的Pickering乳技术提升儿科用药羚珠散中石菖蒲挥发油热稳定性的研究 [J]. 中草药, 2023, 54(2): 544-552.
[16]何珊, 付先军, 张玲, 等. 响应面法优化丹参有效成分的提取工艺及其体外抗氧化活性研究 [J]. 中华中医药学刊, 2021, 39(1): 28-32.
[17]王怡, 高秀梅, 邢永发, 等. 丹参酚酸B、丹参酮治疗心血管疾病的药理学研究进展 [J]. 上海中医药杂志, 2010, 44(7): 82-87.
[18]Wang D, Lu X N, Wang E B,. Salvianolic acid B attenuates oxidative stress-induced injuries in enterocytes by activating Akt/GSK3β signaling and preserving mitochondrial function [J]., 2021, 909: 174408.
[19]廖泳, 陈驹. 丹酚酸B乳剂抗小鼠皮肤光老化的效果评价 [J]. 中国皮肤性病学杂志, 2017, 31(10): 1073-1076.
[20]王璐, 李中平, 曹艳亚, 等. 沙参麦冬汤对皮肤光老化模型小鼠的保护作用 [J]. 中国老年学杂志, 2015, 35(6): 1628-1631.
[21]Song Y M, Cui Y X, Hao L M,. Wound-healing activity of glycoproteins from white jade snail () on experimentally burned mice [J]., 2021, 175: 313-321.
[22]Ellijimi C, Ben Hammouda M, Othman H,.maxima mucus exhibits antimelanogenic and antitumoral effects against melanoma cells [J]., 2018, 101: 871-880.
[23]di Filippo M F, Albertini B, Dolci L S,. Novel drug-loaded film forming patch based on gelatin and snail slime [J]., 2021, 598: 120408.
[24]Qureshi M A, Khatoon F. Different types of smart nanogel for targeted delivery [J]., 2019, 4(2): 201-212.
[25]杨雪华, 李大伟, 毛楷凡, 等. 纳米凝胶的研究进展 [J]. 食品与药品, 2022, 24(2): 183-187.
[26]Neamtu I, Rusu A G, Diaconu A,. Basic concepts and recent advances in nanogels as carriers for medical applications [J]., 2017, 24(1): 539-557.
Preparation and characterization of salvianolic acid B-snail mucus nanogels based on “unification of drugs and excipients”
YAO Bi-jin1, LUO Xi1, ZHANG Qiao-ju1, ZHENG Jun-qiao1, XU Wan-bang2, SHI Jun1, 3
1. School of Traditional Chinese Medicine, Guangdong Pharmaceutical University, Guangzhou 510006, China 2. Guangdong Institute for Drug Control, Guangzhou 510663, China3. Guangdong Engineering & Technology Research Center of Topical Precise Drug Delivery Preparation, Guangzhou 510006, China
To prepare salvianolic acid B-snail mucus nanogel (SAB-SM/Gel) and study its related characterization and the osmotic dynamics ofskin.Salvianolic acid B-snail mucus nanoparticles (SAB-SM nanoparticles) were prepared by high-pressure homogenization method, and then SAB-SM/Gel was prepared with the gel matrix by stirring. The shape, size, polydispersity index (PDI), ζ potential, etc. of nanoparticles were characterize; The Franz diffusion pool method was used to investigate the transdermal absorption and dermal retention performance of SAB-SM/Gel.SAB-SM nanoparticles are transparent and homogeneous liquid, with Tyndall effect, spherical or spheroid structure under transmission electron microscope (TEM), uniform size, no adhesion between particles, average particle size of (155.55 ± 2.95) nm, PDI of 0.31 ± 0.01, average ζ potential of (−15.45 ± 1.67) mV, pH of 6.11 ± 0.12, encapsulation rate of SAB in SAB-SM nanoparticles is (37.70 ± 1.16) %, and drug load is (1.78 ± 0.06) mg/mL; SAB- SM/Gel is a colorless transparent liquid at room temperature, round or quasi-circular under TEM, pH of 6.24 ± 0.13, encapsulation rate of (42.42 ± 1.02) %, SAB loading capacity of (1.44 ± 0.04) mg/mL, average viscosity of 0.02 Pa·s, uniform and delicate texture, which can be quickly gelled applied to the skin, and has good coating performance. Thetransdermal test showed that the cumulative permeability of SAB in SAB-SM/Gel within 48 h was (188.39 ± 2.89) μg/cm2, the dermal retention amount was (17.58 ± 0.04) μg/cm2, and the transdermal release process conformed to the Hixson-Crowell equation.SAB-SM/Gel prescription process is reasonable, with good transdermal absorption and dermal retention performance.
unification of drugs and excipients;snail; mucus; salvianolic acid B; high pressure homogenization method; nanoparticles; gel; transdermal absorption
R283.6
A
0253 - 2670(2023)21- 6988 - 09
10.7501/j.issn.0253-2670.2023.21.007
2023-05-16
国家自然科学基金资助项目(82173982);广东省自然科学基金资助项目(2022A1515011382)
姚碧金(1998—),女,硕士研究生,研究方向为中药制剂研究与开发。Tel: 15362945509 E-mail: 2672245967@qq.com
通信作者:时 军(1990—),男,博士,教授,研究方向为纳米经皮给药系统及瘢痕的中医药防治。E-mail: shijun8008@163.com
徐万帮(1979—),男,博士,副主任中药师,研究方向为中药外源性污染与中药标准体系研究。E-mail: wbxu@163.com
[责任编辑 郑礼胜]

