白酒大曲发酵过程中微生物群落及功能研究进展
薄 涛,吕 娜,杨凯环,张娇娇,张锦华,白宝清,田 翔,范三红,*
(1.山西大学生物技术研究所,化学生物学与分子工程教育部重点实验室,山西 太原 030006;2.山西大学杏花村学院,山西 太原 030006;3.山西杏花村汾酒厂股份有限公司中国汾酒城管理中心,山西 汾阳 032200;4.山西大学生命科学学院,山西 太原 030006;5.山西农业大学农业基因资源研究中心,山西 太原 030031;6.农业农村部黄土高原作物基因资源与种质创制重点实验室,杂粮种质资源发掘与遗传改良山西省重点实验室,山西 太原 030031)
“以曲酿酒”是我国白酒酿造工艺的典型特征。在长期生产实践中,酒曲也发展出不同的类型,诸如大曲、小曲、红曲、麦曲和麸曲[1]。其中,大曲为多数名优白酒生产所必需。大曲以小麦、大麦和豌豆为原料,根据发酵过程中顶温的不同,又可分为高温、中温和低温大曲[2]。在酿酒过程中大曲功能与作用主要体现在3 个方面:首先,提供微生物菌群作为白酒发酵原动力;其次,为白酒酿造提供酶和风味物质,作为曲香和酿造香的来源;最后,为白酒酿造提供原料,起到投粮的作用[2-4]。由此可见,大曲是影响白酒品质的关键因素之一。然而,大曲的工业生产仍面临诸多问题,如制曲操作机械化程度较低、大曲发酵不稳定以及同批次间和不同批次间大曲砖的品质均存在差异等。在生产中保证大曲质量稳定完全依靠经验以及简单理化指标对发酵过程进行控制[3],仍然缺乏相应的科学理论作为指导。
从传统大曲生产过程来看,其特点是生料制曲、开放式培养、自然接种以及多种微生物发酵[5]。这些特点决定了大曲发酵是一个极其复杂的过程,包含了一系列微生物群落演替、相互作用及与之关联的生化反应。因此,在大曲发酵过程中,蕴含了诸多涉及微生物群落及功能的基础科学问题。只有回答好这些科学问题才能加深对大曲发酵过程的客观认识,提出理性调控策略指导生产。
以“大曲”作为关键词,在Web of Science(https://www.webofscience.com)和中国知网数据库对近10 年已发表文献检索,并利用citespace软件进行计量分析,发现近10 年大曲越来越受到关注,论文发表数量逐年上升。在2021年论文发表数量为107 篇,截止至2022年9月已发表论文68 篇,其中包含SCI论文和中国核心期刊发表论文(图1A)。大曲相关研究发表论文最多的是我国学者及研究机构(图1B)。分别对近10 年已发表SCI论文和中国知网收录论文进行关键词共现图谱分析,发现微生物多样性、细菌群落、真菌群落、高通量测序、芳香化合物、风味成分、环境条件、理化指标、筛选分离、酶活力等关键词高频出现(图1C、D)。这一结果表明微生物群落及其在大曲发酵中的功能是研究热点之一。

图1 近10 年(2013.1.1—2022.10.1)大曲相关研究文献计量分析Fig.1 Bibliometric analysis of Daqu research in last decade (January 1st,2013–October 1st 2022)
本文对近期大曲发酵过程中微生物群落及其功能相关研究进行综述,介绍大曲微生物群落的组成、形成机制、演替规律及驱动因子,阐述大曲中的功能微生物、功能酶及二者与风味物质形成的关系,并对大曲微生物群落相关研究进行展望,以期为进一步揭示大曲发酵机制提供参考。
1 不同类型大曲微生物群落结构组成
大曲为酒醅发酵提供了微生物和相关酶,同时也是白酒风味及其前体物质的载体,其“菌、酶、风味”的多样性和丰富度决定了白酒的风格[1,6]。因此,解析生产用曲中微生物群落结构对于进一步揭示微生物群落与风味物质形成的关系、加深白酒发酵机制的理解至关重要。根据发酵过程中大曲达到的最高温度(顶温),可将其分为高温(顶温60~70 ℃)、中温(顶温50~60 ℃)和低温(顶温45~50 ℃)大曲[7-9],分别应用于酱香、浓香、清香型白酒的生产[10]。因原料和发酵工艺的差异,3 种不同类型大曲中优势微生物和微生物群落结构均不尽相同,其优势微生物如表1所示。
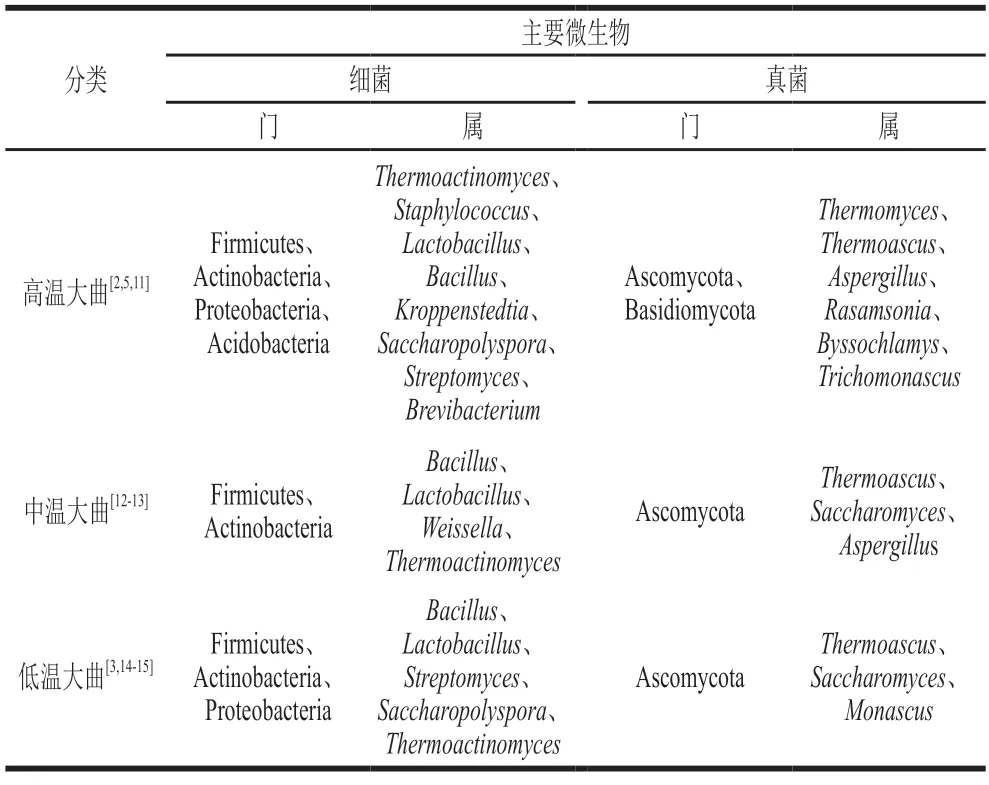
表1 3 种类型大曲优势微生物比较分析Table 1 Comparative analysis of dominant microorganisms in three types of Daqu
高温大曲以小麦为原料,制曲过程中发酵顶温为60~70 ℃[16],是酿造酱香型白酒的主要用曲。高温大曲细菌群落主要由嗜热微生物组成,厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、变形菌门(Proteobacteria)和酸杆菌门(Acidobacteria)是高温大曲中的优势细菌门[2],子囊菌门(Ascomycota)和担子菌门(Basidiomycota)在真菌群落中占优势[11]。在酱香型高温大曲制曲过程中,由于大曲处于曲房不同位置,温度和水分含量等参数变化不同步,最终形成白色、黑色、黄色和红色4 种不同类型的大曲[17]。在不同颜色大曲中,克罗彭斯特菌属(Kroppenstedtia)、芽孢杆菌属(Bacillus)和嗜热真菌属(Thermoactinomyces)均为优势菌属;黑曲和红曲中糖多孢菌属(Saccharopolymonas)和嗜热真菌属(Thermomyces)为优势菌属;散囊菌目(Eurotiales)是黄曲中的优势类群。功能预测分析表明白曲和黄曲中编码细菌酶的基因丰度更高,这些基因的高表达与克罗彭斯特菌属(Kroppenstedtia)密切相关;黑曲中编码真菌酶基因丰度最高,这些基因与嗜热真菌属(Thermomyces)相关[2,5]。
中温大曲是酿造浓香型白酒的主要用曲[18]。中温大曲中最常见的真菌是丝状霉菌(Filamentous molds)和酵母菌,包括曲霉属(Aspergillus)、根霉属(Rhizopus)、支链霉菌属(Amylomyces)、红曲霉属(Monascus)、脱胞菌属(Absidia)、根毛霉属(Rhizomucor)和毛霉属(Mucor),酵母菌包括酵母菌属(Saccharomycopsis)、伊萨氏菌属(Issatchenkia)、酵母属(Saccharomyces)、毕赤酵母属(Pichia)、念珠菌属(Candida)和红酵母属(Rhodotorula)。大曲微生物群落中的优势细菌属包括芽孢杆菌属(Bacillus)、乳杆菌属(Lactobacillus)、明串珠菌属(Leuconostoc)、链霉菌属(Streptomyces)和醋杆菌属(Acetobacter)[12-13]。
低温大曲是清香型白酒的糖化发酵剂。其中细菌与真菌相对丰度比在4∶1以上。其中厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)和变形菌门(Proteobacteria)是优势细菌门,而芽孢杆菌属(Bacillus)、链霉菌属(Streptomyces)、糖多孢菌属(Saccharopolyspora)、乳杆菌属(Lactobacillus)和嗜热放线菌属(Thermoactinomyces)是优势细菌属。子囊菌门(Ascomycota)是优势真菌门,而酵母菌属(Saccharomycopsis)、嗜热子囊菌属(Thermoascus)和红曲霉属(Monascus)是优势真菌属[14]。根据不同制曲工艺可生产出3 种感官和理化性质截然不同的低温大曲,分别为红心曲(顶温(47±1)℃)、后火曲(顶温:(49±1)℃)和清茬曲(顶温:(45±1)℃)[19-20]。在清香型白酒酿造中,红心、后火和清茬曲一般以质量比3∶4∶3的比例混合后投入生产中使用[21]。在属水平,3 种低温大曲各自独有的优势微生物数量众多,而这些微生物能够作为区分不同类型低温大曲的潜在生物标志物。清茬曲中显著富集的细菌主要属于放线菌纲(Actinomycetia)和假诺卡氏菌目(Pseudonocardiales),优势菌属为糖多孢菌属(Saccharopolyspora),优势真菌主要是隶属于子囊菌门(Ascomycota)的嗜热子囊菌属(Thermoascus)。后火曲中显著富集的细菌是厚壁菌门的芽孢杆菌属(Bacillus)和梭状芽孢杆菌属(Clostridia),显著富集的真菌主要属于担子菌门(Basidiomycota)和毛霉菌门(Mucoromycota)。红心曲中显著富集的细菌主要属于链霉菌科(Streptomycetaceae)、乳杆菌目(Lactobacillales)和变形杆菌门(Proteobacteria)(尤其是肠杆菌科(Enterobacteriaceae)),显著富集的真菌属于酵母目(Saccharomycetes)[14-15]。
厚壁菌门(Firmicutes)中的芽孢杆菌属(Bacillus)、乳杆菌属(Lactobacillus)以及放线菌门(Actinobacteria)的嗜热放线菌属(Thermoactinomyces)在3 种大曲中均为显著富集的优势细菌,而子囊菌门(Ascomycota)中的酵母菌属(Saccharomyces)和嗜热子囊菌属(Thermoascus)是3 种大曲中共有的优势真菌。高温大曲中独有的优势微生物有葡萄球菌(Staphylococcus)、克罗彭斯特菌属(Kroppenstedtia)和嗜热真菌属(Thermomyces)。其中,葡萄球菌(Staphylococcus)的存在可能与高温大曲加工环境,尤其是女工赤脚踩制这一特殊工艺有关[2];此外,高温大曲发酵过程中60~70 ℃的顶温使得大部分微生物无法生长与繁殖,而只有耐高温的微生物能够显著富集,如嗜热真菌属。中温大曲中丝状霉菌为优势微生物,如曲霉属(Aspergillus)和根霉属(Rhizopus)。低温大曲中适应中低温环境的微生物占据优势,如细菌放线菌纲(Actinomycetia)和假诺卡氏菌目(Pseudonocardiales)等。总之,不同类型大曲中优势微生物不同,这是形成我国白酒香型种类丰富的原因之一。
2 大曲中微生物群落溯源及演替规律
由于大曲制曲是自然接种和开放式培养,因此原料和环境是其微生物来源。在这种生产模式下,追溯大曲微生物具体来源及解析微生物群落动态演替规律能够为调控大曲发酵提供理性指导。对中温大曲微生物来源进行研究,发现真菌群落诸如扣囊覆膜酵母(Saccharomycopsis fibuligera)、库德里阿兹威毕赤酵母(Pichia kudriavzevii)、米根霉(Rhizopus oryzae)、嗜盐梗孢酵母(Sterigmatomyces elviae)、黄曲霉/米曲霉(Aspergillus flavus/oryzae)、伯顿斯孢毕赤酵母(Hyphopichia burtonii)、伞状毛霉菌(Lichtheimia corymbifera)等主要来源于制曲环境,包括工具和室内地面[22]。大多数细菌群落主要来源于原料,包括α变形菌纲(Alphaproteobacteria)、γ变形菌纲(Gammaproteobacteria)和芽孢杆菌属(Bacilli)[22]。在大曲发酵过程中,不利于白酒发酵的α变形菌纲和γ变形菌纲相对丰度下降,而具有发酵功能的酵母菌和芽孢杆菌相对丰度增加[22]。在高温大曲微生物群落来源的研究中,同样也发现原料小麦是大曲菌群的重要来源[23]。
在大曲发酵开始时,由原料或环境中引入大曲的微生物群落会在发酵过程中被另一个微生物群落所代替,这种时时刻刻发生在大曲中的现象叫做微生物群落演替[13]。高温大曲制曲过程可分为6 个关键阶段,分别为入房堆曲、第一次翻曲、第二次翻曲、干火、后火和出房阶段,不同的发酵阶段优势微生物不同。在高温大曲制曲初期,优势细菌为乳杆菌属和魏斯氏菌属(Weissella);随着大曲发酵温度升高,无色杆菌属(Achromobacter)、寡养单孢菌属(Stenotrophomonas)、代尔夫特菌属(Delftia)在第一次翻曲、第二次翻曲和干火阶段成为优势细菌;出房阶段发酵温度下降,糖多孢菌(Saccharopolyspora)、嗜热放线菌属(Thermoactinomyces)、岩石芽孢杆菌属(Scopulibacillus)、克罗彭斯特菌属(Kroppenstedtia)和芽孢杆菌属(Bacillus)的相对丰度上升。威克汉姆酵母属(Wickerhamomyces)是初始生产阶段的主要优势真菌,但随着发酵温度的升高而消亡。此外,复膜孢酵母属(Saccharomycopsis)和嗜热子囊菌(Thermoascus)由于能够适应高温,其相对丰度逐渐增加,并且嗜热子囊菌在干火期、后火期和出房期大曲中逐渐积累,到出房期,嗜热真菌属(Thermomyces)和嗜热子囊菌成为优势真菌[24]。浓香型中温大曲中细菌和真菌均具有明显的时间演替规律,根据发酵过程中不同阶段微生物群落的相似性,将整个发酵过程分为两个阶段:P1期(发酵第1~6天)和P2期(发酵第7~28天),P1期和P2期的微生物群落具有显著的差异。P1期相对丰度较高的微生物属为魏斯氏菌属(Weissella)、芽孢杆菌属(Bacillus)、乳酸杆菌属(Lactobacillus)和嗜热放线菌属(Thermoactinomyces)。P2期魏斯氏菌属(Weissella)和芽孢杆菌属(Bacillus)相对丰度有所下降,嗜热放线菌属(Thermoactinomyces)、糖多孢菌属(Saccharopolyspora)、芽孢杆菌属(Bacillus)和嗜热子囊菌属(Thermoascus)的相对丰度上升。并且,P1期的优势真菌较多,而P2期时仅嗜热子囊菌占绝对优势[13]。另一项针对中温大曲的研究中观察到相似情况,在粉碎原料压制成曲块时,其中仅白粉病菌(Blumeria)相对丰度较高,与原料中的微生物群落组成相似,此时环境微生物还未进入大曲中生长繁殖。在移入曲房培菌期间,由于曲房环境适宜,大曲中真菌丰富度和多样性急剧增加,此时伊萨酵母属(Issatchenkia)、嗜热子囊菌属(Thermoascus)、根霉属(Rhizopus)、根毛霉属(Rhizomucor)相对丰度升高,魏斯氏菌属(Weissella)和乳酸杆菌属(Lactobacillus)等细菌的相对丰度也有所升高。培菌期结束进入贮藏期后,微生物的种类有所下降,最终趋于稳定[25]。此外,还有研究发现发酵开始前,中温大曲中一些细菌和链霉菌(Streptomyces)相对丰度较高。发酵前4 d,大多数细菌类群和几种真菌类群快速繁殖,大曲发酵第4~12天温度不断升高导致大多数微生物生长受到抑制,而耐热类群,包括芽孢杆菌属(Bacillus)、魏斯氏菌属(Weissella)、高温放线菌属(Thermoactinomyces)、嗜热子囊菌属(Thermoascus)和嗜热真菌属(Thermomyces),能够存活并继续繁殖。通过将中温大曲放置在37 ℃培养箱中降低大曲品温,可以降低微生物群落中耐热类群的相对丰度[12]。
通过上述研究发现大曲在制曲过程中微生物群落总体呈现如下演替规律:发酵开始时,来自原料、环境和工具的微生物会进入到大曲并分解利用原料中的大分子物质,此时相对丰度较高的微生物属为芽孢杆菌(Bacillus)、魏斯氏菌(Weissella)与一些霉菌如根霉属(Rhizopus)、根毛霉属(Rhizomucor)等糖化菌;发酵过程中温度不断升高,无法适应高温环境的微生物的丰度会逐渐下降,能够耐受高温的微生物在发酵中期占据优势,如嗜热放线菌属(Thermoactinomyces)、嗜热子囊菌属(Thermoascus)、嗜热真菌属(Thermomyces)等;发酵结束进入贮曲阶段后,微生物的组成逐渐趋于稳定。
3 大曲微生物群落演替驱动因子
大曲微生物群落演替的发生是微生物适应特定环境条件的结果,根据生态位理论,微生物群落会受到生物和非生物驱动因子的共同影响[26]。大曲中微生物之间相互作用是影响微生物群落结构和推动其演替的主要生物驱动因子[27]。如乳酸菌是大曲发酵过程中的优势微生物,其利用原料产生乳酸等有机酸,导致大曲pH值降低,抑制了其他不耐酸微生物尤其是梭状芽孢杆菌和产甲烷菌的生长[14]。此外,有研究表明乳酸菌可产生乳酸链球菌素、乳酸菌素等抗生素和细菌素来拮抗芽孢杆菌及其他革兰氏阳性菌[28]。能够适应高温和低湿度环境的酵母菌在大曲整个发酵过程中占主导地位[29],而毕赤酵母会强烈地抑制对酒精发酵产生不利影响的芽孢杆菌和丝状真菌的生长[30]。在低温大曲中显著富集的优势真菌根霉属(Rhizopus)具有很强的淀粉酶生产能力,可以将原料中淀粉直接降解为酵母菌可利用的还原糖,因此,根霉属(Rhizopus)真菌可以刺激酵母的生长[31]。大曲微生物群落演替除了受微生物类群间相互作用驱动外,环境理化因子是主要非生物驱动因子,也是可以人为控制的因素。加深环境理化驱动因子对大曲发酵影响的认识对提出更科学的大曲发酵调控策略具有重要意义。温度、湿度、pH值和酸度等因素是大曲微生物群落演替主要环境理化驱动因子[32-35]。酸度、水分和温度是中温大曲中细菌群落演替的环境驱动因子,真菌群落演替主要由水分驱动[13]。进一步对中温大曲发酵过程环境变化与微生物群落间相关性进行分析,发现大曲微生物群落演替驱动因子会随着发酵时间的推移发生变化。在发酵前12 d,温度升高与微生物群落快速演替显著相关,而发酵12 d后温度变化和微生物群落演替并无显著相关性。大曲发酵时内部产生的生物热是大曲微生物群落演替不可忽视的驱动因子之一。在发酵前4 d,曲砖内伴随着微生物快速繁殖产生生物热。然后,生物热作为主要内源性驱动因子在第4~12天促进微生物群落演替。人为降低大曲砖中生物热降低了耐热类微生物的相对丰度,包括芽孢杆菌属(Bacillus)、嗜热放线菌属(Thermoactinomyces)和嗜热子囊菌属(Thermoascus)[12]。对产自青海的低温大曲研究发现,水分和温度显著影响核心真菌群,其中水分是根霉属(Rhizopus)、毕赤酵母属(Pichia)、异常维克汉逊酵母属(Wickerhamomyces)、酵母菌属(Saccharomycopsis)和曲霉属(Aspergillus)演替的驱动因子,而温度是酵母属(Saccharomyces)演替的驱动因子[36]。
4 贮曲过程中大曲微生物群落及理化指标的变化
大曲发酵过程为大曲品质奠定了基础,但刚发酵完成的大曲并不能直接投入酿酒生产,成熟的大曲通常存放在通风良好的开放式房间一段时间,这一过程称为贮曲[37]。在低温大曲贮曲阶段,微生物菌群会随着外部环境如水分和温度等的变化而不断变化。贮曲前,细菌群落中以泛菌属(Pantoea)为主,真菌群落复膜孢酵母菌属(Saccharomycopsis)、未被分类的发菌科(Trichocomaceae_unclassifified)和毕赤酵母属(Pichia)的相对丰度较高。在之后的贮曲过程中,乳杆菌属(Lactobacillus)和魏斯氏菌属(Weissella)在贮曲前2 个月内逐渐成为优势细菌属;真菌群落中,复膜孢酵孢母菌属(Saccharomycopsis)、未被分类的发菌科(Trichocomaceae_unclassifified)和毕赤酵母属(Pichia)的相对丰度较高,随着贮曲的进行,未被分类的发菌科(Trichocomaceae_unclassifified)相对丰度降低,最终在贮曲2 个月后形成以未被分类的发菌科(Trichocomaceae_unclassifified),复膜孢酵母菌属(Saccharomycopsis)、毕赤酵母属(Pichia)、Tremellales_unclassifified为主的真菌群落结构。上述研究结果表明,发酵后大曲中的微生物依然保持活跃,而贮曲可以促进复杂的微生物群落结构达到平衡并趋于稳定,这对于酒醅发酵和白酒质量至关重要[38]。活跃的微生物群落亦能导致曲砖内酶和代谢物含量不断变化[38],研究发现贮曲过程中微生物菌群与大曲理化性质及风味成分之间显著相关,通过贮曲能够去除令人不快的挥发性成分,稳定大曲风味结构[39]。随着大曲贮藏期的延长,其理化性质和酶学指标均有不同程度的变化:机械压制大曲和人工压制大曲在贮藏过程中水分含量和淀粉含量均呈现平缓下降趋势,酸度呈持续的增高趋势,同时,机械压制大曲糖化力、液化力、发酵活性、酯化力均持续下降;而人工压制大曲除发酵活性在贮曲7 个月之内呈显著的增高趋势之外,其余酶学指标均呈下降趋势[4]。机械压制生产的中温大曲有效贮藏时间为1~5 个月,石磨和人工压制中温大曲最长能贮存4 个月。人工压制生产的中温大曲在贮藏期第5个月(第210天)淀粉含量低于QB/T 4259—2011《浓香大曲》的规定(50.0~65.0 g/100 g)。这可能是由于毛霉菌属(Mucoromycota)和芽孢杆菌属(Bacillus)分别在贮曲第3个月和第4个月后相对丰度显著上升,而芽孢杆菌属和毛霉菌属作为重要的糖化菌能将淀粉分解成小分子寡糖和单糖,导致淀粉含量降低[40]。乳酸菌在中温大曲贮曲的整个过程占据优势;醋酸杆菌属(Acetobacter)在中温大曲贮曲后期相对丰度较高,并且可将乙醇氧化成乙酸[41]。因此,机械压制中温大曲和人工压制中温大曲在整个贮藏期间酸度持续升高,并在贮藏第6 个月(第240天)超过QB/T 4259—2011规定的标准值(0.3~1.5 mmol/10 g)[38,40]。综上所述,贮藏期应不超出一定的时间范围,以免大曲变质造成粮食浪费。
5 大曲微生物功能研究进展
制曲过程中纷繁复杂的微生物不断演替更迭,并发挥着各自的功能。研究表明,大曲发酵体系中主要集成了酵母菌、霉菌和细菌三大微生物模块[42-43]。
酵母菌是一种在大曲中显著富集的优势真菌,可以提高大曲中淀粉糖化力、酸性蛋白酶活性以及乙醇合成速率[44],从而影响白酒的风味和品质。同时,芳香化合物是一类对白酒整体风味贡献最大的关键香气化合物,而酵母菌作为白酒主要产香菌之一,其相对丰度与芳香族化合物的积累量呈显著正相关[45],如乙酸乙酯和丁酸乙酯等挥发性香气化合物已经被证实由酵母菌产生[44]。目前,研究表明在种水平上显著富集的扣囊复膜酵母(Saccharomycopsis fibuligera)被认为是最好的产酯和产淀粉酶的酵母菌[43,46]。
霉菌可以分泌多种水解酶,如糖化酶、蛋白酶、脂肪酶和淀粉酶,降解原料中的大分子物质,如淀粉和蛋白质,增加整个反应体系中糖和氨基酸的含量[47],这不仅为其他微生物的生长和繁殖提供了营养物质,并且极大地促进了白酒风味化合物的合成。如高温大曲中曲霉属(Aspergillus)和链孢菌属(Alternaria)作为小麦源真菌属微生物在大曲发酵早期阶段参与糖异生I、蔗糖降解III、磷酸戊糖途径、5-氨基咪唑核糖核苷酸合成I、甲基酮合成和鸟苷二磷酸-甘露糖生物合成等多种代谢途径,这可能对大曲中风味物质的形成和菌群演替发挥重要作用[48]。其中,曲霉属可产生酸性或碱性蛋白酶等大量胞外酶,产生酯类和芳烃类等多种次级代谢物[49]。中温大曲中毛霉(Mucorales)和散囊菌目(Eurotiales)是潜在优势菌群,负责大曲中相关降解酶的分泌和风味前体化合物的产生,丝衣霉属(Trichoderma)和曲霉属(Aspergillus)分别参与愈创木酚和4-乙烯基愈创木酚的生物合成[50]。
细菌在大曲发酵过程中同样发挥至关重要的作用。首先,细菌为发酵提供酸性环境。中温大曲发酵早期出现的酸性热环境主要是由乳酸杆菌和横梗霉属(Lichtheimia)的分解代谢活动造成的,这可能有助于微生物群落的有效自我驯化[50];其次,产生蛋白酶、果胶酶、脂肪酶、糖化酶和纤维素酶等酶类,并参与多种代谢途径。高温大曲中鉴定出的乳酸杆菌目(Lactobacillales)可产生丰富的酯酶和脂肪酶,与大曲主要风味物质产生密切相关,也是甲酯和乙酯类化合物主要产生菌[51]。吡嗪类化合物主要由芽孢杆菌和曲霉产生,芽孢杆菌还赋予大曲特有的发酵大豆的香气[52]。中温大曲中魏斯氏菌属(Weissella)、乳酸杆菌属(Lactobacillus)和葡萄球菌属(Staphylococcus)等细菌参与了2,3-丁二醇代谢,高温放线菌(Thermoactinomyces)属参与了丁酸代谢[50]。在低温大曲发酵过程中细菌发挥20 种不同的功能,并可以将其分为3 类:代谢、信息存储和处理以及细胞过程与信号传导。与代谢相关的功能表现出最高丰度,主要包括氨基酸转运和代谢、碳水化合物转运和代谢、转录、能量产生和转化、翻译等。在此基础上,低温大曲中的细菌能够促进或抑制风味物质的积累[14,53],例如乳酸菌可以利用原料中的糖类产生乳酸和其他化合物,因此其相对丰度与酸味、鲜味和涩味显著相关。乳酸菌产生的乳酸是乳酸乙酯的前体化合物,而乳酸乙酯是清香型白酒中重要的风味物质,可增强白酒的醇厚风味和甜味,并能降低乙醇对感官的影响,延长回味[14,54-56]。芽孢杆菌相对丰度与对白酒风味最关键的两个指标(苦味和酸味)呈负相关,它可以抑制苦味的产生以及平衡风味。因此,富含芽孢杆菌的后火曲在生产中可用于调节清香型白酒的苦味和酸味。嗜热子囊菌相对丰度与含硫有机化合物的产生呈显著负相关,含硫有机化合物是各种发酵食品和酒精饮料中的重要风味物质,具有低检测阈值和强感官特性[57]。白酒中的含硫有机化合物通常会产生一种令人不快的香气,类似于洋葱和煮熟白菜散发出的气味[56]。嗜热子囊菌产生丰富的水解酶,其具有高热稳定性和活力,可有效抑制含硫有机化合物的生成,防止不良气味的产生[14]。
大曲是白酒酿造的糖化发酵剂,亦是白酒香气来源之一,以上研究表明这些功能的发挥依赖于微生物分泌的各种酶类[58]。针对大曲中酶种类和功能的研究,传统方法主要通过测定大曲中酶的活力、催化底物以及产物鉴定[59]。近年来,利用宏基因组学、宏蛋白质组学、代谢组学等技术,鉴定出了大曲中复杂的酶系统,根据CAZy数据库被注释为6 类:糖苷水解酶(glycoside hydrolases,GH)、糖基转移酶(glycosyltransferases,GT)、碳水化合物结合模块(carbohydrate-binding module,CBM)、碳水化合物酯酶(carbohydrate esterases,CE)、辅助模块酶(auxiliary activities,AA)和多糖裂解酶(polysaccharide lyases,PL)。它们可以组装或降解自然界广泛存在的碳水化合物,例如用于能量储存的淀粉,用于结构维持的纤维素、糖复合物。在大曲中,GT和GH的相对丰度最高,PL最低[53]。GHs是一组重要的水解糖苷键的酶,与淀粉液化、糖化和纤维素降解有关[60]。GT与寡糖和多糖的生物合成有关,表明大曲中含有能合成多糖的微生物。与酿造黄酒用的麦曲相比,大曲具有较高的蛋白酶和纤维素酶活性、较低的葡萄糖淀粉酶和淀粉酶活性[53]。酱香型高温大曲中的优势微生物巨大芽孢杆菌(Bacillus megaterium)分泌的纤维素酶可水解大曲和高粱纤维素中的β-1,4-糖苷键,生成其他微生物可利用的纤维二糖和葡萄糖,有利于制曲过程中微生物的生长和富集。纺锤形赖氨酸芽孢杆菌(Lysinibacillus fusiformis)可产生蛋白酶和氨基酸酶,水解大曲中的蛋白质不仅可为微生物提供营养物质,其形成的氨基酸还可与葡萄糖发生美拉德反应,为白酒香气提供前体物质。葡萄球菌(Staphylococcus)代谢可产生水解长链脂肪酸和甘油的脂肪酶并生成游离脂肪酸和甘油,这构成了白酒中的香味物质或香味前体物质[61]。
6 结语
目前对于大曲发酵过程及生产用曲中微生物群落结构及功能有了较为清晰的认识,但是生产中大曲发酵是否正常、成曲质量等的评价主要还是依赖于感官经验和简单理化指标。对于大曲发酵的内在机制并没有完全清楚,针对这一问题的研究依然存在挑战。首先,当前关于大曲微生物群落的研究多采用不依赖于分离培养的高通量测序技术,包括扩增子测序和宏基因组测序。不管是利用哪种方法,数据均反映的是样本中全部微生物的信息,并不能区分活的和已经死亡的微生物。而根据这些数据得出的结果与真实情况相比会产生滞后效应,阻碍对微生物功能及大曲发酵机制的理解。因此,大曲发酵过程中活微生物群落实时动态变化应该被更多的关注,而培养组学技术[62]、宏转录组学技术[63]、基于叠氮溴化丙锭处理的扩增子测序技术[64]都是有力的研究手段。其次,关于影响大曲发酵过程中微生物群落演替的推动因子,先前研究报道主要关注点在理化因子,诸如温度、湿度、水分含量、酸度等。其中,温度是影响大曲发酵最重要的因素之一,生产中通过调节环境温度调控大曲发酵中微生物群落的生长繁殖。然而,值得注意的是,温度在影响微生物群落演替过程中既是因也是果。大曲发酵过程中,观测温度可以分为曲房环境温度和大曲曲砖内部温度。环境温度作为外部可控因素是大曲温度和微生物群落变化的因;但是大曲温度不止受到环境温度的影响,微生物代谢活动产生的生物热对大曲温度也产生巨大且显著的影响,此时大曲内部温度是生物热引起的结果。而关于微生物群落对生物热的贡献以及生物热反向对大曲发酵及微生物群落演替的影响目前还知之甚少。此外,除了理化因子,大曲中含量和种类不断变化的营养物质亦是推动大曲微生物群落演替及发酵进程的重要因素,而相关研究报道较少。魏军林等[65]针对营养相互作用对传统发酵食品微生物群落构建的推动作用进行了综述,提出深入解析传统发酵食品中营养相互作用对微生物群落构建的影响有助于更全面地认识其发酵机制,为制定理性调控策略提供了依据。第三,关于微生物群落互作研究主要还是基于测序数据的统计分析及预测,或者是两种微生物群落间的体外互作分析,对于两种以上更为复杂的高阶微生物互作研究开展较少,解析大曲内活微生物群落间互作机制更是研究难点。面对这些挑战,整合宏基因组学、宏转录组学、宏蛋白质组学、代谢组学、培养组学等技术手段,多组学技术联用将能够深入大曲发酵机制研究[66]。实际上,这些挑战也是大多数传统发酵食品发酵机制研究所要面对的,深入解析上述科学问题将有助于进一步揭示包括大曲在内传统发酵食品的发酵机制,助力其发酵过程控制与高效生产。

