异种脱细胞膀胱黏膜下层支架的制备
肖 峰
(贵州省贵阳市第六医院泌尿外科,贵州 贵阳 550006)
各种先天性和获得性疾病如癌症、创伤、结核等往往导致膀胱组织发生严重的病理性缺损[1]。临床上,膀胱缺损患者常采用手术切除联合胃肠道替换的方法重建膀胱,以维持患者储水排尿的生理需求[2]。虽然从短期来看,能够修复膀胱缺损,但是这些方法受到机械、结构、功能或生物兼容性问题的限制,并不能满足临床需求。近些年来,随着组织工程技术的发展,为完全修复膀胱缺损提供了可能的新方法。一般来说,组织工程通常包括三个基本要素:种子细胞、生物支架和生长因子。膀胱支架的理想材料应具备良好的生物相容性、机械性以及生物安全性等特点[3-4]。目前,通过一系列物理化学手段去除异体组织中的细胞成分得到的脱细胞基质材料,因其具备完整的细胞外支架结构,免疫原性低,并且含有的胶原和弹性纤维等利于细胞的黏附生长与增殖等特点使其成为一种理想的生物支架材料[5-6]。因此,异种脱细胞基质已经成为组织工程技术修复膀胱损伤的重点研究对象。本研究通过不同浓度的叠氮钠溶液对猪膀胱进行预处理,利用低渗-液氮反复冻融-NaOH溶解法等一系列程序对叠氮钠溶液处理过的猪膀胱进一步脱细胞处理,获得猪膀胱脱细胞基质(bladder acellular matrix graft,BAMG),即异种脱细胞膀胱黏膜下层支架。随后通过组织学检测、DNA残留实验、细胞毒性实验、细胞黏附实验、以及皮下植入实验等方法进一步验证制备的BAMG的生物安全性,为其临床应用奠定一定的理论基础。报告如下。
1 材料与方法
1.1实验动物与细胞 健康猪膀胱由黔康肉食品经营有限公司提供,取材3 h内进行脱细胞处理。SPF级7~8周的SD大鼠(雌)购自北京华阜康生物科技有限公司,体重210~230 g。动物饲养于屏障环境中的独立通气笼盒内,适应性饲养1周后用于实验。饲养密度不超过6只/笼,环境温度控制在22~26 ℃,相对湿度40%~60%,笼具、垫料、饮用水和标准饲料均经灭菌处理,小鼠自由活动及进食。人源膀胱平滑肌细胞培养于DMEM完全培养基(含体积分数20%胎牛血清),由本院病理研究室提供。
所有动物实验均通过贵阳市第六医院伦理委员会批准通过(许可证号:202109122)。
1.2主要试剂 叠氮钠由翌圣生物科技(上海)股份有限公司提供。无菌磷酸盐缓冲盐水(phosphate buffer saline,PBS),苏木素伊红(hematoxylin-eosin,HE)染色试剂盒以及Hoechst 33258染色液均由Solarbio公司提供,货号P1020,G1120和C0021。四唑盐(methyl thiazolyltetrazolium,MTT)比色法试剂盒由Sigma公司提供,货号:CT01-5。胎牛血清由Hyclone公司提供,货号:SH30070.031。DMEM高糖培养基由博士德生物工程有限公司提供,货号:PYG0070。人源膀胱平滑肌细胞购自武汉普诺赛生命科技有限公司,货号:CP-H069。青霉素-链霉素溶液(含100 U/mL青霉素、100 g/L链霉素),两性霉素B溶液(250 mg/L)均购自武汉普诺赛生命科技有限公司,货号:PB180120,PB180127。DNase和RNase均购自上海碧云天生物科技有限公司,货号:R0127。MagMAX-96 DNA多样品试剂盒购自赛默飞公司,货号:4413021。
1.3构建猪BAMG ①将得到的猪膀胱,用含抗生素(100 U/mL青霉素、100 g/L链霉素)和抗真菌药物(2.5 mg/L两性霉素B)的PBS缓冲液冲洗。②将洗净的猪膀胱分别置于浓度为0.1 g/L、0.2 g/L、0.3 g/L、0.5 g/L、0.7 g/L、1g/L叠氮钠溶液中浸泡共2 h。③用薄玻片刮去膀胱黏膜层浸入蒸馏水中6 h,每2 h换液1次。④-80 ℃条件下反复冻融3次,60 min/次。⑤加入40 U/mL DNase和RNase混合液,37 ℃,静置2 h。⑥浸入4% NaOH溶液,4 ℃,静置24 h,每6 h换液1次。⑦PBS缓冲液震荡漂洗5次,30 min/次。⑧置于冷冻干燥机中冻干,60CO消毒,4 ℃保存备用。
1.4组织学检测细胞残留 猪膀胱经脱细胞处理后,用10%多聚甲醛固定,石蜡包埋,切片(5 μm),HE染色,封片,光镜观察。
1.5紫外分光光度法检测BAMG中的DNA含量 取合适大小BAMG(10 mg),随后利用MagMAX-96 DNA多样品试剂盒提取BAMG中总DNA含量,并用紫外分光光度计进行检测。
1.6MTT比色法检测BAMG的体外生物相容性 将4 cm2的BAMG浸泡在1 mL含10%胎牛血清的DMEM中,37 ℃,静置24 h,即可得到获得BAMG的浸提液。随后,将人源膀胱平滑肌细胞悬液接种于96孔板内,待细胞贴壁后加入上述浸提液培养细胞,空白对照加入DMEM培养基,于37 ℃、5% CO2孵箱中分别培养细胞12 h、24 h和48 h。然后弃掉培养基,每孔加入等的量MTT试剂。避光培养2 h后,去除MTT试剂并加入200 μL二甲基亚砜。上机测定490 nm处的吸光度。
1.7细胞黏附实验确定BAMG的黏附性 将人平滑肌细胞制备成单细胞悬液,并稀释为1×107个/mL。取200 μL单细胞悬液接种到BAMG表面并在,在含10%胎生牛血清的DMEM培养基中培养。培养1周后,BAMG经培养基冲洗后通过Hoechst 33258染色检测BAMG表面的DNA浓度确定细胞黏附情况。
1.8皮下植入试验观察BAMG与周围组织的相容性 在成年SD大鼠脊柱中线两侧约2 cm处平行各取2点作为皮下注入点。水合氯醛麻醉动物,无菌条件植入BAMG作为实验组,假手术组作为对照组。每天观察皮肤手术切口及动物反应变化。在术后第2周和第4周处死大鼠,切开皮肤仔细观察样品与周围组织的粘连情况并进一步切片作组织学评价。
1.9统计学方法 应用SPSS 20.0统计软件分析数据。计量资料比较采用t检验、单因素方差分析和SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1组织学观察检测脱细胞效率 通过组织学观察检测脱细胞效率,初步发现,经脱细胞处理后,猪膀胱组织中仅可见基质结构和胶原纤维,其中胶原纤维排列整齐,结构完整;并且可见视野内的细胞核数量显著减少,未见明显的细胞残留。表明该方法处理得到的BAMG符合无细胞的要求(图1)。
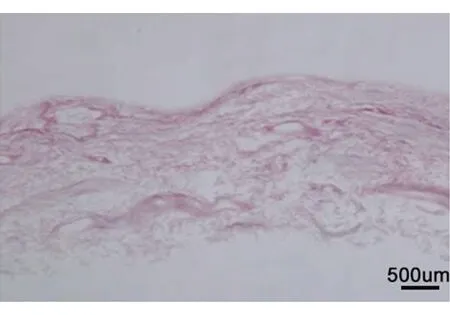
图1 组织学观察脱细胞效率
2.2脱细胞处理对BAMG中DNA含量的影响 利用紫外分光光度法检测经脱细胞处理后BAMG中残留的DNA含量。结果显示,脱细胞处理组的DNA含量显著低于对照组,差异有统计学意义(P<0.05)。见表1。表明,经脱细胞处理能够显著降低BAMG中的DNA含量,即本实验中所采用的制备方法比较成功地实现的脱细胞的目的。
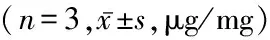
表1 紫外分光光度法检测DNA残留含量
2.3BAMG的体外生物相容性检测 利用MTT法检测经脱细胞处理后BAMG浸提液在不同时间点对人膀胱平滑肌细胞细胞活性的影响。结果显示,2组细胞生长状态良好,随培养时间的延长,细胞数量稳定增长,细胞增殖能力差异无统计学意义(t=0.989,0.636,1.608,1.403,P>0.05)。结果表明,经脱细胞处理的BAMG浸提液对培养的人平滑肌细胞没有显著的细胞毒性,见表2。

表2 BAMG浸提液对人膀胱平滑肌细胞细胞活性的影响
2.4BAMG的细胞黏附能力检测 通过Hoechst 33258染色液确定BAMG表面的DNA含量,间接检测BAMG 的细胞黏附能力。结果显示,与对照组相比,接种细胞后BAMG表面的DNA含量显著增加。这提示人膀胱平滑肌细胞能够黏附在BAMG表面生长,BAMG具有一定的细胞黏附力。上述结果间接阐明了BAMG能够与人平滑肌细胞的紧密黏附(图2)。

图2 组织观察法确定BAMG的细胞黏附情况
2.5BAMG的组织相容性检测 利用透射电子显微镜确定BAMG植入后组织中由中性粒细胞和巨噬细胞组成的炎性细胞。结果显示,BAMG植入后,伤口处未见明显的炎症反应,如水肿、化脓以及发炎等。植入部位未见异常。术后1周取出BAMG,发现其与周围组织轻微粘连,出现轻微的炎性细胞浸润(白色箭头);术后4周取出BAMG,发现其与周围组织黏附,未见炎性细胞浸润(图3)。

图3 透射电子显微镜检测不同时期的炎性细胞( ×100)
3 讨 论
在组织工程学中,支架为种子细胞的生长分化提供了稳定的三维结构。事实上,细胞的生长发育受到支架提供的微环境影响[7]。由于膀胱在充盈和排空过程中会受到不同的机械力,因此需要一个动态支架来提供机械支撑。细胞外基质(extracellular matrices,ECM)是一种天然理想的生物支架材料,其细胞成分和抗原均已去除,尤其是以脱细胞基质为代表的ECM材料已广泛用于各种组织重建应用。脱细胞基质主要由结构蛋白和各种功能分子组成,如胶原蛋白、糖胺聚糖、生长因子、黏附分子和细胞因子[8]。功能上,能够为细胞提供物理支架并调节细胞反应,包括细胞增殖、存活、分化、迁移、稳态和形态发生[9]。其特点是能够保持组织的机械性能和结构蛋白,不需要进行二次工程设计。在众多组织来源的脱细胞基质生物材料中,BAMG无需体外细胞种植即可促进膀胱再生,并可被宿主组织重塑和取代;同时,保留了组织再生所需的生物活性蛋白,包括血管内皮生长因子和胰岛素样生长因子[10-11]。
与任鹏程等[12]报告的脱细胞方法相比,本研究主要采用一系列浓度梯度的叠氮钠溶液对猪膀胱进行脱细胞处理,建立了一种高效快速的制备猪膀胱脱细胞基质的方法。首先将灭菌处理的健康猪膀胱分别浸泡于不同浓度的(浓度为0.1 g/L、0.2 g/L、0.3 g/L、0.5 g/L、0.7 g/L、1 g/L)叠氮钠溶液,充分裂解基质细胞并释放胞内内容物。随后浸入蒸馏水6 h,以达到水解细胞的目的。而液氮冻融法使膀胱组织内的细胞发生肿胀破碎,进一步增强脱细胞效果。此外,DNA酶及RNA酶可以消化处理膀胱基质内的核酸成分。最后,采用NaOH溶解法使细胞脱水坏死、脂肪皂化,彻底去除膀胱组织中的残留细胞膜结构和胞内脂质。总之,将整个制备过程分为6个质量控制环节:叠氮钠裂解细胞、渗透溶液法水解细胞、液氮冻融法破碎细胞、酶消化法去除核酸、NaOH溶解法清除细胞脂质和PBS溶液清洗等步骤。经过上述操作过程实现猪膀胱组织高效的脱细胞处理,获得较理想的BAMG。随后对该方法的脱细胞效率和BAMG的生物安全性评价进行了广泛的研究。
为了鉴定所制备的BAMG是否能作为生物支架材料应用于组织工程膀胱的构建,主要从形态学、细胞相容性及移植后反应等3个方面对制备的BAMG进行了综合评价。首先,通过HE染色确定制备的BAMG的脱细胞效率[13]。HE染色结果显示,脱细胞处理后,胶原纤维排列整齐,结构完整;与对照组相比,可见视野内无细胞核出现,未见明显的细胞残留。另外,供体DNA残留量也是评价脱细胞效率的主要指标之一[14]。初步研究发现,与正常对照组相比,脱细胞处理组能显著降低膀胱组织的DNA含量(P<0.01)。因此,本次建立的脱细胞方法效率高,且经脱细胞处理得到的BAMG符合无细胞的要求。随后,依照医疗器械生物学评价的标准,选择MTT法对细胞增殖率进行测定,了解BAMG的体外生物相容性[15-17]。目前,MTT法在大多数研究中已经成为检测生物材料体外生物相容性的必要手段。本研究结果显示,BAMG的浸提液对人原代膀胱平滑肌细胞的细胞增殖能力无显著影响。最后,通过体内移植实验观察材料与周围组织的相容性[16]。研究发现,该材料具有较低的免疫原性,移植后周围组织炎性症状轻微,并未发生组织坏死及排斥现象,上述结果证明该材料在体内具有较好的生物相容性。
综上所述,利用不同浓度叠氮钠快速制备BAMG的方法,制作过程快速简单,且成本低廉。同时,利用该方法制备的BAMG具有良好的组织相容性,可以作为组织工程膀胱缺损的理想支架,实现重建膀胱的目的。因此,该方法的提出为膀胱缺损修复提供了一种新的思路。

