基于“教—学—评融合”的教学设计与实践研究*
——以“依据化学方程式的计算”为例
陈 欢
(苏州工业园区星湾学校 江苏 苏州 215000)
一、教学主题内容与教学现状分析
学生初中阶段对化学反应的定量认识发展经历如下四个层级:定性水平、定量综合水平、定量比例水平和宏微观贯通比例水平[1]。“依据化学方程式的计算”取自上海教育出版社义务教育化学教材第四章“认识化学变化”第3节的内容,安排在“化学反应中的质量关系”(即质量守恒定律)之后,是学生巩固定性水平、定量水平,并发展定量比例水平和宏微观贯通比例水平的关键组成部分。
初中化学课程标准中对于本节内容知识和方法界定的标准为:认识化学反应中的各物质间存在定量关系;学习利用质量关系、比例关系定量认识化学反应,认识定量研究对化学科学发展的重大作用[2]。以往的文献对于“依据化学方程式的计算”的教学设计主要有:真实的情境创设、可计量的化学计算、真切的学科观念培养[3-7]。但也存在一些不足:问题虽逐次推进但欠缺大问题统领、情境虽真实但欠缺系统性设计、计算研究角度虽多元但欠缺一致性规划。
二、基于“教—学—评融合”理论的教学设计与实践
1.教学目标
结合初中化学课程标准要求和教材内容,依据问题理论学习方式,并考虑学生的认知特点,将本部分内容的教学目标设计为:(1)通过天和核心舱中供氧剂选择问题的研究,初步学会从物质变化、能量变化、条件、现象、反应类型和元素守恒等角度认识化学反应,初步形成化学反应的系统思考能力;(2)通过天和核心舱中氧气供给的定量研究,初步认识化学反应中物质之间的质量关系,进一步理解质量守恒定律,能够根据化学方程式中各物质的相关质量关系正确计算出反应物或生成物的质量;(3)通过研究天和核心舱总废料处理和氧气再生的探究问题,初步学会设计解决物质制备、废料处理等实际问题的思路,初步体会化学反应与工程技术之间的关系,感受我国航空航天领域的巨大成就。
2.教学思路与流程设计
本节课以课程标准、教材和学情为依托明晰知识、技能和情感,并反向寻找实际情境问题——航空航天中宇航员的生存问题,具体模式见图1。
3.教学活动设计
(1)航空航天中宇航员的生存问题
【问题1】2021年10月16日,中国宇航员将进行为期六个月的太空驻留实验,你觉得宇航员要在太空长期生存,需要考虑哪些问题?
【问题2】这些问题归纳起来主要分为三个角度:舱室环境控制、生命保障系统和健康保障系统。其中最为重要的是生命保障系统,在该系统中最为紧要的物质是什么,为什么?
【问题3】假设一名航天员,身高170 cm,体重70 kg,在中等劳动强度下,需要的热量是2 800 kcal/天,这种条件下每天需要吸收约830 g氧气,释放出约950 g二氧化碳。
那如何才能知道产生这么多氧气需要多少供氧剂呢?化学计算的种类很多,本节课重点讨论依据化学方程式的计算。
(2)航空航天中供氧剂的选择
【问题1】我们学习过的产生氧气的方法有很多,请写出对应的化学方程式,并简单讨论哪种方法比较适宜。
【学生讨论】
学生1:制备氧气有分离液态空气法、高锰酸钾制氧气、双氧水制氧气、氯酸钾制氧气、电解水和光合作用;
学生2:需要反应物中含有氧元素;
学生3:高锰酸钾、双氧水、氯酸钾制氧气和电解水都属于分解反应;
学生4:分离液态空气法在太空中不适宜,因为无原料,可以考虑携带液氧,但液氧的保存需要额外创造低温高压的环境,不太现实;
学生5:双氧水制备氧气反应条件简单,生成氧气的同时也产生了水,但双氧水本身不够稳定,太空中环境复杂,存在隐患;
学生6:高锰酸钾和氯酸钾制氧气的反应需要加热,产生的其他产物再利用程度较小;
学生7:光合作用需要光能和植物,植物生成需要一定的生态环境,存在一定困难;
学生8:电解水需要电能,可以利用太阳能发电解决能量问题,产生的氢气可以作为燃料使用,相对而言比较适合。
【教学小结】同学们从物质变化、能量变化、反应条件与现象、反应类型和元素守恒等角度再次定性认识化学反应,并确定使用电解水供氧比较适宜。刚刚大家思考的方向和科学家的研究方向一致,对于航空航天的理解也在逐渐深入。
【问题2】要想产生830 g 的氧气至少需要水的质量为多少?
(3)航空航天中供氧剂的用量
【问题1】你可以从哪些方面对电解水的化学方程式进行解读?
【学生交流】
①从物质变化的角度:水在通电的条件下生成了氢气和氧气。
②从物质构成的角度:水是由水分子构成的,氧气是由氧分子构成的,氢气是由氢分子构成的。化学方程式中水的化学计量数为2,表示微观上2 个水分子;氧气的化学计量数为1,表示1 个氧分子;氢气的化学计量数为2,表示2 个氢分子。微观上可以解读为每2个水分子反应生成1个氧分子和2个氢分子,其中H2O、O2、H2的分子个数之比为2∶1∶2。
【问题2】已知一个水分子的实际质量约为3×10-23g,一个氧分子的实际质量约为5.32×10-23g,一个氢分子的实际质量约为3.32×10-24g,请你算出反应中的分子质量比。
【学生交流】每个分子的实际质量乘以分子的个数,即可算出反应中分子的实际质量比。计算可以获知,反应中每9 份质量的水分子分解产生8 份质量的氧分子和1份质量的氢分子。
【问题3】反应中分子质量之比是否等于参加化学反应的宏观物质质量比,为什么?
【学生交流】两者之间质量比相等,三种物质都是由分子构成的,分子大量聚集形成了物质。参加反应的宏观物质的分子个数比等于化学方程式中解读的分子个数比,使得其质量比仍然相等。
【问题4】除了利用分子的实际质量求算其分子质量比之外,还有其他方法吗?
【学生交流】已知Ar(H)=1和Ar(O)=16,可求得每2个水分子的相对分子质量为36,每个氧分子的相对分子质量为32,每2个氢分子的相对分子质量为4。
因为相对分子质量、相对原子质量都是分子、原子的实际质量与某种碳原子质量的1/12的比值,由于它们是与相同的基准进行比较的,所以相对分子质量乘以化学计量数的比值就等于化学反应中各物质的实际质量之比。
【教学小结】化学方程式是表示化学反应的符号,包含着非常丰富的信息,不仅有宏观和微观的意义,也有定性与定量的意义。而依据化学方程式计算的核心是:化学反应中各物质的质量比例是固定且唯一的。
【问题5】若有36 t水能产生多少氧气和氢气?若产生2 t氢气,需要水的质量是多少,能产生多少氧气?
【问题6】角色扮演:若请你当一回中国空间站的设计师,请计算当航天员每天需要830 g氧气时,至少需要多少水?
【学生练习+板书演示】
解:设需要水的质量为x。
答:需要水的质量为933.75 g。
【问题7】请同学们参照课本107页例题和黑板上的内容,思考如何完善自己的解题过程。
【问题8】请同学们总结依据化学方程式计算的具体解题步骤是什么?
【学生交流】①正确书写化学方程式;
②寻找与计算有关的量,已知物质和待算物质的质量即为相关的量,准确计算两种物质的相对分子质量乘以化学计量数的乘积,把已知物质的质量和待算物质的质量x对应放在上述乘积的下方;
③列比例式;
④利用数学解一元一次方程得出结果;
⑤简明进行作答。
【问题9】产生830 g氧气的时候,又产生了多少克H2?
【教学小结】在化学方程式的计算中,可以根据任意一个量求算出与之相关的其他量。
【问题10】同学们,你还有其他方法计算H2的质量吗?
【学生交流】①质量守恒定律:利用水的质量减去氧气的质量算得氢气的质量。
②化学式计算:利用水的质量求算水中氢元素的质量,进而求得氢气的质量。
【教学小结】定量问题的解决可以利用质量守恒,也可以利用元素守恒。所以,守恒是化学计算的关键。
(4)天和核心舱紧急供氧剂的选择
【问题1】国际空间站还会备有紧急氧气以及紧急供氧剂——烛状高氯酸锂,每支烛状高氯酸锂能产生830 g氧气。已知:LiClO4=△===LiCl+2O2↑
通过计算说明为什么选择使用高氯酸锂(LiClO4)而非高锰酸钾(KMnO4)。[已知:M(rLiClO4)=106,M(rKMnO4)=158]
【学生交流】利用化学方程式算得需要1 374.7 g高氯酸锂,利用化学式算得需要高氯酸锂的质量也是1 374.7 g。
利用化学方程式算得需要8 196.3 g高锰酸钾,利用化学式算得需要高锰酸钾的质量是2 049.1 g。
根据计算结果可知产生相等质量氧气需要携带的高氯酸锂质量更少。
【问题2】为什么不同方法算得的高氯酸锂质量相同,而高锰酸钾质量却不同?
【学生交流】高氯酸锂中所有的氧元素全部转化成氧气,所以两种计算方式结果相同;高锰酸钾中只有部分氧元素转化为氧气,利用化学方程式计算更能准确反映出元素质量变化。
【教学小结】同学们从定量的角度分析出了选择使用高氯酸锂作为紧急供氧剂的原因。当然,因为太空和舱内环境的复杂性,还需要考虑其他更为系统的因素。
在化学发展中,有一位非常著名的计算小能手——里希特。
【化学史实】里希特在质量守恒理论的指导下第一次提出了“化学计算”,创立化学反应中各种物质之间质量比的计算方法。但他试图推导出适用于所有化学反应的数学公式,结果失败了,因为他没有从真实反应入手,考虑到化学物质之间的质量变化关系。
【教学小结】化学方程式计算更能直观地从本质上揭示化学反应中各物质之间的质量关系,化学方程式计算是一种非常重要的计算形式,具有非常广泛的应用,也是同学们必须掌握的一项技能。
(5)天和核心舱中废料的处理和氧气的再生
【问题1】电解水产生的氢气和呼吸作用产生的二氧化碳如何处理呢?
【信息呈现】电解水产生的氢气和呼吸作用产生的二氧化碳早期处理方法是处理后排放到太空中,后来发现利用萨巴蒂尔反应能将二氧化碳和氢气转化为甲烷和水,见图2。
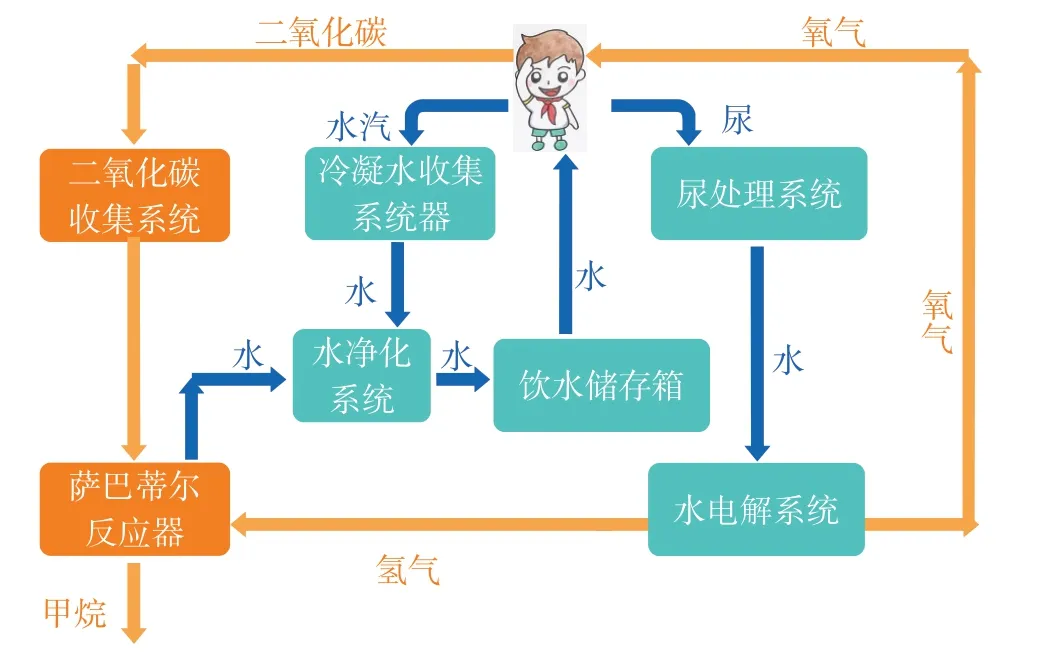
图2 近地空间站物质原位循环再生
【问题2】一名宇航员每天释放的950 g二氧化碳,为一名宇航员供氧的同时产生103.75 g 氢气,试计算两者能否恰好完全反应。(已知CH4+2H2O)
【学生交流】950 g 二氧化碳参与反应时需要约172.7 g氢气,103.75 g氢气参与反应时需要约570.6 g二氧化碳,两者不能恰好完全反应,最终二氧化碳会过量。
【问题3】分析数据发现,现有系统无法实现在太空中物质之间的自给自足和平衡,有没有什么已知体系能够做到这一点?
【学生交流】地球上的生态系统,能够达成生态平衡。
【课堂小结】我国科学家刘红用了很长时间的努力模拟地球生态系统以研究如何在太空中实现生态平衡。2017 年至2018 年,其研究团队进行了时间最长、闭合度最高的生物再生生命保障系统集成实验,4 人370天,自给率达到98%,只需要2%的外界供给,这就是中国航空航天,这就是中国科学,这就是中国力量。
三、教学效果与教学反思
教学之后,基于实际的教学效果对问题理论的教学实践产生了诸多思考。
1.关注问题情境的真实性提升化学学习的应用价值
问题理论要求设计的问题具备真实性。真实性的问题才有现实意义和解决的必要。问题情境的真实性使得教学过程更加真实,脱离了为了计算而计算的简单设定,也让学生理解化学计算在日常生活和化学生活中的真实作用。本课中有一项计算的真实数据:假设一名航天员,身高170 cm,体重70 kg,在中等劳动强度下,需要的热量是2 800 kcal/天,这种条件下每天需要吸收约830 g 氧气,释放出约950 g 二氧化碳。但真实问题中的真实数据带来了水、高锰酸钾和高氯酸锂计算较为复杂、需时较长等问题,不过在课后反馈中学生讨论到计算虽然复杂但应用性很强,同时也加深了对化学定量研究有用的认识。
2.关注问题解决的教学反馈深化化学学习的实际效用
问题理论要求问题解决中能自然地提供反馈,在不断的反馈中修正教师教的方式和学生学的方式,从而提升课堂教学的实效性。在化学计算的由来中讨论为什么分子的实际质量之比与物质的实际质量之比相等,学生反馈得不好,这也在一定程度上说明学生并没有将分子与物质之间的对应质量关系以及原子与元素之间的对应质量关系理解到位,教师利用更具有靶向性的问题促进了学生对于宏微观之间定量关系的理解。
3.关注教学内容的总结促进化学研究的高位发展
问题理论教学中需将核心问题进行分解,但分解后的再次重构与整合对学生能力要求较高,需要教师在每个教学阶段后能进行及时的总结,以提升问题理论的发展性。本课中希望通过航空航天中氧气的供给及废气的处理让学生理解计算的实际意义和巨大作用,同时加深学好化学有利于促进科学技术的进步的认识。这使得教师需要在每一个环节结束后做出两个方面的总结:一是化学知识的总结,二是学生所思所想与航空航天科学家研究之间的关系的总结。例如在学生分析供氧剂选择时,教师需及时跟进说明,学生从化学反应的条件、物质的稳定便携、元素含量的高低等角度认识了化学变化,同时这种选择在一定程度上也与科学家的思考及当前主流的使用方向相契合。

