超声处理修饰羊肌肉蛋白结构改善嫩度的研究
杨裕如,潘德胤,马金明,姜晓娟,陈洪生,*,刁静静
(1.黑龙江八一农垦大学食品学院,黑龙江大庆 163319;2.黑龙江省食品与生物技术创新研究中心(国际合作),黑龙江大庆 163319;3.黑龙江八一农垦大学国家杂粮工程技术研究中心,黑龙江大庆 163319)
嫩度指肉品入口咀嚼组织状态时所感觉的印象,反应肉的质地,是影响消费者满意度和饮食质量的主要因素[1]。羊肉因具有高蛋白、低脂肪、低胆固醇且矿物质元素丰富的特点,已成为深受消费者喜爱的冬季进补肉品之一[2],市场对其的需求量也随即增加。但冬季羊肉为保证销路,羊肉制品通常以冻品保存[3],冻融后的羊肉仍存在嫩度差、水分流失等问题,同时不恰当的处理也会影响羊肉嫩度[4]。因此,在羊肉加工过程中如何改善其嫩度,提高肉的保水性,仍是行业亟待解决的问题。
超声波技术是一种新兴的物理法嫩化手段[5-6],主要通过空化效应破坏溶酶体、肌纤维蛋白和结缔组织,达到最佳嫩化效果[7-8]。Chang 等[9]研究表明,低频、高功率超声(40 kHz、1500 W)处理,可通过降低牛肉半腱肌结缔组织机械强度,使其剪切力降低,但同时伴随肉品水分流失,当超声时间大于10 min时,牛肉表面微观结构破坏显著。超声嫩化多作用于肉品成熟期,并通过延长肉品成熟期和缩短成熟时间,改善肉品嫩度。李正英等[10]发现利用超声对羊后腿肉进行嫩化,可使羊后腿肉剪切力显著降低,后熟时间的延长则可进一步提高羊肉嫩度。张莉等[11]利用超声改善哈萨克羊肉的嫩度,发现羊肉剪切力降低,肌原纤维小片化指数、蛋白溶解度升高,且羊肉成熟时间缩短48 h。
目前,对于超声波嫩化羊肉的研究较少,主要集中在超声波对宰后羊肉成熟期的影响,对成熟期羊肉超声嫩化的研究不够充分;且研究变量多为超声时间,需更深入地研究不同参数条件下对羊肉蛋白结构和品质特性的影响。因此,本文以羊半膜肌肉为研究对象,对其进行超声波嫩化,以拉曼光谱、水分分布、扫描电镜、剪切力等为检测指标,探究不同超声时间和功率对羊肉蛋白结构和肉品质的影响。研究结果可为后续羊腿肉产品开发提供嫩化方案,也可为工业上超声嫩化羊肉条件的选择提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
新鲜羊后腿肉(8 月龄养殖雌绵羊) 购于大庆金锣专卖店。选取羊半膜肌,剔除多余脂肪和结缔组织,切块(3 cm×3 cm×6 cm)称重后真空包装,于-20 ℃储藏,贮藏时间不超过14 d。牛血清蛋白 Takara生物公司;Tris-HCl 缓冲液 北京索莱宝科技有限公司;SDS-PAGE 凝胶配制试剂盒、彩色预染蛋白Marker(10~250 kDa) Biosharp 生物公司;十二烷基硫酸钠(Sodium dodecyl sulfate,SDS) 广州赛国生物科技有限公司;溴酚蓝(Bromophenol blue,BPB)国药集团化学试剂有限公司;冰乙酸 天津市富宇精细化工有限公司;β-巯基乙醇 上海阿拉丁生化科技股份有限公司;所用试剂纯度均为分析纯。
TA-XT plus 质构仪 英国SMS 公司;NMI 20-15低场核磁共振成像仪 苏州纽迈分析仪器股份有限公司;SB25-12DTD 超声波清洗仪 宁波新芝生物科技股份有限公司;CR-410 色差计 Konica Minolta公司;Centrifuge5810 R 高速冷冻离心机 德国Eppendorf 公司;S3400 N 扫描电镜 日本日立公司;DM2700M Ren RL/TL 共聚焦显微拉曼光谱仪 德国Renishaw 公司。
1.2 实验方法
1.2.1 超声嫩化 将切块备用的羊肉样品于4 ℃,解冻12 h,分装密封后放入超声波设备中进行处理。参考朱琪[12]的参数范围并作适当修改,设计实验条件如下:a. 超声频率为40 kHz,超声功率为300 W,超声时间分别为10、20、30、40、50 min 对羊肉样品进行嫩化处理。b. 超声频率为40 kHz,超声时间30 min,超声功率分别为200、250、300、350、400 W对羊肉样品进行嫩化处理。
1.2.2 拉曼光谱的测定 将肉样切成3 mm 薄片放置在载玻片上,采用波长785 nm 离子激光器,功率75 mW,20 倍聚焦镜头聚焦,拉曼光谱扫描范围在500~2100 cm-1。用Origin 2019 软件对数据进行Savitzky-Golay 平滑处理,二阶导数基线校正后,高斯函数分峰拟合,计算二级结构相对含量。
1.2.3 肌原纤维蛋白(Myofibrillar protein,MP)的提取 参考Park 等[13]的方法,实验温度及试剂温度应保持在4 ℃。取20 g 的肉样,加入4 倍体积的提取液(10 mmol/L 磷酸盐、0.1 mmol/L NaCl、2 mmol/L MgCl2和1 mmol/L EGTA,pH7.0,4 ℃)进行蛋白的提取,匀浆60 s 后,冷冻离心3500 r/min,15 min,弃去上清液,上述过程重复3 次。随后加入4 倍体积0.1 mol/L NaCl 溶液,并调节pH 为6.25,随后再次3500 r/min 离心15 min,沉淀即为MP。使用双缩脲法测定蛋白浓度,提取后立即进行电泳样的配制。
1.2.4 蛋白质电泳分析 参考李可等[14]的方法,稍作改动。将浓度为2 mg/mL 的MP 样液与上样缓冲液(4% SDS,20% 甘油,0.02% 溴酚蓝,125 mmol/L Tris-HCl,10%β-巯基乙醇)进行1:1 混合,沸水浴3 min。配制10%的分离胶和4%的浓缩胶,Marker和电泳样进样量均为10 μL。取出后的胶片后用染色液染色1 h,用脱色液洗脱两次至胶片透明。胶片拍照成像后,使用ImageJ 对蛋白条带进行定量分析。
1.2.5 肌原纤维小片化指数(Myofibril fragmentation index,MFI)的测定 参考苏丹[15]的方法。称取4 g 肉样,与40 mL MFI 浸提液(100 mmol/L KCl,7 mmol/L KH2PO4,18 mmol/L EDTA-2Na,1 mmol/L MgCl2,pH7.0,4 ℃)匀浆30 s,于8500 r/min 下冷冻离心30 min,收集上清液,重复2 次。沉淀用MFI浸提液溶解,单层纱布过滤。将提取液浓度稀释至0.5 mg/mL,在540 nm 波长处测定其吸光度。计算出肌原纤维小片化指数公式如下:
式中:A540nm为稀释后样品在540 nm 波长处吸光度值。
1.2.6 剪切力的测定 参照Sheard 等[16]的方法,稍作改动。将超声处理后的肉样放入80 ℃水浴锅内进行水浴,待肉样中心温度为70 ℃时取出。将待检测的肉样沿纤维切成规则的小块(1 cm×1 cm×3 cm),使用HDP/BC 探头进行测量,测定参数为:测前速度2.00 mm/s,测试速度3.00 mm/s,测试后速度10.00 mm/s,距离25 mm,引发力5 g。
1.2.7 pH 的测定 参考朱紫玉等[17]的方法,仪器校准后,将探头没入肉样进行测定。
1.2.8 色度值的测定 参照Chang 等[9]方法,仪器使用白板校准,测定肉样的L*,a*和b*值。
1.2.9 蒸煮损失的测定 参照Honikel 等[18]的方法。肉样称重后于80 ℃水浴45 min,冷却至室温并置于4 ℃过夜,再次称重。羊肉样品蒸煮损失计算方法如下:
式中:W1为肉样重量,g;W2为蒸煮后肉样重量,g。
1.2.10 持水率的测定 参考Naveena 等[19]的方法。将10 g 的肉样与15 mL 0.6 mol/L 的NaCl 溶液置于离心管中,漩涡振荡1 min,4 ℃静置15 min,再次振荡1 min,5000 r/min 冷冻离心15 min,测量上清液体积。
式中:V1为离心后液体的体积,mL;V2为离心管内液体总体积,mL。
1.2.11 T2横向弛豫时间的测定 参考程天赋等[20]的实验方法测定。标品校正后,将超声处理后的肉样切割成规则小块(2.0 cm×0.5 cm×0.5 cm),放入核磁管内,在23.2 MHz 的共振频率下使用CPMG 序列进行测量,扫描16 次,拟合0.01~3000 ms 的弛豫时间。
1.2.12 扫描电镜 根据朱琪[12]的方法稍作修改。将样品切割成规则肉块(0.5 cm×0.5 cm×0.3 cm),置于2.5% 戊二醛(pH7.4)固定2 d,0.1 mol/L 磷酸盐缓冲溶液清洗3 次后,分别使用浓度为50%、70%、80%、90%、100%的乙醇溶液进行梯度洗脱,脱水后的样品用叔丁醇进行置换。冷冻干燥样品后喷金镀膜,使用扫描电子显微镜在电压为20.0 kV、放大倍数为1000 倍条件下进行扫描,观察肌肉结构的变化。
1.3 数据处理
各项实验指标重复测定3 次,结果表示为“平均数±标准差”,数据采用Statistix 8 分析软件,进行单因素方差分析法对数据进行分析,执行Duncan 多重比较分析处理,P<0.05 代表差异显著。采用Sigmaplot 12.5 和Origin 2019 软件作图。
2 结果与分析
2.1 超声波处理对羊肌肉蛋白结构的影响
2.1.1 超声波处理对羊肌肉蛋白二级结构的影响肉在加工过程中蛋白二级结构的变化可以通过拉曼光谱反映出来[21]。由图1 和图2 可以看出,与对照组相比,超声处理组的拉曼强度均发生了不同程度的下降,这主要是由于超声处理使羊肌肉蛋白质密度降低,这一定程度上可以有效提升羊肌肉的嫩度[22]。在拉曼图谱中蛋白S-S 的拉伸位置在500~550 cm-1[23],随超声时间和功率的增加,蛋白S-S 峰强度皆呈现先降低后升高的趋势,这可能是由于超声时间和功率过大,会引起断裂的二硫键发生再次交联。在970 cm-1处,随超声时间和功率的增加,平面弯曲顺式异构体γ(=C-H)强度降低,说明超声对羊肌内脂肪饱和度呈现积极作用[24]。

图1 不同超声时间羊肌肉的拉曼光谱Fig.1 Raman spectra of lamb muscle at different ultrasonic time

图2 不同超声功率羊肌肉的拉曼光谱Fig.2 Raman spectra of lamb muscle at different ultrasonic power
波长为1645~1685 cm-1被指认为酰胺Ⅰ带,常用于研究蛋白二级结构的变化,主要包括位于1645~1660 cm-1的α-螺旋,1665~1680 cm-1的β-折叠、1680 cm-1附近的β-转角和位于1660~1665 cm-1处的无规则卷曲[25]。由表1 可知,随超声时间的增加,α-螺旋含量先降低后增加,在超声20 min 时占比达到最低为20.68%(P<0.05),β-折叠含量则相反,占比达到最大为40.39%(P<0.05),但均与超声30 min时差异不显著(P>0.05)。这与李弓中等[26]的实验结果相一致。
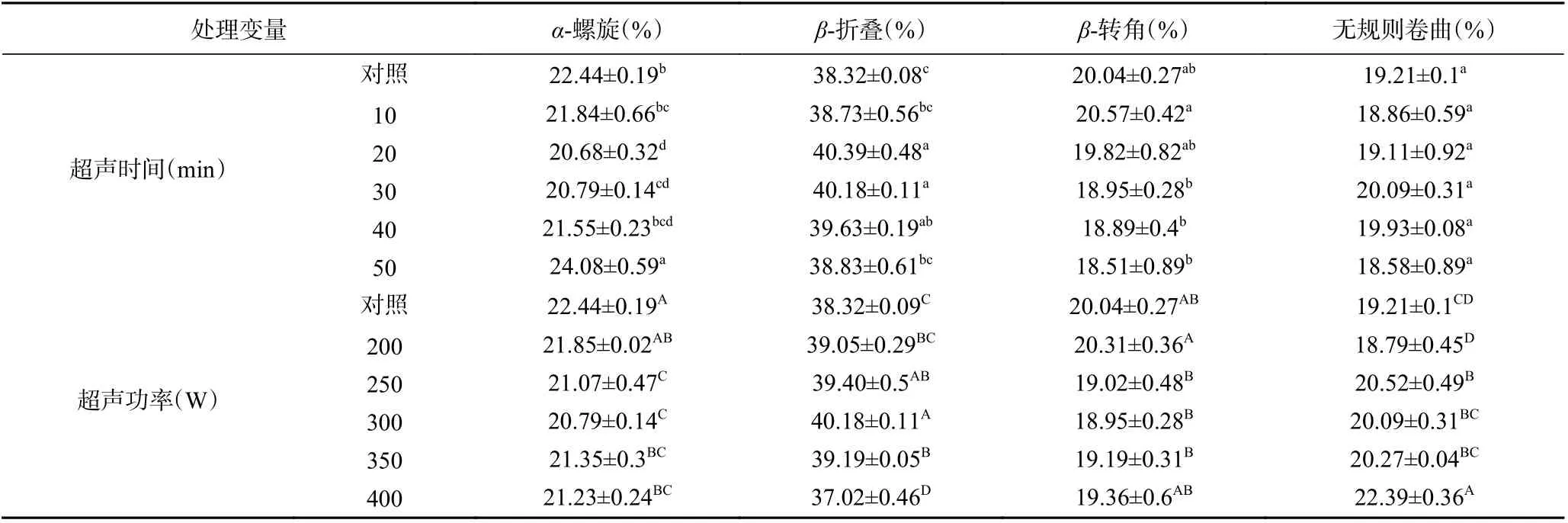
表1 超声时间和功率对羊肌肉MP 二级结构的影响Table 1 Effect of ultrasonic time and power on MP secondary structure of lamb muscle
由表1 可知,随超声功率的增加,α-螺旋含量降低,β-折叠含量先增加后降低,无规则卷曲逐渐增加。在超声300 W 时,α-螺旋含量占比达到最低为20.79%(P<0.05),β-折叠含量达到最大为40.18%(P<0.05);超声400 W 时,无规则卷曲含量占比达到最大为22.39%(P<0.05)。这可能是由于超声波的空化作用破坏了稳定α-螺旋的氢键[16],使其向无序的结构转变,蛋白结构稳定性下降,变得更加松散,从而有利于提高嫩度。Shi 等[27]研究也发现经超声波辅助处理的MP,其α-螺旋向更松散的结构转化,减少了聚集体的形成,降低了蛋白的聚集,使其持水性得到改善。
2.1.2 超声波处理对羊肌肉蛋白降解情况的影响电泳检测到的蛋白条带主要有肌球蛋白重链(Myosin heavy chain,MHC,220 kDa)、C 蛋白(100 kDa)、肌动蛋白(44 kDa)、原肌球蛋白(35 kDa)和降解蛋白质条带(15~20 kDa)[28-29]。
由图3A 可知,超声时间小于30 min 时,MHC、原肌球蛋白、降解蛋白质条带强度逐渐降低。结合表2 发现,与对照组相比,超声10~30 min 时的肌动蛋白相对含量显著增加(P<0.05)。这可能是由于超声波促使肌细胞释放组织蛋白酶和钙蛋白酶,加速了肌动球蛋白的降解[30],从而形成了较多的肌动蛋白。超声30 min 时,肌动蛋白条带颜色加深,且两条带下方出现了明显的条带,产生了较多的中等分子量降解蛋白,量化结果显示肌动蛋白条带相对含量增加至最大,此时肌动球蛋白解离程度也达到最大。当超声处理40 和50 min 时,肌球蛋白上方的大分子条带明显变浅,肌球蛋白条带与30 min 处理组相比强度下降明显,40 min 时肌动蛋白下方出现了明显的新条带;另外,原肌球蛋白条带变浅,降解蛋白质条带变深,说明超声处理导致原肌球蛋白水解明显。此结果与量化结果相一致。

表2 蛋白亚基定量分析表Table 2 Quantitative analysis table of protein subunits

图3 超声处理羊肌肉的SDS-PAGE 模式Fig.3 SDS-PAGE patterns of ultrasonic treatment of lamb muscle
由图3B 显示,超声功率在200~350 W 时,MHC、C 蛋白、肌动蛋白、原肌球蛋白和降解蛋白质条带均随超声功率的增加逐渐变细,颜色明显变浅。降解蛋白质条带在超声功率达到300 W 时达到最浅,这与量化结果相一致,说明小分子蛋白发生显著降解。这可能是由于超声波的空化作用产生的微射流和高压,影响了蛋白分子间的相互作用,产生大量可与水分子结合的作用位点,从而导致蛋白质的二级结构发生了变化[31]。当超声功率到达400 W 时,MHC 和肌动蛋白条带强度显著增强。这与上述拉曼光谱的结果相一致,可能是由于超声波的湍流作用引起断裂的二硫键再次交联,形成聚集体所致[32-33]。
2.1.3 超声波处理对羊肌肉MFI 的影响 MFI 是长度为1~4 个肌节的肌原纤维占全部肌原纤维的比例,与肌纤维内部结构和骨骼蛋白的破坏程度呈正相关[34],与剪切力呈负相关。由图4 可知,随超声时间的增加,羊肌肉MFI 呈现先上升后平稳的趋势,且在超声30 min 达到最大值44.3,与对照组相比差异显著(P<0.05)。由图5 可知,随超声功率的增加,羊肌肉MFI 也呈现先上升而后平稳的趋势,超声功率300 W 达到最大值44.59,与对照组相比差异显著(P<0.05)。这与Carrillo-lopez 等[35]的实验结果相似,MFI 的提升可能是由于超声的空化作用产生的气泡破坏溶酶体,扩大了肌纤维的间隙,使蛋白酶释放从而水解肌纤维蛋白,破坏了肌纤维结构,使其分解成小片段[10,36]。
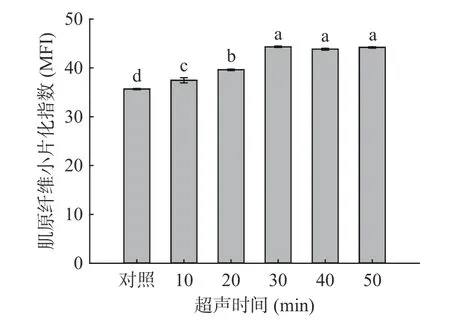
图4 超声时间对羊肌肉MFI 的影响Fig.4 Effects of ultrasonic time on MFI of lamb muscle

图5 超声功率对羊肌肉MFI 的影响Fig.5 Effects of ultrasonic power on MFI of lamb muscle
2.2 超声波处理对羊肉肌肉品质特性的影响
2.2.1 超声波处理对羊肌肉剪切力、pH 及色差值的影响 由表3 中剪切力结果可知,超声处理组的剪切力值均显著低于对照组(P<0.05),随超声时间的增加,羊肌肉剪切力呈先下降后平缓趋势,在超声30 min 时达到最低为32.04 N,随后差异不显著(P>0.05);随超声功率的增加,羊肌肉剪切力呈先下降后平缓趋势,超声 300 W 达到最低为 31.22 N,随后差异不显著(P>0.05)。此结果与 Barekat 等[31]采用高强度超声处理改善肉嫩度的实验结果相一致。这可能是由于超声的机械力和空化作用促使组织蛋白酶释放,并促进钙激活因子的扩散,同时也削弱了肌节的连接力,进而产生了嫩化作用[36]。

表3 超声时间和功率对羊肌肉剪切力、pH 及色差的影响Table 3 Effects of ultrasonic time and power on shear force, pH and color difference of lamb muscle
由表3 中pH 测定结果可知,随超声时间的增加,羊肌肉pH 的变化与对照组相比差异显著(P<0.05),呈先上升后下降的趋势,超声20 min 时达到最大6.07。随超声功率的增加,羊肌肉pH 呈先上升后下降的趋势,在超声功率为300 W 时pH 最大为6.04(P<0.05)。超声处理组pH 整体大于对照组,这可能是由于超声处理使蛋白酶释放,碱性胺类的利用率提高,酸性蛋白基团降低,部分离子释放到细胞外,基团位置改变造成的[11]。
由表3 中色差结果可知,与对照组相比,超声处理对羊肌肉L*值、a*值影响较为明显。随超声时间的增加,处理组L*值显著升高(P<0.05),而a*值显著下降(P<0.05)。这可能是超声的机械作用使肌束松散,释放了肌肉中的瘀血[37],致使L*值增加;并且超声的空化作用抑制了脱氧肌红蛋白与氧气合成氧合肌红蛋白[38],导致a*值下降。
2.2.2 超声波处理对羊肌肉蒸煮损失与持水率的影响 由图6 和图7 可知,随超声时间和功率的增加,与对照组相比,超声处理均先降低了样品的蒸煮损失,而后有所升高,在超声30 min 时蒸煮损失最低为33.47%,超声功率250 W 时,达到最低为32.90%,但与200 W 和300 W 相比差异并不显著(P>0.05)。羊肉样品持水率的测定结果与蒸煮损失结果相对应,即:持水率高,蒸煮损失小,反之亦然。在超声时间30 min 时持水率达到最大值93.59%,超声功率为250 W 时,持水率最高93.94%,与对照组相比差异均显著(P<0.05)。这可能是由于超声的空化作用使肌肉组织中的细胞破裂,水分进入到肌肉细胞内[39];同时肌丝伸长收缩的程度变大,与水分子相结合能力变强,提高其保水能力[40]。结合pH 和MFI的数据可以发现,pH 的增加使纤维间隙变大,MFI的增加有利于肌原纤维蛋白与水结合,捕获更多的水分子,提高其持水率[41]。这些结果与蒸煮损失的结果相对应。
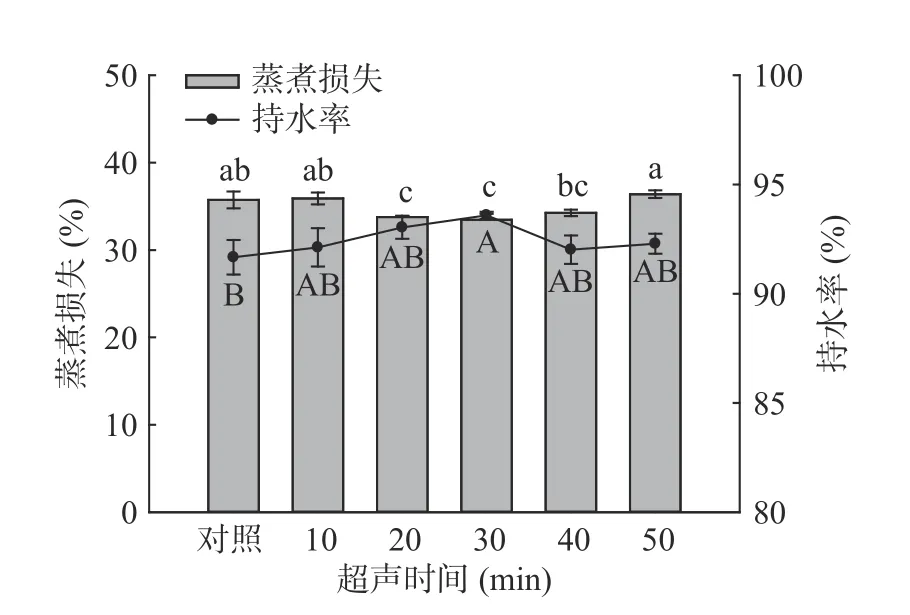
图6 超声时间对羊肌肉持水率及蒸煮损失的影响Fig.6 Effect of ultrasonic time on water retention and cooking loss of lamb muscle
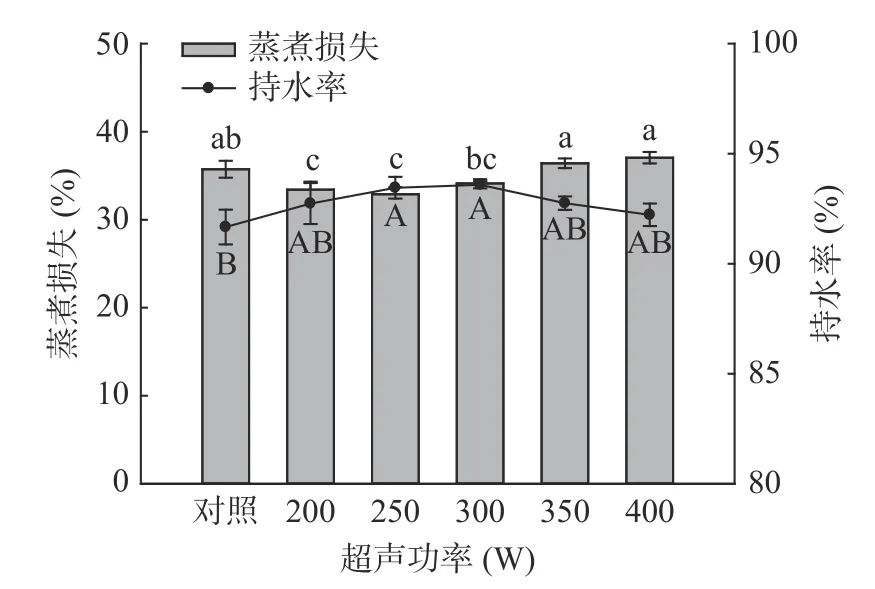
图7 超声功率对羊肌肉持水率及蒸煮损失的影响Fig.7 Effect of ultrasonic power on water retention and cooking loss of lamb muscle
2.2.3 超声波处理对羊肌肉水分分布的影响 根据弛豫时间对水分子的状态进行划分为,强结合水T2b(0~1 ms)、弱结合水T21(1~10 ms)、不易流动水T22(10~100 ms)、自由水T23(100~1000 ms)[42]。
由表4 可以知,随超声时间的增加,各组样品横向弛豫时间先减少后增加,在超声50 min 时弛豫时间与对照组相比显著增加(P<0.05)。随超声功率的增强,各组分横向弛豫时间同样呈现先减少,后增加的趋势,从超声350 W 开始T22与对照组相比显著增加(P<0.05)。说明较强的超声处理,可以使羊肉中不易流动水的自由度增加,与底物蛋白的结合力变弱[43]。
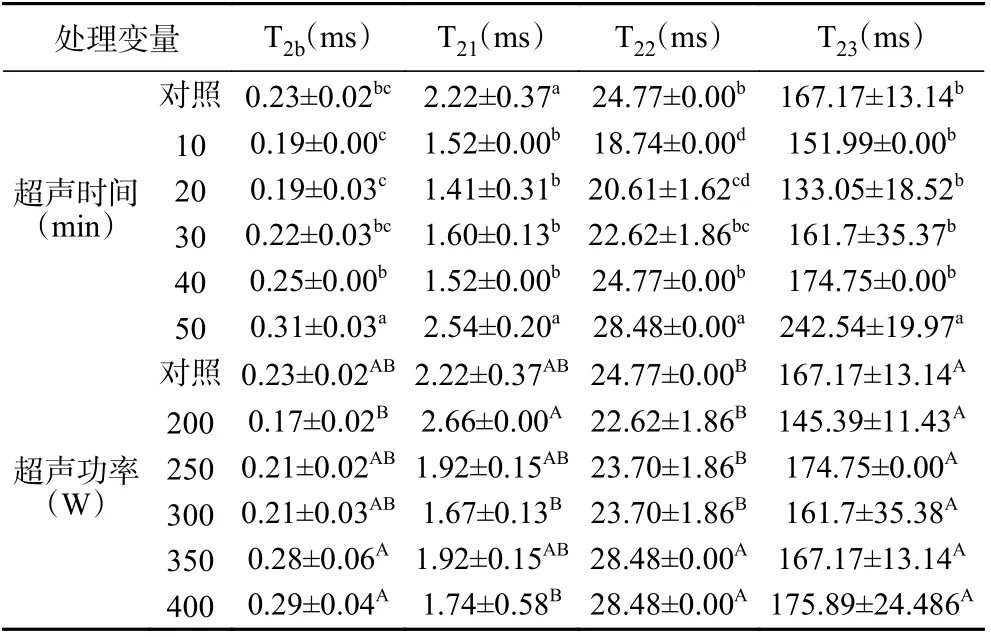
表4 超声时间与功率对羊肌肉T2 驰豫时间的影响Table 4 Effect of ultrasonic time and power on T2 relaxation time of lamb muscle
由表5 可知,超声时间为30 min 时,不易流动水峰比例P22达到最大为96.37%。超声功率为300 W 时,P22最大达96.29%,此时自由水峰比例P23达到最低为0.51%,且与对照组相比差异显著(P<0.05)。图8 和图9 也显示,随超声时间和功率的增加,各组羊肌肉样品的T22峰比例均呈先增大,后减少的变化趋势。这与上述持水率和蒸煮损失的结果相一致。

表5 超声时间与功率对羊肌肉T2 驰豫时间的峰比例的影响Table 5 Effect of ultrasonic time and power on the peak area ratio of T2 relaxation time of lamb muscle
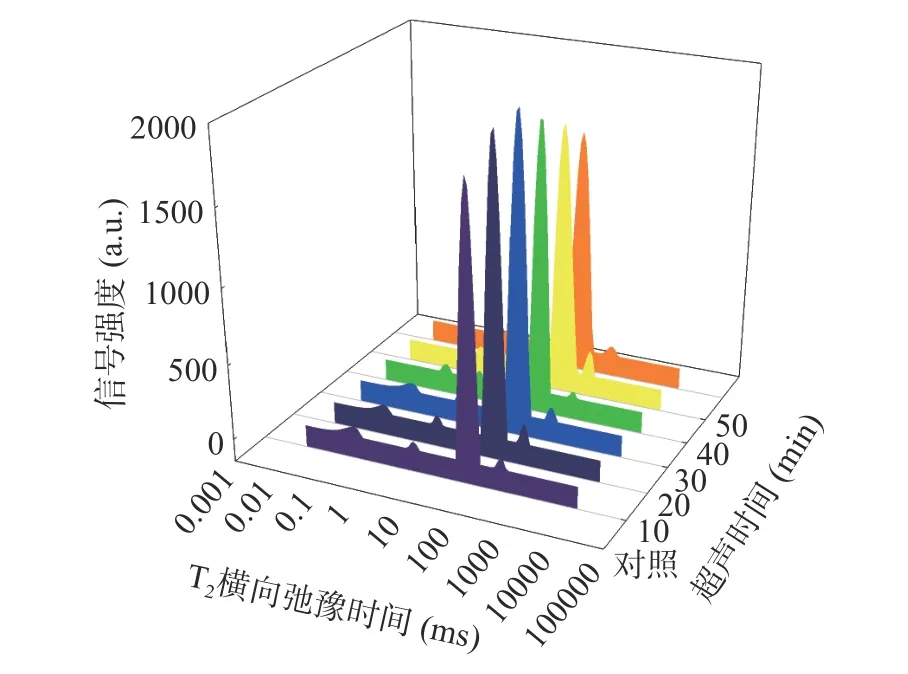
图8 超声时间对羊肌肉T2 横向驰豫时间的影响Fig.8 Effect of ultrasonic time on T2 transverse relaxation times of lamb muscle

图9 超声功率对羊肌肉T2 横向驰豫时间的影响Fig.9 Effect of ultrasonic power on T2 transverse relaxation times of lamb muscle
2.2.4 超声波处理对羊肌肉微观结构的影响 通过分析上述指标的结果,确定选择嫩化效果明显的三组样品进行微观结构分析,即:超声30 min,300 W、超声50 min,300 W 和超声400 W,30 min,对照组不变。
由图10 可知,超声处理对羊肉肌纤维微观结构影响明显。对照组的羊肌肉纤维结构平行完整,肌束膜包裹排列紧密。超声30 min(图10B)使原本分布均匀的肌束膜变得散乱,肌周结构被破坏;超声50 min(图10C)时,肌束膜大部分被瓦解,肌节收缩明显,肌束间间隙变大,完整的纤维结构受损,变成较小的蛋白质单体或片段,使原本平整的表面,变得凸凹不平。这些结果与前述的MFI 结果相一致,并且,陈丽艳等[44]研究超声对鹅肉肌纤维结构的影响时,也发现随超声时间的增加,肌肉组织受损程度显著增大。所以,超声处理羊肉的最适时间为30 min。

图10 不同超声处理羊肌肉的扫描电镜图(1000×)Fig.10 Scanning electron microscopy of lamb muscle with different ultrasonic treatment (1000×)
超声功率为300 W(图10B 和图10C)时,肌束膜有所减少,且变得松散混乱;肌纤维间空隙变大,部分肌纤维呈现小片化。超声功率为400 W(图10D)时,可以明显看出肌束膜大部分被瓦解,肌原纤维裸露,纤维间空隙也更加明显。这与持水率的研究结果相对应,主要原因可能是由于超声的机械作用和空化作用导致肌纤维降解,发生小片化,同时超声处理还可能通过改变蛋白质结构来促进肌膜的分离[45]。
3 结论
超声处理能够有效地改善羊肉的嫩度。不同的超声处理时间和功率可修饰羊肉蛋白结构,改变了羊肉的微观结构,肌束膜被有效降解,肌纤维呈现碎片化,改善了嫩度,提高了肉的保水性。其中超声时间为30 min,功率为300 W 时,羊肉嫩化效果最好,此条件下与对照组相比,羊肉MP 由α-螺旋结构向β-折叠转换数量增加,水分子结合位点增多,肌动球蛋白降解效果达最佳。同时,羊肉肌原纤维小片化指数显著提高到44.59(P<0.05),羊肉剪切力降低至31.22 N(P<0.05),水分子与肌肉蛋白结合紧密,不易流动水占比显著增加,持水率达到93.59%,蒸煮损失显著下降(P<0.05)。经本实验筛选得到的最佳嫩化条件,可为工业上超声波嫩化羊肉提供一定的应用借鉴。

